对宫颈癌移位卵巢位点的初步研究*
2020-03-05胡明宗周本梅贾钰铭雷开键徐国洪
胡明宗,周本梅,贾钰铭,雷开键,徐国洪
644000 四川 宜宾,宜宾市第二人民医院 放疗科(胡明宗、周本梅、徐国洪),肿瘤科(贾钰铭、雷开键)
宫颈癌是女性常见的一种盆腔恶性肿瘤,而放射治疗是宫颈癌主要的治疗手段之一[1-2]。由于卵巢对放射线极为敏感,超过6Gy的吸收剂量即可引发不可逆转的卵巢损害,进而导致卵巢功能的丧失[3],故对于术后需要放疗和保留卵巢功能的宫颈癌患者,可利用卵巢移位术将卵巢移位至盆腔放射野之外,以避免因放疗而损害卵巢功能[4-5]。目前常用的移位方法主要有卵巢上腹部移位术、结肠旁沟移位术、乳房下卵巢移位术和卵巢腹膜外移位术等,这种方法可有效减少卵巢在盆腔放疗中的受照剂量,避免该类患者提前进入绝经期。因此,对于年轻的宫颈癌患者,卵巢移位术是一种安全可行的保留卵巢功能的方法[6-7]。
目前有关卵巢移位术的研究较多,但对卵巢移动的位置和高度没有统一的标准,各实验研究所得结果和结论也存在一定的差异[7-8]。理论上卵巢移动的位置越高,距离放射野越远,卵巢功能保留得越好[6]。在我院,通常将单侧或双侧的卵巢移位至结肠旁沟区域,这种移位方法具有操作简单、并发症较少等优势。因此,本文以我院常用的结肠旁沟移位术为基础,对宫颈癌移位卵巢的不同高度以及每一高度的不同位点进行研究,初步探讨了基于结肠旁沟移位术的卵巢最佳移位点,为移位术的改进提供更多的科学依据,从而更好地保留接受放射治疗的宫颈癌患者的卵巢功能。
1 资料与方法
1.1 一般资料
四川大学“成都仿真人体模型”(ICRU 48 Report成都剂量体模),由四川省肿瘤医院物理室提供。在放疗计划系统中随机选取20例宫颈癌患者的CT图像,其靶区与仿真体模相似。
1.2 放疗设备及材料
Activion东芝16排螺旋CT机、LX-40A模拟定位机(日本东芝医疗公司)等放疗设备,Elekta Focallpro医生工作站、Elekta Mosiaiq网络传输系统、Elekta Xio计划系统、Pacas系统数据库(成都信通医疗)等软件系统,以及低温热塑板(由深圳市腾飞宇科技有限公司生产)等材料,以上均由宜宾市第二人民医院放疗科提供。
1.3 研究方法
运用低温热塑板,在仿真体模上制作一个盆腔热塑膜。在CT机上接受定位CT扫描(扫描层厚为5mm),将扫描图像传至Elekta Focal医生工作站。接着对靶区和“移位卵巢”进行勾画,分别选择髂嵴下1cm、髂嵴上3cm和髂嵴上4.5cm三个高度层面,以右侧结肠旁沟区域为研究部位,从椎旁3cm处依次往侧前方的结肠旁沟区域选定5个位点,分别表示为“a”、“b”、“c”、“d”、“e”,使其呈“C”字形排列,并且位点中心距皮缘4cm,两两间隔1cm(图1)。以此模拟移位于靠近前方(“e”)、侧方(“c”“d”)和后方(“a”“b”)的卵巢。
在Elekta Xio计划系统中,分别对仿真体模制定四野均等给量(0.5Gy/F/野)、四野非均等给量(前后两野均为0.58Gy/F,左右两野均为0.42Gy/F)、前后两野对穿照射(1Gy/F)、左右两野对穿照射(1Gy/F)等四种放疗计划,依次命名为plan1、plan2、plan3、plan4。各计划的处方剂量均设为50Gy/25F,并在计划系统中读取和记录各位点的评估剂量。与此同时,在20例宫颈癌患者的CT图像上实施相同的研究方法,先后完成“移位卵巢”的勾画和放疗计划的制定,并对各位点的评估剂量进行记录。
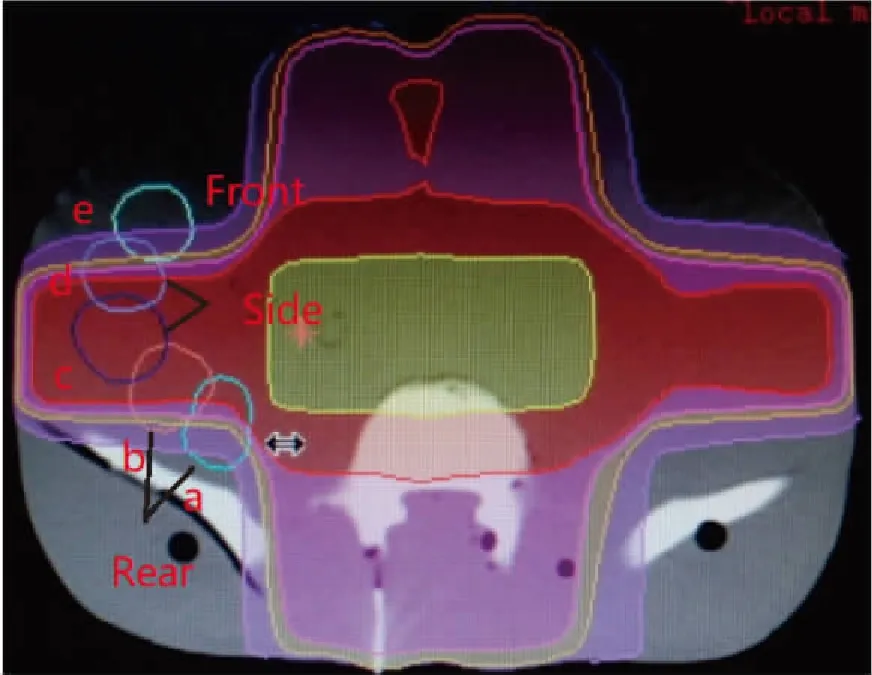
图1 “移位卵巢”的勾画方式Figure 1. Delineation of Transposed OvariesFrom the 3cm side of the cone to the lateral colonic sulcus area, 5 sites were selected in turn, which were respectively designated as ‘a’, ‘b’, ‘c’, ‘d’, and ‘e’ to make them ‘C’. The center of the sites are 4cm away from the skin margin, while guaranteeing the interval between two points is 1cm. This way to simulate ovaries that are located near the front (‘e’), side (‘c’, ‘d’) and rear (‘a’, ‘b’).
1.4 统计学分析
2 结 果
2.1 仿真体模和宫颈癌患者的比较
采用Mann-Whitney U检验方法对两组数据进行对比分析,结果表明宫颈癌患者的评估剂量2.49(24.81)Gy与仿真体模的评估剂量2.60(22.51)Gy的差异无统计学意义(P=0.772,Z=-0.290),由此可认为仿真体模和宫颈癌患者的评估剂量具有良好的一致性。
2.2 不同照射方式对剂量的影响
采用Tamhane’s T2检验方法,对比分析在同一高度层面上不同计划方式的评估剂量,结果表明在髂嵴下1cm和髂嵴上3cm的高度层面上,各计划之间的剂量差异具有统计学意义(P<0.05),而在髂嵴上4.5cm层面的差异则无统计学意义(P>0.05)。并且plan1和plan2在各高度层面的剂量差异均无统计学意义(P>0.05,表1)。同时在剂量体积直方图(dose volume histogram,DVH)中可知(图2),plan1、2、3、4各计划的靶区体积分别为(98.10±1.42)%、(98.58±0.78)%、(95.46±1.65)%和(84.86±0.38)%,即plan1和plan2可获得较高的靶区体积。由此认为使用盆腔盒式进行计划设计所得到的剂量分布具有较好的稳定性。
表1 各高度层面不同计划评估剂量的对比分析Table 1. Comparative Analysis of Assessed Doses for Different Plans at Various
a: Compared with plan 1,P<0.05;b: Compared with plan 2,P<0.05;c: Compared with plan 3,P<0.05.
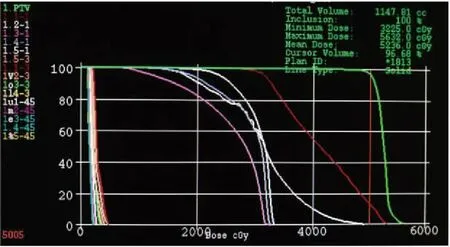
图2 某宫颈癌患者在plan1中的DVH图Figure 2. Dose Volume Histogram of A Cervical Cancer Patient in Plan 1In the figure, 1-1, 2-1, 3-1, 4-1 and 5-1 respectively represent the dose distribution of ‘a’, ‘b’, ‘c’, ‘d’ and ‘e’ at the height of 1cm below the iliac crest; 1-3, 2-3, 3-3, 4-3 and 5-3 respectively represent the dose distribution of ‘a’, ‘b’, ‘c’, ‘d’ and ‘e’ at the height of 3cm above the iliac crest; 1-45, 2-45, 3-45, 4-45 and 5-45 respectively represent the dose distribution of ‘a’, ‘b’, ‘c’, ‘d’ and ‘e’ at the height of 4.5cm above the iliac crest; and PTV represents the dose distribution in the target area.
2.3 不同高度层面对剂量的影响
通过Kruskal-Wallis检验方法对比分析各高度层面的评估剂量可知,各组数据分布的差异具有统计学意义(χ2=96.53,P<0.01)。使用Mann-Whitney U检验方法对其进行两两比较可知,各高度层面的剂量随着高度的增加而显著减小(P<0.05;表2)。同时对各高度层面的评估剂量与3Gy进行单样本t检验可知,髂嵴下1cm层面处位点的评估剂量(32.02±16.92)Gy显著大于3Gy(P<0.01),髂嵴上3cm层面处位点的评估剂量(2.94±1.12)Gy与3Gy差异无统计学意义(P=0.74),而髂嵴上4.5cm层面的评估剂量(1.70±0.22)Gy则明显小于3Gy(P<0.01)。因此认为髂嵴上3~4.5cm为相对安全区域。

表2 各高度层面评估剂量的对比分析Table 2. Comparative Analysis of Assessed Doses at Various Levels
2.4 移动部位对剂量的影响
由2.3可知,髂嵴下1cm层面处位点的评估剂量显著大于3Gy(P<0.01),故不能作为卵巢移动的部位。采用LSD检验方法,对比分析髂嵴上3cm和髂嵴上4.5cm两个高度层面不同照射方式下各移动部位之间的差异可知,在髂嵴上4.5cm层面,plan1和plan2的侧方和前方剂量均明显小于后方剂量(P<0.01)。但考虑到解剖位置的关系,通常不提倡将卵巢移位至前方,因此认为侧方更适合作为卵巢移动的部位(表3)。
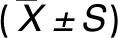
表3 髂嵴上3cm和髂嵴上4.5cm处各移动部位的评估剂量Table 3. Assessed Doses of Different Moving Parts at 3cm and 4.5cm above the Iliac
a: Compared with rear,P<0.05;b: Compared with front,P<0.05.
3 讨 论
近年来,宫颈癌患者呈现逐渐年轻化的趋势[9-11]。放射治疗是宫颈癌患者的主要治疗手段,但尚存在诱发卵巢功能衰竭的风险[12]。虽然胚胎冷冻、卵母细胞冷冻等辅助生殖技术能够在一定程度上保护生育功能,但其适用人群局限、耗时长、费用高、安全性和可靠性未知,目前尚未得到广泛应用[13-14]。而卵巢移位术可有效降低卵巢对放射线的吸收,尽可能地避免放疗引起的卵巢损伤,改善患者的围绝经期症状,提高患者的生活质量[15-17]。临床上对卵巢移动的部位没有统一的标准,包括同侧乳房、侧腹上部和结肠旁沟等区域。如Yamamoto等[18]对结肠旁沟、侧腹区域两个移位点进行了研究,结果表明两者在5年内可保留卵巢功能的比例分别为89.5%、72.7%,并且前者的稳定性较好、并发症较少。通过大量的实验研究证实,结肠旁沟可作为首选的移位点,能较好地保留卵巢功能[19]。
卵巢的吸收剂量与射野大小、距离射野边缘的长度、楔形板以及防护措施的使用等因素有关,其中卵巢与放射野边缘的距离即卵巢移位点的选择是卵巢受照剂量的主要决定因素[20]。Hwang等[6]将宫颈癌患者的卵巢移位至结肠旁沟,通过ROC曲线得到层面高度的最佳临界值为髂嵴上1.5cm;Soda等[4]通过实验研究认为在制定盆腔放疗计划时,应给予双侧卵巢大于2cm的安全界限,从而对卵巢进行有效保护。已有研究表明,卵巢的吸收剂量达到3Gy即可诱发绝经期症状。若能将其限制在3Gy以内,便可使近90%的宫颈癌患者避免发生卵巢不可逆的功能损伤[8]。因此本实验将3Gy作为阈值展开讨论,超过该剂量即可认为存在卵巢衰竭的风险。由于卵巢功能与患者年龄、治疗手段、随访时间等因素有关[7],故本文以徐茜[21]的实验研究为基础,首先在仿真体模上进行初步研究,以此排除上述因素的干扰。同时增加宫颈癌患者的病例数量,深入分析不同卵巢移位高度层面、不同移位点、不同计划等因素对移位卵巢的影响。
实验证实,在宫颈癌放疗中,使用盆腔盒式四野照射可得到较高的靶区体积,此时卵巢的吸收剂量随着移位高度的增加而显著减少,其中髂嵴上3cm层面处位点的吸收剂量略小于3Gy,而髂嵴上4.5cm以上层面位点的吸收剂量则明显小于3Gy,并且完全避开了高剂量区域。故认为髂嵴上3~4.5cm是相对安全区域,可较好地避免移位卵巢发生功能衰竭;在研究不同位点的剂量分布时,由于人体解剖的局限,通常不将卵巢移位至靠前的部位,故本文仅讨论侧方和后方的剂量关系。在各个高度层面上,靠近结肠旁沟侧方的剂量均低于后方,故建议将卵巢移位于结肠旁沟内靠近侧方的区域。同时尽量选择盆腔盒式四野照射,以此减少移位卵巢在放疗中的吸收剂量。
综上,对于接受放疗的宫颈癌患者,建议放疗前在允许范围内将单侧或双侧卵巢尽量上移,至少移位于髂嵴上3~4.5cm,并将其固定于结肠旁沟内靠近侧方的区域。与此同时,在制定放疗计划时,需根据宫颈癌患者移位卵巢的具体位置,尽量采用盆腔盒式四野照射方式,适当调整各射野的剂量,最大程度减少移位卵巢在盆腔放疗中的吸收剂量。从而有效地保护宫颈癌患者的卵巢功能,改善其生存质量。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:本文全部作者均认同文章无相关利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
