体部立体定向放射治疗早期可手术非小细胞肺癌*
2020-03-05董百强王谨综述陈明审校
董百强,王谨 综述,陈明审校
310022 杭州,中国科学院大学附属肿瘤医院/浙江省肿瘤医院 放疗科
原发性肺癌是最常见的恶性肿瘤之一。作为占比75%~80%的病理类型,非小细胞肺癌将被更早、更多地发现[1]。肺叶切除联合纵隔淋巴结清扫是早期(T1-2N0M0)非小细胞肺癌(non-small cell lung cancer,NSCLC)患者的标准治疗手段,可让这类患者的5年总生存率(overall survival,OS)达到60%~70%[2-4]。然而,约30%的患者因高龄或合并严重心、肺等内科疾病而无法或拒绝接受手术治疗[5]。体部立体定向放疗又称为立体定向消融放射外科(stereotactic ablative body radiosurgery,SABR),是在精确定位、精确制导和严密质控下给予肿瘤高剂量、低分割的电离杀伤,同时对周围危及器官(organs at risk,OAR)损伤最小化的技术。目前体部立体定向放疗(stereotactic body radiation therapy,SBRT)已成为早期不可手术NSCLC患者的标准治疗选择[6-7]。在治疗早期不可手术肺癌患者获得令人鼓舞的疗效背景下,人们开始探索SBRT应用于可手术患者的可能性。相比手术切除,SBRT具有无创、可门诊治疗、治疗后可立即恢复活动、可同时治疗多处病变等优点。本文就SBRT治疗早期可手术NSCLC的研究成果进行综述。
1 SBRT用于早期可手术的NSCLC患者
1.1 前瞻性研究
日本多中心II期临床试验JCOG-0403对64例可手术与100例不可手术且经病理确诊的cT1N0M0 NSCLC患者进行分析,主要终点为3年生存率,次要终点包括无进展生存期、复发类型和治疗毒性。所有患者入组前接受多学科评估,满足如下条件纳入可手术组:1)术后一秒用力呼气容积(forced expiratony volume in one second,FEV1)预期值≥800 mL; 2)PaO2≥65mmHg; 3)无严重心脏病和糖尿病,两组患者均接受48Gy/4F放疗。研究结果显示,可手术组患者的3年OS和无病生存率(disease frec survival,DFS)分别为77%、55%,6%的患者出现3级不良反应,无3级以上不良反应和治疗相关死亡发生;不可手术组患者的3年OS和DFS分别为60%、49%,10例患者出现3级不良反应,2例患者发生4级不良反应,无5级不良反应发生[8]。尽管该研究入组患者的中位年龄是78岁,但疗效结果与样本年龄较小的相关研究接近[9-10]。 RTOG-0618试验则对接受54Gy/3F放疗的可手术周围型T1-2N0M0 NSCLC患者的疗效和毒性进行了评估,患者入组前由胸外科医师进行评估,符合以下全部条件视作耐受手术:1)FEV1和肺一氧化碳弥散功能(diffusing capacity of the lungs for carbon monoxide,DLCO)实测/预测均>35%;2)PaO2>60mmHg,PaCO2<50mmHg;3)无严重合并症。中位随访48个月发现,在可分析的26例病例中,只有1例患者出现原发灶复发,预测4年局部控制率(local contral,LC)、DFS和OS分别为96%、57%和56%,2例患者出现3级毒性,无3级以上治疗相关副反应发生[11]。相应研究的信息见表1。
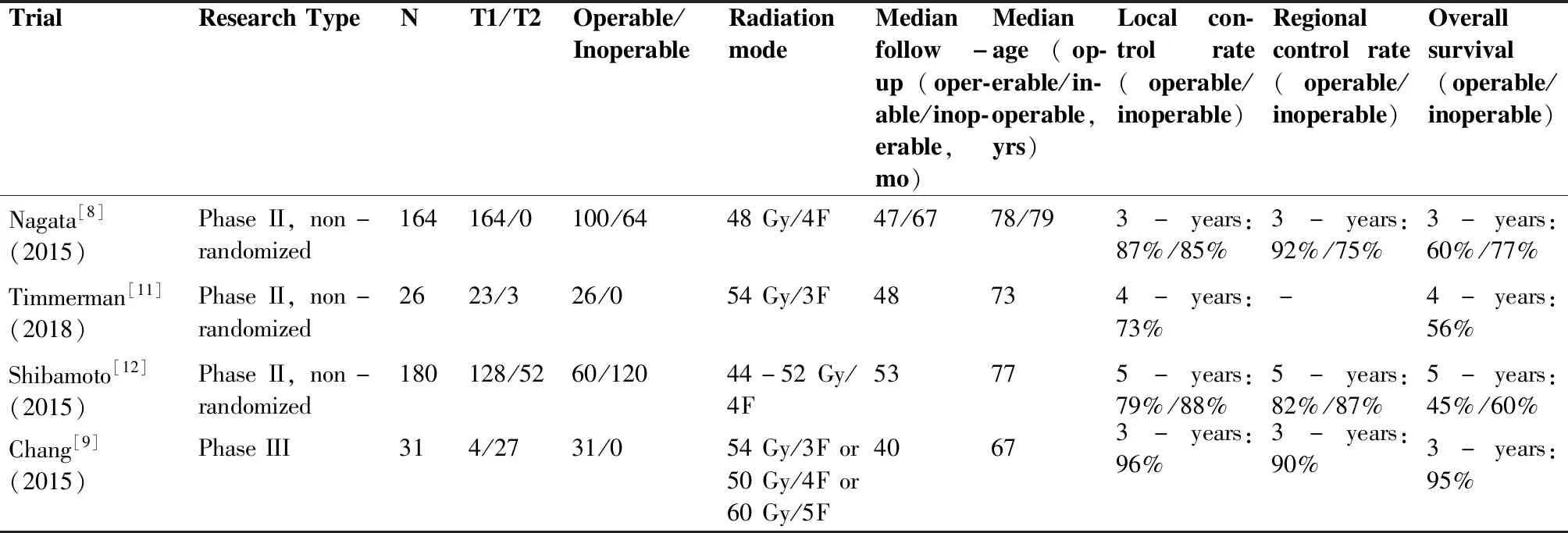
表1 SBRT治疗早期NSCLC相关研究Table 1. Researches of SBRT on Operable Early Stage NSCLC
STARS、ROSEL和ACOSOG-Z4099均为对比SBRT与手术的III期多中心试验,但都因入组缓慢而被迫终止。前两项具有相似的入组标准:两项试验中手术组的所有患者只接受肺叶切除术联合纵膈淋巴结清扫,STARS试验要求组织学明确为NSCLC,而ROSEL试验则不需要;STARS试验SBRT组的周围型和中央型病人别接受54Gy/3F与50Gy/4F分割模式放疗,ROSEL研究仅入组周围型肿瘤,并执行54Gy/3F或60Gy/5F分割模式放疗。Chang等[9]将两项试验合并,SBRT组(31例)与手术组(27例)中位随访时间分别为40.2个月和35.4个月,两组年龄、一般健康状态评分、组织学及分期均无显着差异。报道SBRT组的3年OS显著高于手术组(95%vs79%)。10%的SBRT患者出现3级毒性,无4级以上毒性,而44%的手术患者出现3或4级手术相关不良反应,且1例患者死于术后并发症。STARS和ROSEL试验的综合分析结果表明,与手术组相比,SBRT组患者生存率高并且治疗副反应轻,尽管样本量较小,随访时间较短,但两种治疗方式入组的病例条件是平衡的,这为进行更多比较SBRT与手术的随机试验提供了理由。
截至目前,有5项进行中的前瞻性随机试验对比了SBRT与手术治疗早期NSCLC患者的效果。STABLE-MATES(NCT02468024)是由德州大学西南医学中心发起的一项多中心III期试验,经病理证实的I期NSCLC患者随机接受SBRT(54Gy/3F)或亚叶切除,主要终点是3年OS,次要终点为5年DFS和毒性,预计2024年12月完成。RAXSIA(NCT03431415)是一项加拿大开展的比较I期NSCLC患者SBRT(周围型为48Gy/4F,中央型为50Gy/5F)和手术疗效的随机对照试验,手术组干预为肺段或肺叶切除,主要终点为5年DFS,预计2025年2月完成。RTOG和NGR发起的多中心试验POSTLIV(NCT01753414)由中国医学科学院、山东省肿瘤医院、上海市肿瘤医院和浙江省肿瘤医院共同完成,该试验使≤3cm的周围型NSCLC患者随机接受55Gy/5F qod放疗或根治性切除术+区域淋巴结清扫,主要终点为2年局部区域控制(local regional control,LRC),预计2026年1月完成。VALOR(NCT02984761)比较SBRT(周围型为54~58Gy/3~5F,中央型为50Gy/5F)与手术(肺叶切除或肺段切除)的治疗疗效。患者入组前需接受活检和PET-CT确诊为I期NSCLC,该研究的主要终点是5年OS,预计2027年9月完成。SABR-Tooth(NCT02629 458)是一项旨在探究开展SBRT与手术III期随机试验的可行性研究,目前尚无结果公布。
1.2 回顾性研究
Zheng等[13]对2000年至2012年间发表的63项共计11 000多例NSCLC患者的SBRT和外科研究结果进行荟萃分析。结果显示,与SBRT相比,接受肺叶切除术的患者具有更高的5年OS(66%vs41%);但当年龄和可手术患者占比等变量因素被平衡后,两者OS和DFS不再具有统计学差异。该分析还发现,SBRT组中可手术患者的百分比与OS呈正相关,而可手术患者占比的中位数为12%,说明SBRT研究中大多数患者无法手术,SBRT和外科的患者群体在年龄上也存在显着差异,SBRT患者年龄较大(中位年龄74岁vs66岁)。Berlin等[14]对853例诊断为I期NSCLC的患者进行分析,其中17例接受SBRT治疗。中位随访9.7年,发现放疗组与手术组的肿瘤特异性15年生存率相当,分别为90%和95%。作为回顾性研究,结果受年龄、体能状态、合并症情况等混杂因素影响。
倾向评分匹配(propensity score match,PSM)可在诸多基线因素间进行配对,从而创建一对基线相似的比较组。多项应用PSM比较SBRT和手术疗效的研究结果表现出两者相近的OS、LRC和远处控制率[15-17]。Grills等[18]报道了比较SBRT(n=58)与亚叶切除术(n=69)治疗T1-2N0M0 NSCLC患者的随访结果,该研究的所有患者均无法耐受肺叶切除术。与SBRT组相比,手术组具有更高的OS(72%vs87%;P<0.01),这并不意外,因为95%的SBRT组患者在医学上视作不可手术,另外接受SBRT的患者具有更高的年龄和更严重的医学合并症。两组癌症特异生存率(cancer specific survival,CSS)相同,手术组为94%,SBRT为93%,并且30个月的局部区域复发(local regional recurrence,LRR)、远处转移(distant metastasis,DM)和DFS无显着差异。Yerokun等[19]根据美国国家癌症数据库比较SBRT(n=1 778)和楔形切除(n=4 517)对早期NSCLC的治疗效果。PSM分析显示SBRT与楔形切除相比OS降低(31%vs50%,P<0.001)。尽管在匹配方面做出了最大努力,但该研究的一个重要缺陷是未将肺功能等严重影响生存的指标纳为匹配参数,选择偏倚可能对生存比较产生影响。Zhang等[20]对6项比较SBRT和手术用于NSCLC患者的PSM结果进行了荟萃分析。864例病例以1∶1比例接受SBRT和手术治疗,手术组93%患者接受肺叶切除术。两组1年OS相近,但手术组3年OS较好,1年、3年OS的风险比分别为1.31(95%CI0.9~1.91)和1.82(95%CI1.38~2.40)。两组LC、CSS和发生远处转移风险相同。Shirvani等[21]对 9 093例接受肺叶切除、亚叶切除术和SBRT的早期NSCLC老年患者的真实世界结果进行比较。研究发现,未进行PSM调整前,接受肺叶切除的患者3年死亡率明显低于SBRT组(25%vs45%),应用PSM后,SBRT与肺叶切除的OS相当。相关研究的信息见表2。
可手术I期 NSCLC患者的标准治疗仍是肺叶切除术联合纵隔区域淋巴结清扫,对于这部分人群,有关SBRT的尝试和研究正在增加,越来越多的证据表明手术与SBRT在OS、CSS上可能具有等效性[9,21-27]。与传统的开胸手术相比,微创切除术的发展对患者围手术期护理产生重要影响。电视辅助胸腔镜手术(video-assisted thoracoscopic surgrery,VATS)具有疼痛轻、输血量少、围手术期并发症少、住院时间短、胸导管放置时间短等优点[28],一些应用VATS肺叶切除术治疗高手术风险人群的相关研究发现VATS肺叶切除术具有良好的围手术期效果和长期疗效[29-31]。另外,肺段切除术被视作一种潜在的替代治疗方式,与肺叶切除相比具有非劣效性[9,32-33],但仍需前瞻性随机试验讨论两者的确切等效性,这可能会重新定义早期NSCLC的标准治疗选择。目前,对于手术高风险的患者,由外科医生、肿瘤内科医生和患者等关于SBRT和手术选择的联合讨论应该有助于指导合适的治疗策略,未来的III期试验可能会告诉我们SBRT在可手术肺癌中的作用,为这场持续的争论提供必要的见解。

表2 比较SBRT与手术治疗早期肺癌相关研究Table 2. Researches Comparing SBRT with Surgery on Early Stage Lung Cancer
2 SBRT治疗中央型NSCLC患者
根据国际肺癌研究协会定义,距近端气道、纵隔器官和臂丛2cm内的肺部肿瘤称为中央型肺癌[34]。与周围型肿瘤相比,手术术式一般选择全肺切除术而非肺叶切除,除手术难度大、风险高之外,患者术后恢复差,肺功能减退明显。中央型肺癌放疗增加了气管、支气管、食管、肺动脉和脊髓等关键结构的辐射暴露风险,大分割放疗增加这些结构发生严重毒副反应的可能[35]。自2006年Timmerman等[36]定义“禁飞区”以来,有关中央型肺癌使用SBRT一直存在争议[36-40],其他研究证实已知或揭示新的SBRT相关毒性,如支气管狭窄、坏死和食管溃疡等,更是增加了人们的担忧[35,41-42]。
印第安纳大学的一项前瞻性II期研究分析了接受SBRT的70例不可手术的早期NSCLC患者,其中周围型和中央型NSCLC均以60~66Gy/3F治疗,中位随访17.5个月。尽管2年LC为95%,但8例患者(11%)出现3~4级毒性,6例患者(9%)发生治疗相关死亡。中央型位置被证明是毒性发生的不良预后因素,中央型和周围型肺癌的2年无严重毒性(2级以上)发生率存在明显差异(54%vs83%),证实该放疗方案不可应用于中央型肺癌[36]。HILUS是一项北欧的多中心、非随机前瞻性II期试验,该试验以56Gy/8F治疗中央型肺癌(原发NSCLC或转移)。截至目前,该结果仅以摘要形式呈现。在该研究纳入的74例患者中,3级及以上毒性的发生率为28%,包括6例致命性咯血和1例致命性肺炎。鉴于总体高毒性反应发生率,作者表示需要进一步评估剂量-毒性依赖的危险因素。
RTOG-0813是一项旨在探讨中央型NSCLC患者最大耐受剂量、疗效和毒性的剂量递增试验,研究以50Gy/5F开始,每阶梯增加0.5Gy至60Gy/5F,共纳入120例符合要求病例。研究发现,3例患者出现致命性大出血的5级毒性,其中2例发生在57.5Gy组中,1例在60Gy组中。2019年5月,Bezjak等[43]对该研究进行更新报道:中位随访37.9月,当处方剂量为60Gy/5F时,治疗相关毒性发生率为7.2% (95%CI2.8%-14.5%),72.7%的2年生存率与周围型肺癌疗效相当。Yu等[44]对包含了599例中央型早期NSCLC患者的13项观察性研究进行荟萃分析来探索SBRT的疗效和安全性,结果表明3年LC为72.2%,3+级毒性发生率为12%。正在进行中的EORTC LungTech试验[45]和SUNSET试验[46]将进一步解决中央型和超中央型肺癌人群应用SBRT的安全性和有效性问题。
关于SBRT在中央型NSCLC人群中的研究,荷兰一项回顾性报道分析了60Gy/12F 治疗肿瘤与近端支气管树或食管重叠的肺癌患者,中位随访29个月,LC为100%,但观察到38%的患者出现3级以上治疗毒性,15%的患者出现致命的肺出血,21%的患者可能发生治疗相关死亡。尽管作者指出该结果与接受适形放疗的支气管内肿瘤相关死亡率相似,但15%的5级毒性率令人担忧,故应进一步评估SBRT的适应证[47]。最近美国纪念斯隆凯特林癌症中心的一项研究回顾性分析了超中央型NSCLC患者接受SBRT治疗的毒性效应。患者接受生物有效剂量(biological equivalent dose,BED)为84 Gy或更高的图像引导放疗,主要终点为放疗相关的毒性效应。研究共纳入88例患者(中位年龄74岁),53例(60%)为原发性或局部复发肺癌,35例存在肺转移。大多数患者(n=76)的肿瘤与近端支气管树相邻,23例计划靶区与食管重叠。随访期间19例患者(22%)出现3级或更高的毒性反应。10例患者(11%)出现可能与SBRT相关的致命事件,其中6例出现致命性肺出血,其他4例与SBRT相关的死亡归因于放射性肺炎。2例患者出现气管食管瘘,3级或更高级别毒性患者的1年生存率为78.1%[48]。本研究中2级以上毒性反应和致命毒性事件的发生率较高,但既往一些SBRT研究认为超中央型肺癌接受SBRT不增加相关风险,导致这种研究结论差异的可能原因为超中央型肺癌的定义不同,以及既往研究可能采取了BED较低的治疗方案[49-50]。相关研究信息见表3。

表3 SBRT治疗中央型/超中央型肺癌相关研究Table 3. Researches of SBRT on Central/Ultracentral lung cancer
相关回顾性研究表明,在保证BED10≥100前提下,控制OAR剂量限值和增加分割次数可能可以实现较高LC的同时把毒性控制在可接受水平,但考虑到这些研究的回顾性,人们担心毒性程度被低估[34,52-54]。有结果表明,在保证OAR在剂量限值范围内的前提下,单次10~15 Gy的大分割放疗没有出现严重并发症[55]。JROSG10-01试验表明,只要保证OAR的剂量限制,60Gy/8F治疗中央型NSCLC是安全的[56-57]。在更多长期随访结果和治疗毒性数据公布之前,不可手术的中央型肺癌的SBRT剂量分割选择应谨慎考虑,并严格保证放疗质控,以尽量减少相关毒性。
3 总 结
多项基于PSM对SBRT与手术的比较结果为SBRT在可手术患者的尝试提供了有力证据,更多的前瞻性试验可能会为这场持续的争论提供必要的见解。此外对于中央型肺癌的患者,SBRT被证明是可行、有效的。目前,对于手术高风险的人群,将由外科、放疗科、肿瘤内科医师和患者等进行联合讨论以确定个体化的最佳治疗选择。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:本文全部作者均认同文章无相关利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
