MOBETRON移动式术中电子线加速器临床应用*
2020-03-05张达廖雄飞黎杰
张达, 廖雄飞, 黎杰
610041 成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院 放疗中心
术中放疗(intraoperative radiation therapy,IORT)是指在手术中对不能切除的暴露肿瘤、切除后的瘤床区进行单次大剂量照射,以杀灭残留肿瘤细胞。其优点是在医生视觉、触觉引导下利用限光筒来决定放疗区域,可将正常组织与治疗区域分开,最大限度降低正常组织剂量。IORT是一项多学科联合治疗肿瘤的技术,其顺利进行需要放疗科医生、物理师、外科手术医生、麻醉师和手术护士共同配合完成。四川省肿瘤医院于2017年4月采用MOBETRON 2000型移动式电子线加速器成功实施了西部地区首例IORT手术,同年9月正式开展临床治疗。截至2018年7月,共完成IORT手术46台,现将我们积累的质量保证(quality assurance,QA)数据和操作使用经验总结如下。
1 材料与方法
1.1 设备简介
我院引进的MOBETRON 2000型移动式电子线加速器(IntraOP Medical Inc.,Sunnyvale,CA)具体参数如表1所示,其工作原理及介绍可参见文献[1-3]。
该加速器配有45个不同直径和端面角度的圆柱形限光筒,应用于不同大小和角度的射野。限光筒直径3~10cm,间隔0.5cm一个筒。限光筒端面倾角分别为0、15和30度,另配有一个直径8cm,端面倾角45度的圆柱形限光筒和一个7cm×12cm,0度的矩形限光筒。每个限光筒长50cm,即为有效源皮距,表示虚拟射线原点到限光筒末端的距离为50cm。每个限光筒配有5mm和10mm的组织补偿片,补偿片大小和角度与限光筒相对应。机头配有消毒隔离帽,机头下方安装有一个射线阻挡装置,可与机头联动用于降低杂散辐射污染[4]。
1.2 QA设备
MOBETRON 2000产生3档高能电子线用于治疗,分别为6、9和12MeV,剂量率330MU/min。每档能量配有一个QA测量模体(IntraOP QA Phantom),模体一端用于测量最大剂量深度Dmax,另一端测量50%剂量深度D50。同时,系统配备了1个直径10cm,端面0度的QA专用限光筒,PTW0.6cc指型电离室1个,静电计1台(Model 206, CNMC Instruments Inc.),如图1所示。

表1 MOBETRON 2000型移动式电子线加速器特征参数Table 1. Characteristics of MOBETRON 2000
*MU:Machine unit; SSD: Source skin distance.

图1 质控设备Figure 1. Quality Control Equipmenta:Quality assurance applicator; b:Quality assurance phantom; c:Ionization Chamber; d:Electrometer.
1.3 测试方法
MOBETRON 2000加速器放置于手术室,平时保持关闭状态,只有在治疗当天早上,物理师会开机预热,并对机器进行详细而严密的QA和质量控制(quality control, QC),以确保各射线能量和剂量率在正常范围内。晨检主要包括两方面内容:剂量输出稳定性和射束能量稳定性。测量输出量时使用Dmax模块,测量能量稳定性(D50/Dmax)时使用D50模块,每次出束200MU。
1.4 治疗过程
IORT是多学科联合治疗肿瘤的技术,在实施前需要进行多学科联合会诊,制定出最佳治疗方案;手术当天早上,物理师对加速器进行QA和QC,保证输出剂量误差在3%以内。外科医生将肿瘤切除或暴露后,放疗医生探查瘤床区位置,确定照射范围和深度,并避开周围正常组织和器官。医生和护士安装固定支架,将限光筒固定在合适的位置和角度。护士将无菌隔离帽安装在治疗机头上,并用无菌床单覆盖治疗床,只露出限光筒和反光板。将治疗床推至机头下方,物理师调整机头位置,直到射束中轴与限光筒中轴对准,激光软到位系统发光二极管灯稳定地亮起。当机头与限光筒对准后,两者相距约4cm。所有工作人员撤离手术室后,物理师根据放疗医生给出的处方剂量和治疗深度,选择治疗能量,计算机器跳数,并出束。治疗完毕后,将治疗床推回原位置,加速器各参数恢复原状并关机。外科医生继续进行后续手术。
2 结 果
2.1 百分深度剂量
2.1.1 表面剂量 不同直径,不同端面角度限光筒表面剂量如表2所示。根据GB15213-2016《医用电子加速器性能和试验方法》相关要求[5],医用电子直线加速器产生的电子线的表面剂量用体模表面下0.5mm处剂量表示。
从表2可以看出,表面剂量随能量增加而增加;随直径增加,表面剂量先降低再增加,且在5cm左右最低。
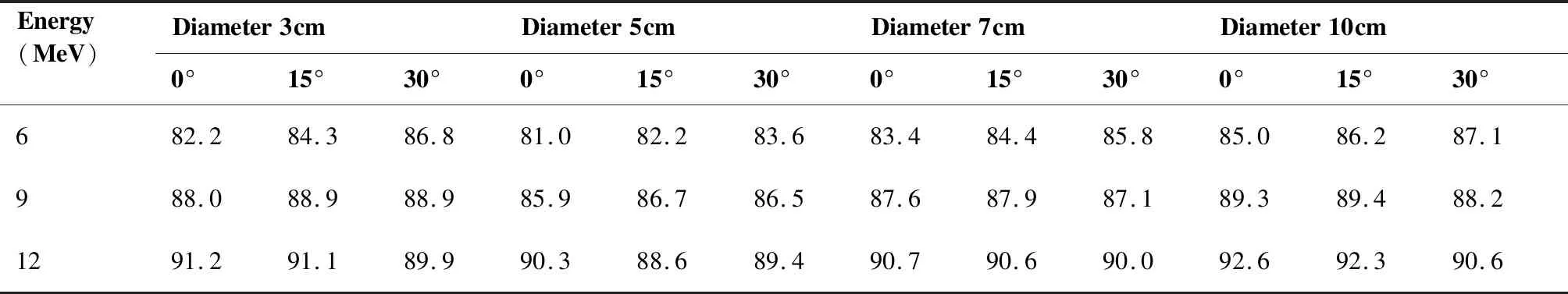
表2 表面剂量(%)统计Table 2. Surface Dose (%)
2.1.2 最大剂量深度Dmax不同直径,不同端面角度限光筒最大剂量深度Dmax如表3所示。由表3可看出,Dmax随能量增加而增加,随角度增加而降低。端面0度的限光筒Dmax随直径先增加后减小,在5cm时达到最大值。
2.1.3 有效治疗深度D90不同直径,不同端面角度限光筒D90剂量深度如表4所示。
临床上一般使用90%Dmax深度作为有效治疗范围[6],由表4可知,D90随能量增加而增加,随角度增加而降低。

表3 最大剂量深度(mm)统计Table 3. Depth of Maximum Dose (mm)
2.1.4 实际射程Rp 不同直径和端面角度的限光筒电子线实际射程Rp如表5所示。
Rp定义为电子深度剂量曲线下降最陡峭处切线与轫致辐射形成的背景外推线交点的深度[7]。由表5可看出,端面0度,直径10cm的限光筒在能量12MeV时Rp最大为59.8mm。Rp随能量增加而增加,随端面角度降低,0度和15度Rp变化不大,30度限光筒Rp快速下降。
2.2 每日QA数据
2.2.1 输出稳定性分析 各档能量输出稳定性如图2所示。由图可见,MOBETRON的输出剂量稳定性都在±3%以内,满足要求。

图2 3档能量Dmax输出剂量Figure 2. Dmax Output Dose of 3 Patterns of Energy
2.2.2 能量稳定性分析 MOBETRON电子线各档能量的稳定性用D50/Dmax进行分析,如图3所示。由图可以看出,3档能量稳定性满足美国医学物理师协会TG72号报告要求,即6MeV允许误差范围为(-12.2%~12.5%),9MeV为(-13.3%~13.7%),12MeV为(-11.5%~11.9%)[3]。

图3 3档能量稳定性(D50/Dmax)分析Figure 3. Stability of 3 Patterns of Energy (D50/Dmax)
2.3 IORT病例数据
2017年5月~2018年7月,我院共进行IORT手术46例。具体病例数如图4所示。
由图4可以看出,胰腺肿瘤接受IORT的比例最高,共29例,占63%。其次为骨与软组织肿瘤,共7例,占15%。
在46例病例中有39例为1射野,6例2射野,1例3射野照射。其中29例胰腺手术全部采用1射野,胰腺手术限光筒使用情况见图5。由图5可以看出胰腺手术使用的限光筒直径多为5cm,有13例,占44.8%。4cm和5.5cm直径各5例。
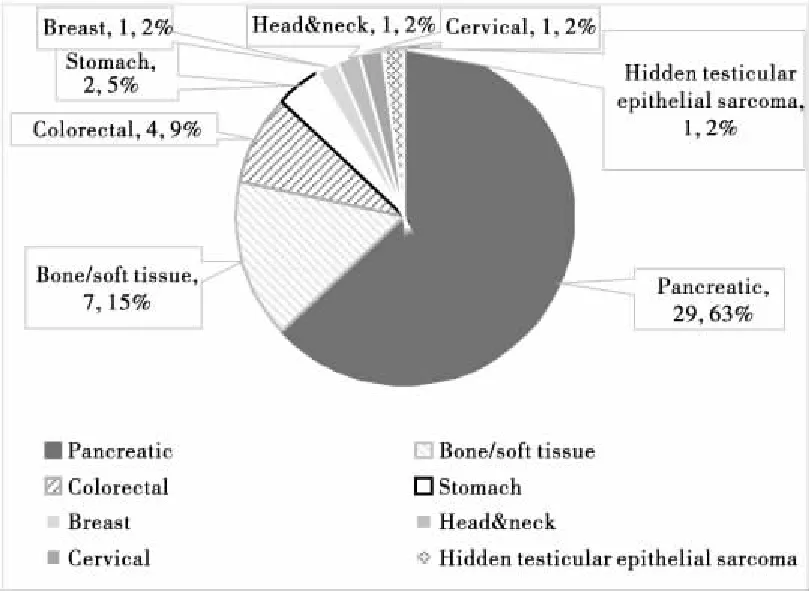
图4 病例统计Figure 4. Case Statistics

图5 胰腺手术限光筒使用情况Figure 5. Statistic of Applicator Used in Pancreatic Cases
骨/软组织外科有2例2射野,1例3射野,胃肠外科有2例2射野,结直肠和宫颈各有1例2射野。
在39例1野照射病例中,12MeV能量有25例,占64.1%,其中胰腺病例为23例,结直肠2例。9MeV能量有8例,其中胰腺6例,占75%。6MeV能量6例,骨/软组织有4例,占66.7%。胰腺手术照射深度约为3cm,射线能量12MeV或9MeV;骨与软组织肿瘤照射深度较为表浅,靶区面积大,多采用多射野连接照射,照射深度在1cm左右,能量多为6MeV和9MeV,且多使用补偿片,以减少治疗深度。在全部46例病例中,仅11例使用补偿片,而7例骨/软组织IORT中就有6例使用补偿片,可见骨/软组织IORT照射深度较浅。在限光筒角度选择上,0度有33例,占71.7%。
3 讨 论
IORT利用低能光子或高能电子线对肿瘤组织或瘤床区进行单次大剂量照射,其剂量跌落陡峭,且可以将正常器官移出靶区外。IORT可单独使用,也可与外照射(external beam radiation therapy,EBRT)相结合进行局部治疗,以提高局控率[1]。目前的EBRT大多采用高能光子束。三维适形和调强技术的发展可以有效降低正常组织受量,但对射线敏感组织附近的肿瘤或者对射线不敏感的肿瘤组织,治疗效果有限。而IORT可以在医生视觉、触觉引导下直接对瘤床区或肿瘤组织进行单次大剂量照射,同时避开周围正常组织和器官;对于肿瘤后面的正常组织的受量可通过调整射线能量来控制照射深度。如果靶区内有正常组织,可将其移出靶区范围。IORT一般只有一个射野,且源皮距固定,这有利于简化治疗计划设计。通常物理师只需要根据限光筒直径、端面角度、治疗深度,选择适当的射线能量,并计算机器跳数。每个限光筒的剂量分布在对机器验收时已进行测量,并记录下来;同时,不同限光筒和射线能量所对应的机器跳数也记录下来,用于治疗时计算机器跳数。
我院引进的MOBETRON 2000型移动式电子线IORT加速器,其电子线准直性好,高度聚焦,因此产生的杂散辐射较少。在常规光子线EBRT中,由于皮肤建成效应,表面剂量较低;而MOBETRON采用高能电子线直接对暴露的肿瘤或瘤床区进行单次大剂量辐照,表面剂量在90%左右,3档能量的Rp最大均不超过60mm,能有效保护靶区后组织,且剂量率较高。与光子线EBRT相比,术中电子线照射治疗时间更短,表面剂量更高,靶区剂量分布更均匀。但IORT专用加速器存在两方面的不足,一是无法像EBRT一样设计放疗计划,二是由于其每一脉冲剂量较高(3~12 cGy/pulse),很难使用放疗标准剂量计测量[1]。由于加速器机头移动范围有限,因此对患者摆位、手术切口和限光筒端面角度选择都有一定的要求;同时,麻醉机、监护仪等设备和医生手术操作习惯等也需要在术前考虑。安装好限光筒后,应尽量使限光筒端面与机头平行,以利于物理师调整机头位置,节省调节时间。物理师调节激光软到位系统是一个比较耗时的过程,机头可在5个方向上进行调节,调节任一方向,均会引起其余4个方向的变化。物理师通过激光位置点来判断调节方向,需要多次微调,不断缩小误差范围,直到激光软到位灯稳定地亮起。此时机头与限光筒之间的距离约为4cm,机头与限光筒之间通过激光反射来确定位置偏差,精度小于1mm[8]。激光软到位系统还会受到呼吸运动的影响,尤其在胸腹部IORT时,可能会使位置偏差增大而导致治疗中断,因此,需要麻醉师适当减小患者呼吸幅度,并加深麻醉[9]。
目前,我们对MOBETRON IORT加速器共进行了60多次检测,其输出剂量均在±3%以内,剂量学参数较稳定,能满足临床应用要求[10]。根据美国医学物理师协会TG72号报告,能量稳定性的评价方式为IORT加速器百分深度剂量曲线左右各平移1mm后,射线能量改变的范围[10]。根据该报告[10],我们使用加速器自带的QA模体进行测量,并计算出3档能量的允许误差范围。IORT属于单次大剂量照射,对剂量准确性要求较高,因此,每次实施前,物理师会对加速器进行QA和QC,并将检测结果记录下来,以便剂量计算时进行修正。为保证患者得到准确、安全、可靠的治疗,需要设计一套规范合理的QA程序,以确保整个系统的准确性和精确度。为此,我们根据设备厂商提供的QA系统和程序,结合手术室特殊的防护环境,并参考TG72号报告[10],建立了一套合理有效的日常QA程序。
IORT目前主要应用于局部晚期和复发或反复发生的肿瘤,尤其是EBRT已不再适用的患者[11]。近年来,IORT在治疗早期乳腺癌方面也取得了可喜的效果[12-14]。我院已完成的46例IORT手术中,胰腺肿瘤最多,其次为骨与软组织肿瘤。IORT作为胰腺癌的综合治疗方法之一,可以提高局控率,延长生存时间,改善患者生活质量[15-17]。我院骨与软组织外科于2018年4月开展第一台术中放疗后,IORT患者数量增长较快。IORT在提高骨与软组织肿瘤疗效的同时还能保留骨与软组织部分功能,在肿瘤局部控制上占有明显优势[18-20]。骨与软组织肿瘤也是使用接野照射最多的,这是由于患者靶区较大,一个射野无法完全覆盖所有靶区,或者靶区间隔较远。但接野治疗存在一定问题,包括如何衔接才能确保靶区既不遗漏又不出现过高剂量,相接处剂量分布如何等,需要行进一步的研究。IORT采用单次大剂量照射,剂量一般在十几到几十Gy,与常规分割照射不同,IORT这种单次大剂量照射首先破坏肿瘤血管的内皮细胞,继而引起肿瘤自身免疫反应,能有效抑制肿瘤细胞繁殖周期中细胞的再氧合和再分布[21]。在放射生物学理论中,单次照射的治疗比比常规分割照射低,但由于IORT照射区域较小,且可将正常组织移出靶区外,因此其对正常组织的损伤大大降低。另一方面,Sindelar等[21]通过实验证明单次剂量小于25Gy一般不会产生毒副作用。由于肿瘤局控率与总剂量之间存在明确的关系,因此,可以通过IORT与EBRT相结合来提高总体剂量,以获得更好的局控率。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
