III-pN2期非小细胞肺癌术后复发模式分析:对术后放疗临床靶区体积范围的建议*
2020-03-05周娇刘志刚朱苏雨罗晴符胜男刘丰鑫周继开夏成程
周娇,刘志刚,朱苏雨,罗晴,符胜男,刘丰鑫,周继开,夏成程
421000 湖南 衡阳,南华大学 研究生院(周娇、刘丰鑫、周继开、夏成程);519000 广东 珠海,中山大学附属第五医院 肿瘤中心(刘志刚);410006 长沙,湖南省肿瘤医院/中南大学湘雅医学院附属肿瘤医院 肿瘤放疗科(朱苏雨);410013 长沙,中南大学 湘雅医学院(罗晴、符胜男)
在可手术切除的III-pN2期非小细胞肺癌(non-small cell lung cancer,NSCLC)患者中,术后局部复发和远处转移频繁发生[1]。研究表明术后化疗可减少远处转移[2],但即使是在根治切除术及辅助化疗后,局部肿瘤复发的风险仍高达20%~40%[3]。有文献报道术后放疗(postoperation radiotherapy,PORT)可使III-pN2 期NSCLC患者的局部复发率降低20%[4],总生存期(overall survival,OS)延长13%[5],但近期研究显示PORT无OS获益[6]。因此III-pN2期NSCLC根治切除术后,辅助放疗的地位并不明确,期待LUNG ART研究[7]为III-pN2期NSCLC PORT提供明确指导。此外,术后局部复发问题及寻找PORT获益人群日益重要,已有相关研究显示阳性淋巴结数目、比值及状态、T分期、分化程度、血小板与淋巴细胞比值等因素与生存预后相关[6,8-13],而目前大多数研究都尚未确定与局部复发相关的独立因素。
目前III-pN2期NSCLC PORT靶区勾画无统一共识[14]。不同侧肺癌临床靶区体积(clinical target volume,CTV)范围需要基于外科手术、淋巴结受累的分布以及纵隔淋巴引流的影像学证据来设置[15-16]。2010年Spoelstra等[17]总结到,在术后不同阳性淋巴结术后靶区勾画所需包括的淋巴结区域(lymph node station,LNs)中,LNs4、LNs7被包括在所有的推荐CTV内。但不同癌症中心PORT CTV勾画除在包括残端、同侧肺门、阳性淋巴结及隆突下淋巴结达成共识外,是否包括其他高危淋巴结存在一定差异。因此,本研究回顾性分析III-pN2期NSCLC患者术后复发的高危因素,并依据III-pN2期NSCLC术后复发具体部位及频率为PORT CTV范围提供参考。
1 资料与方法
1.1 患者特征及入选标准
本研究回顾性纳入2013年1月至2016年12月我院术后病理证实为III-pN2期[国际抗癌联盟(Union for International Cancer Control,UICC)TNM第8版分期标准]的NSCLC患者。收集患者的性别、年龄、临床分期、吸烟情况、手术、辅助治疗及预后情况等基本临床资料。纳入研究标准:患者术前美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG),一般体力状态评分≤2分;脑MRI、ECT、腹部超声等检查未发现远处转移;术后病理证实为III-pN2期;切缘阴性;术后接受化疗;第一次复发或转移时的影像学资料完善。排除标准:不满足入选标准;接受新辅助治疗(化疗和/或放疗);术后接受放疗;术后仅辅助靶向治疗;同时或相继出现第二原发肿瘤的患者。本研究已获得我院伦理机构审查委员会批准。
1.2 治疗
1.2.1 手术 外科手术采用肺癌根治术,包括肺叶或全肺切除和系统性纵隔淋巴结清扫,按照肺癌国际根治切除术定义为[18]:显微镜下所有切缘阴性,系统淋巴结切除(≥3组肺内及肺门淋巴结,≥3组包括隆突下淋巴结在内的淋巴结),无淋巴结结外侵犯,纵隔最高淋巴结阴性。
1.2.2 术后化疗 术后3~4周常规接受以铂为基础的辅助化疗,中位化疗周期为4周期(1~6周期)。
1.3 随访
患者术后2年内每3个月随访一次,2年后每6 至12个月随访一次。标准随访评估包括体格检查、生化检查、胸部CT扫描、头部CT扫描和腹部超声或CT扫描。局部复发评估包括临床评估、影像学检查和/或病理报告。通过查阅患者电子病历及电话调查取得跟进资料。随访截止日期为2018年12月31日。
1.4 评价指标
无局部复发生存期(local recurrence-free survival,LRFS)定义为手术至首次出现局部复发时间; OS定义为手术至死亡时间或末次随访日期;局部复发定义为累及支气管残端、肺门、纵隔、锁骨下或锁骨上淋巴结的肿瘤复发;所有其他复发部位定义为远处转移;复发淋巴结定义考虑满足以下三点:1)当新发或肿大淋巴结在CT上短轴长度≥1cm;2)肿大淋巴结进行性增大或抗肿瘤治疗后呈缩小趋势;3)PET-CT示高代谢影或经病理证实,则无论其大小都定义为复发淋巴结。根据2009年国际肿瘤研究协会(International Association for the Study of Lung Cancer,IASLC)淋巴结图谱评估纵隔或肺门肿瘤复发部位[19],术后分期采用UICC TNM第8版分期标准[20]。
1.5 统计分析
使用IBM-SPSS 22.0版本统计软件进行数据分析。采用Log-rank检验评价各协变量与LRFS的相关性,进一步行多变量Cox回归分析计算HR及95%CI,其中单因素分析P<0.1者进入多因素分析,P<0.05认为具有统计学差异。
2 结 果
2.1 临床资料
根据入排标准,本研究共纳入III-pN2期NSCLC患者105例。确诊时患者中位年龄为55岁(39~75岁),中位随访时间为38个月(4~67月)。回顾性分析患者的性别、年龄、吸烟情况、肿瘤分期、淋巴结状态、治疗详情、局部复发、生存情况等。105例患者中50例(47.6%)、63例(60.0%)、52例(49.5%)分别出现局部复发、远处转移及死亡,中位LRFS及OS分别为17个月和29个月;2年LRFS及OS率分别为62.1%和78.3%(表1)。
2.2 局部复发与远处转移
50例(47.6%)患者术后出现局部复发(首次或累积复发),其中术后首次局部复发并伴有远处转移患者占36.2%(38/105),见图1;大多数局部复发患者诊断时即伴有远处转移,本研究中首次局部复发时伴远处转移患者占总局部复发患者比率为76.0%(38/50)。所有患者均经CT证实局部复发,部分经病理检查或PET-CT证实。
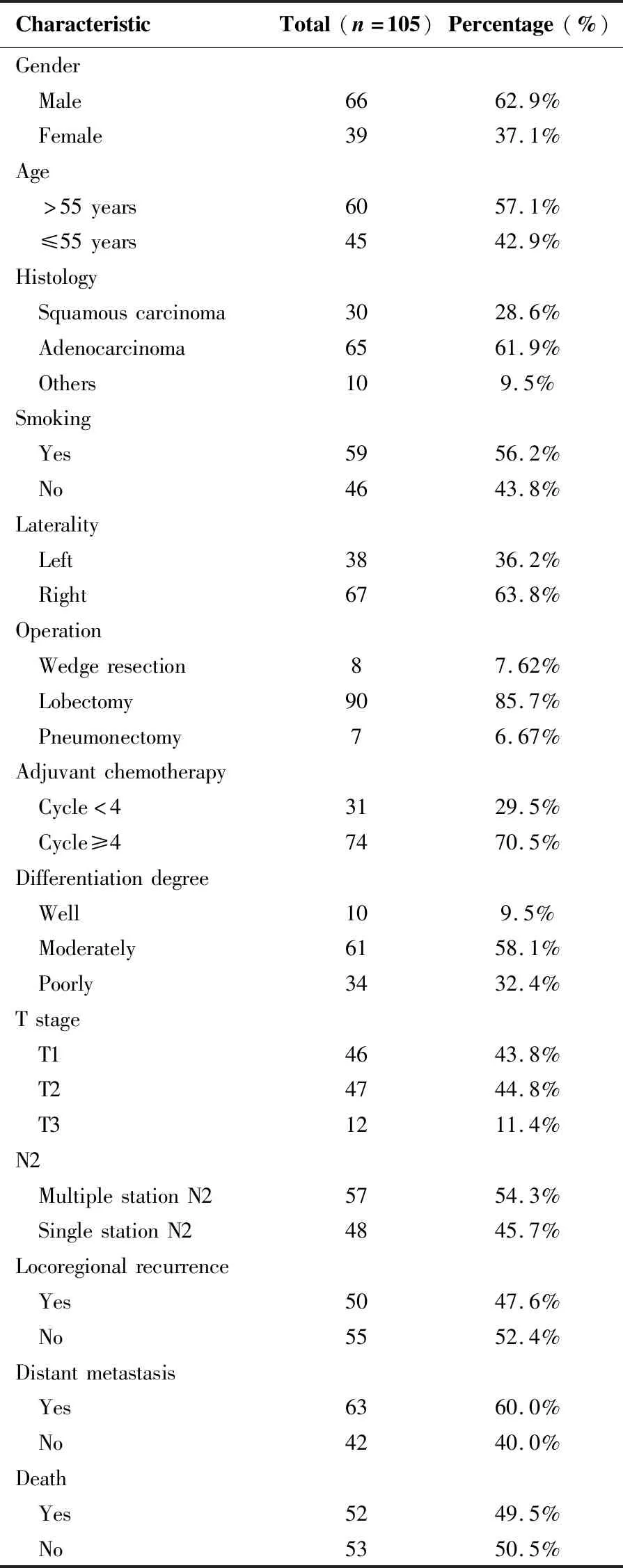
表1 患者一般临床资料Table 1. Characteristics of Patients
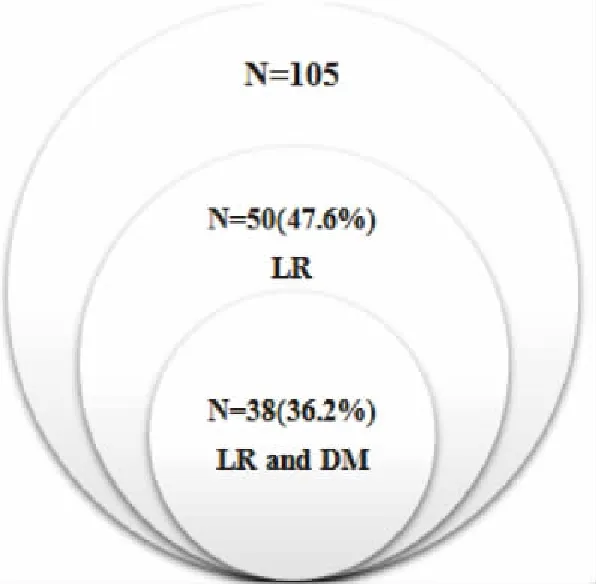
图1 局部复发占比及局部复发同时远处转移占比图Figure 1. Percentage of LR and Percentage of LR and DMLR: Local recurrence; DM: Distant metastasis.
2.3 LRFS单因素及多因素分析
影响患者术后局部复发的临床病理因素详见表2。在单因素分析中,T分期(P=0.004)、年龄(P=0.049)、原发肿瘤大小(P=0.029)、分化程度(P=0.014)、pN2淋巴结站数(P<0.001)、阳性pN2数目(P=0.001)及阳性pN2比值(P<0.001)与局部复发显著相关。多因素分析显示多站pN2与LRFS显著相关[HR2.020,(95%CI,1.245~3.278),P=0.004];此外,阳性pN2的比率[HR1.705,(95%CI,1.054~2.758),P=0.030]、分化程度[HR1.610,(95%CI,1.112~2.329),P=0.012]和年龄[HR1.529,(95%CI,1.001~2.333),P=0.049]也是LRFS的独立预测因素。
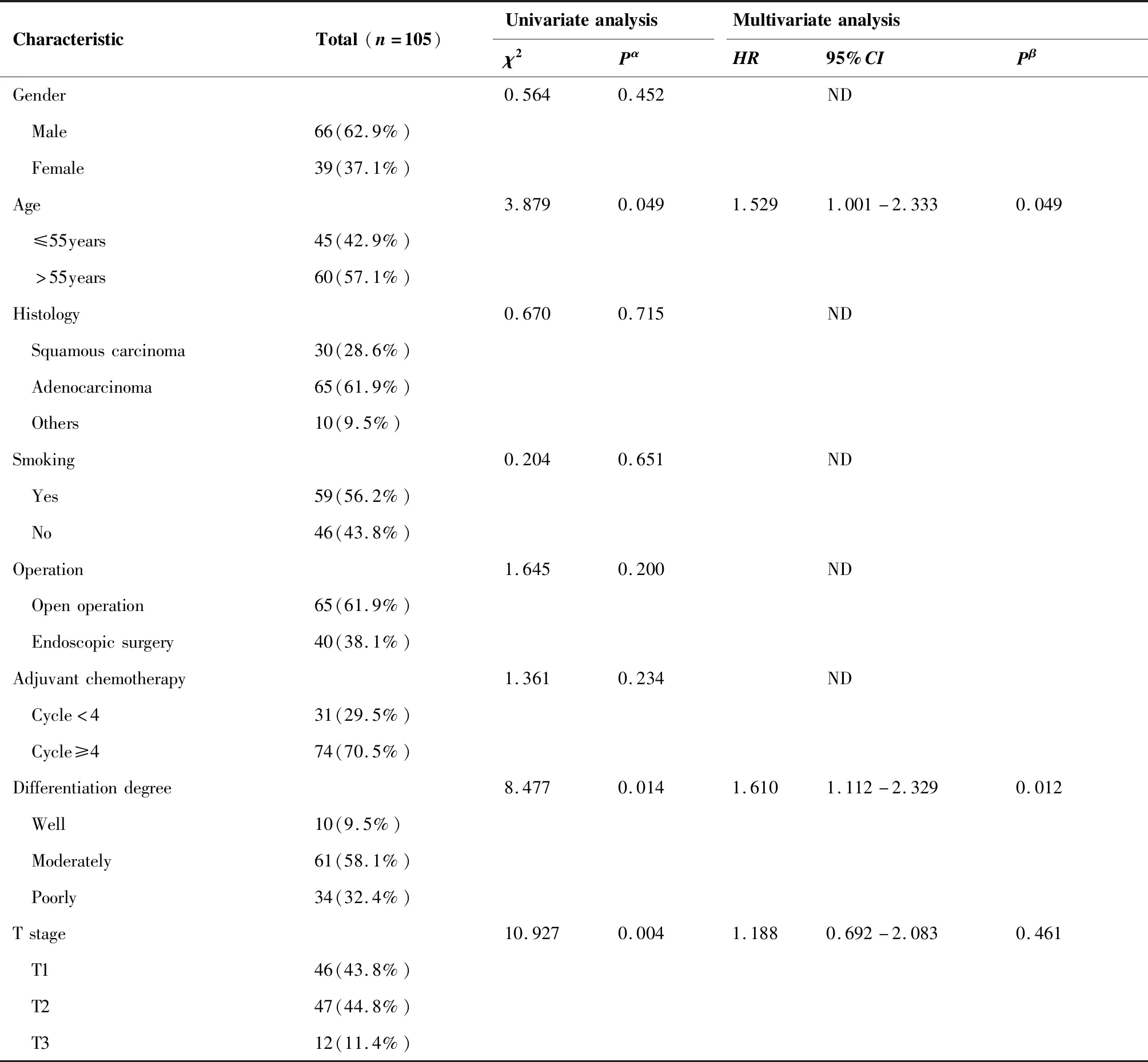
表2 LRFS单因素及多因素分析Table 2. Univariate Analysis and Multivariate Analysis of LRFS
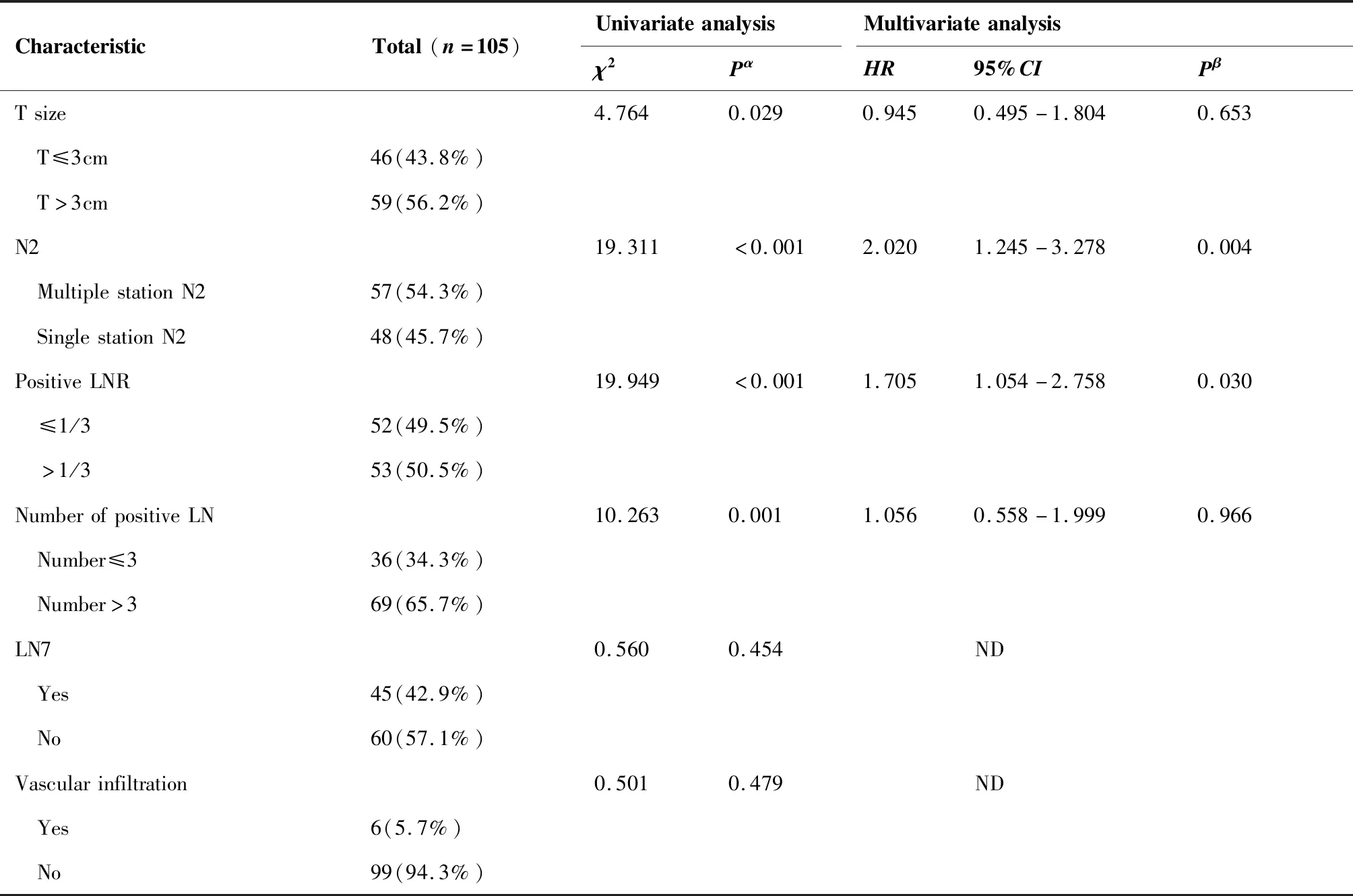
CharacteristicTotal(n=105)UnivariateanalysisMultivariateanalysisχ2PαHR95%CIPβTsize4.7640.0290.9450.495-1.8040.653 T≤3cm46(43.8%) T>3cm59(56.2%)N219.311<0.0012.0201.245-3.2780.004 MultiplestationN257(54.3%) SinglestationN248(45.7%)PositiveLNR19.949<0.0011.7051.054-2.7580.030 ≤1/352(49.5%) >1/353(50.5%)NumberofpositiveLN10.2630.0011.0560.558-1.9990.966 Number≤336(34.3%) Number>369(65.7%)LN70.5600.454ND Yes45(42.9%) No60(57.1%)Vascularinfiltration0.5010.479ND Yes6(5.7%) No99(94.3%)
αKaplan-Meier;βCox regression analysis;
LRFS: Local recurrence-free survival; HR: Hazard ratio; CI: Confidence interval; LNR: Lymph node ratio, defined as the ratio of positive lymph nodes to the total number of lymph nodes removed; LN: Lymph nodes; ND: Not determined.
2.4 不同原发灶部位的局部复发模式
本研究中50例患者术后出现局部复发(首发或累积),总计147个局部复发部位(2.94个/例)。最常见复发部位依次为同侧肺门(21.0%)、残端(20.0%)、LNs4R(19.0%)、LNs4L (18.1%)及LNs7 (15.2%)。表3详细描述了局部复发在原发肿瘤不同部位的分布情况,结果如下:左上叶(n=21):局部复发以同侧肺门及LNs4L最常见(n=6,28.6%),其次为支气管残端、LNs5、LNs6、LNs7、LNs4R及LNs1(图2A)。左下叶(n=17):最常累及局部复发部位为LNs4L及同侧肺门(n=5,29.4%),其次为LNs5, LNs4R,支气管残端,LNs7及 LNs6(图2B)。右上叶(n=33):局部复发以LNs4R最常见(n=7,21.2%),在支气管残端、同侧肺门及LNs2R也有较高复发率(图2C);右中叶(n=13):以支气管残端复发(n=3,23.1%)最为常见,其次为同侧肺门和LNs4R, LNs7(图2D);右下叶(n=21):最常累及局部复发部位为LNs4R(n=5, 23.8%),其次为同侧肺门、LNs7、支气管残端、LNs5及LNs4L(图2E);左肺(n=38):较常见局部复发部位依次为:同侧肺门(28.9%)、LNs4L(28.9%)、支气管残端(21.1%)、LNs5(21.1%)、LNs6(15.8%)、LNs7(15.8%)及LNs4R(15.8%)。右肺(n=67)较常见局部复发部位依次为:LNs4R(20.9%)、支气管残端(19.4%)、同侧肺门(16.4%)及LNs7(14.9%)。
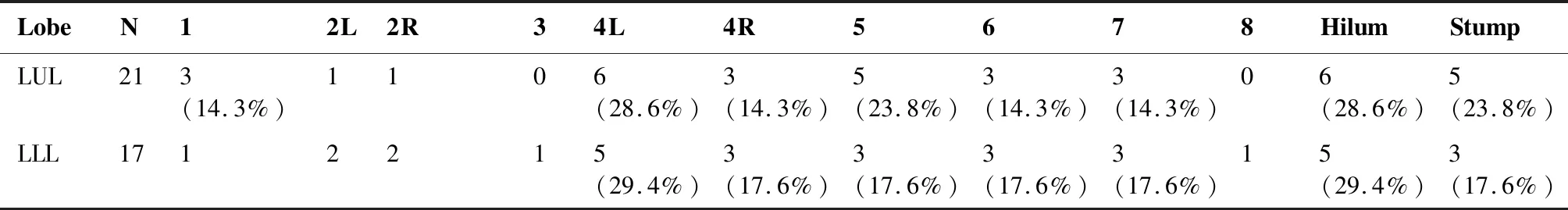
表3 不同原发灶部位的局部复发模式Table 3. Relationship between Primary Sites and Local Recurrence Patterns
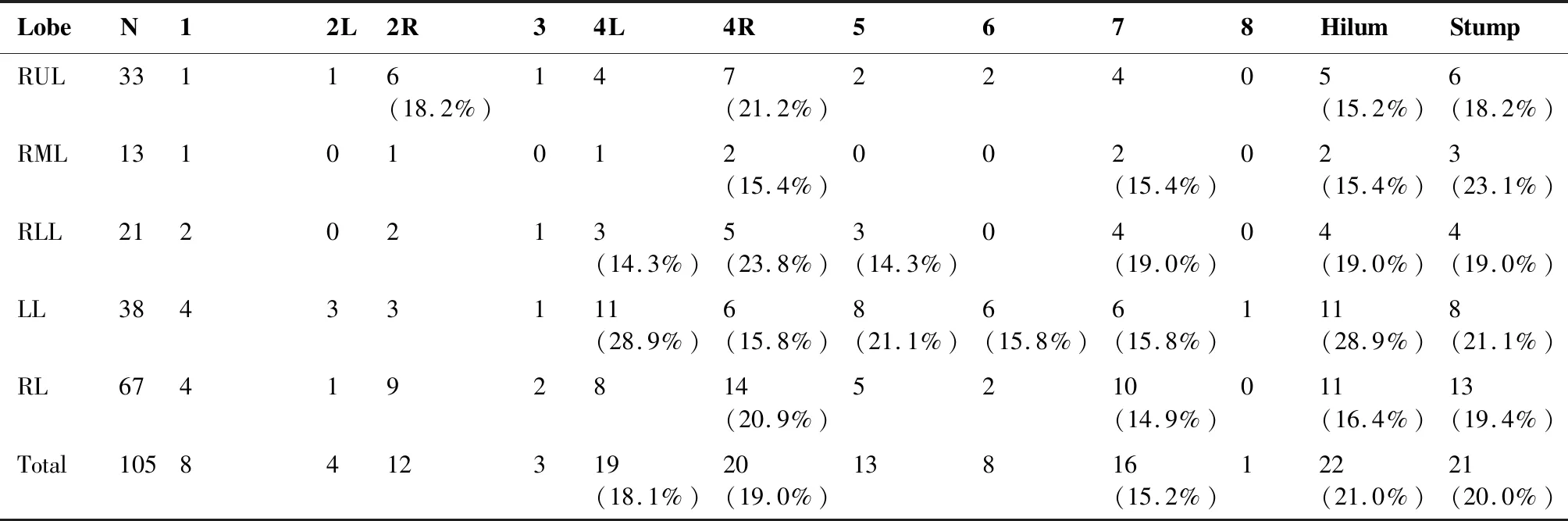
LobeN12L2R34L4R5678HilumStumpRUL33116(18.2%)147(21.2%)22405(15.2%)6(18.2%)RML13101012(15.4%)002(15.4%)02(15.4%)3(23.1%)RLL2120213(14.3%)5(23.8%)3(14.3%)04(19.0%)04(19.0%)4(19.0%)LL38433111(28.9%)6(15.8%)8(21.1%)6(15.8%)6(15.8%)111(28.9%)8(21.1%)RL674192814(20.9%)5210(14.9%)011(16.4%)13(19.4%)Total1058412319(18.1%)20(19.0%)13816(15.2%)122(21.0%)21(20.0%)
LUL: Left upper lobe; LLL: Left lower lobe; RUL: Right upper lobe; RML: Right middle lobe; RLL: Right lower lobe; LL: Left lung; RL: Right lung.
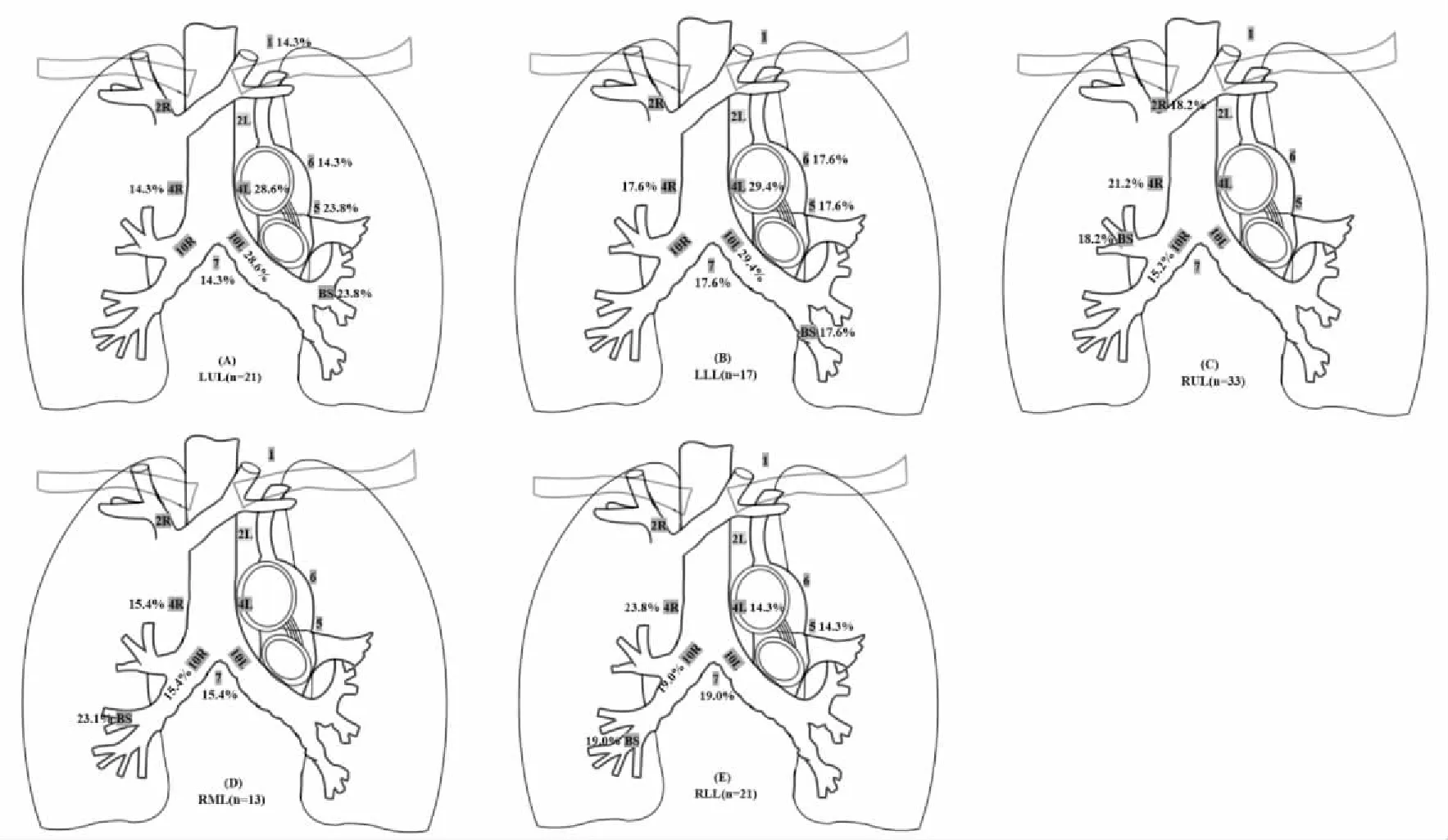
图2 5个不同肺叶肺癌术后局部复发图;Figure 2. Locoregional Recurrence Patterns of 5 Lung Lobes after Operation for Lung CancerA: Locoregional recurrence pattern of left upper lobe after operation for lung cancer; B: Locoregional recurrence pattern of left lower lobe after operation for lung cancer; C: Locoregional recurrence pattern of right upper lobe after operation for lung cancer; D: Locoregional recurrence pattern of right middle lobe after operation for lung cancer; E: Locoregional recurrence pattern of right lower lobe after operation for lung cancer.LUL: Left upper lobe; LLL: Left lower lobe; RUL: Right upper lobe; RML: Right middle lobe; RLL: Right lower lobe.
2.5 术后不同阳性淋巴结为基础的局部复发模式
我们以术后病理证实不同阳性淋巴结为基础,进一步描述局部复发区域与不同阳性淋巴结的关系(表4)。总体可以看出,术后病理证实阳性LNs4患者比例最高(54.3%),其后依次为LNs7(42.9%)、LNs2(30.5%)、LNs8(29.5%)、LNs6(14.3%)、LNs5(11.4%)、LNs9(10.5%)及LNs3(7.62%)。分析术后复发部位发现,无论阳性淋巴结所在何区域,支气管残端、同侧肺门、LNs4L、LNs4R及LNs7局部复发率基本均较高。对于术后阳性LNs4患者,LNs2(14.0%)及LNs7(15.8%)复发率高;以阳性LNs2为基础, LNs4(28.1%)及LNs1(15.6%)复发率高,而LNs7复发率较低(<10%);而以术后阳性LNs8/9为基础,LNs7复发率分别为16.1%及18.2%;若LNs5/6病理证实为阳性淋巴结,则此2个区域淋巴结均易局部复发(复发率>15%)。
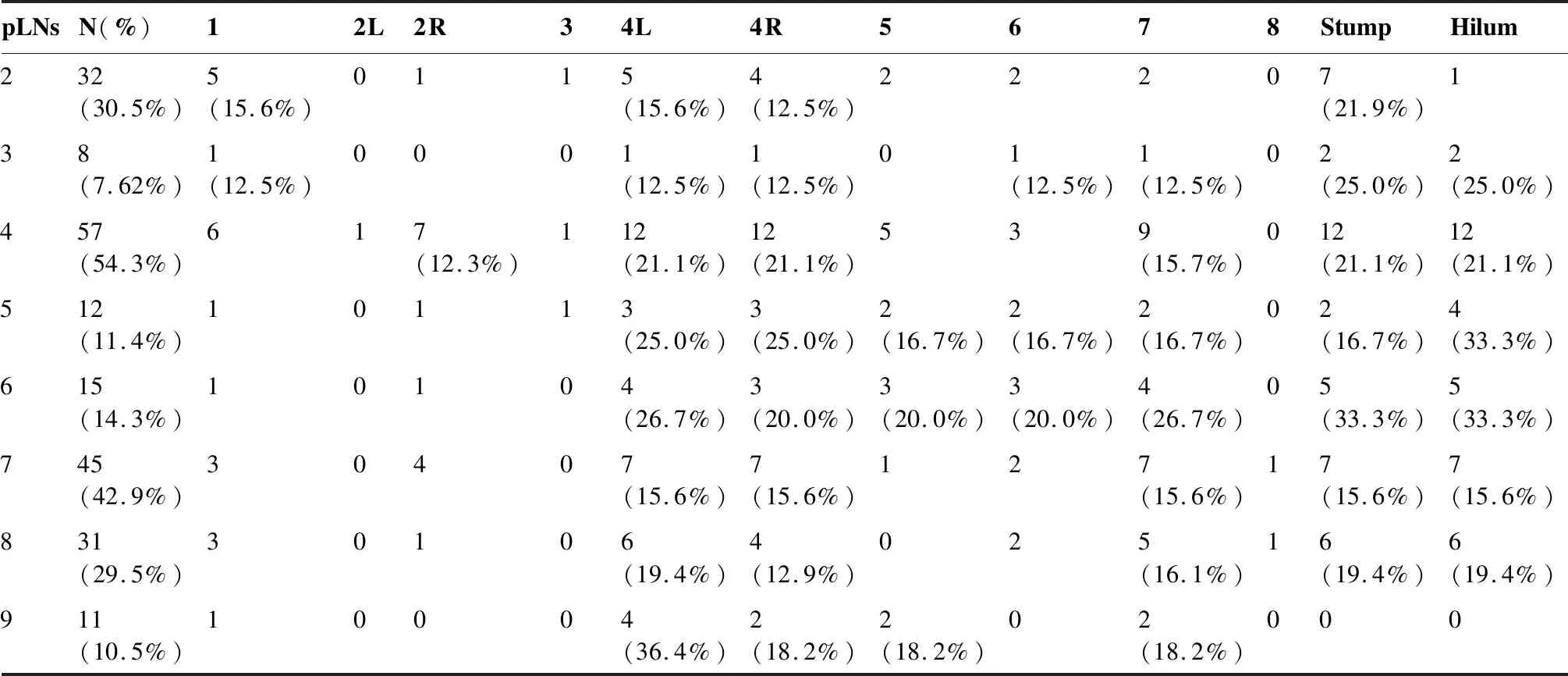
表4 术后不同阳性淋巴结为基础的局部复发模式Table 4. Relationship between Positive Lymph Nodes and Local Recurrence Patterns after Operation
pLNs: Positive lymph node station.
3 讨 论
对于可手术切除的III-pN2期NSCLC患者,PORT的影响仍存在争议。基于SEER数据库分析及ANITA研究[21-22]显示,随着三维适形放疗及调强适形放射治疗的应用,III-pN2期NSCLC患者生存获益显著。Herskovic等[23]通过研究NCDB数据库,发现PORT可延长患者生存期,这也在Robinson等[24]的研究中进一步得到证实。若PORT有益,明确术后复发模式及复发高危人群能提高PORT准确性及针对性,故本研究基于局部失败模式及复发高危因素而展开分析。
实际上,III-pN2期NSCLC患者是具有不同临床病理特征的异质性群体,因此分析其复发高危因素从而有选择性地筛选适宜患者来实施PORT是目前的热点问题。IASLC研究分析了不同pN2亚组患者的预后发现,跳跃单站N2(N2a1)的患者较其他pN2亚组预后更好[25]。本研究进一步证明N2a1患者局部复发风险相对较低,PORT或许无法使此类患者进一步获益。Wang等[8]和Yoo等[10]则认为pN2淋巴结数目是III-pN2期NSCLC患者独立预后因素;Urban等[11]研究建议阳性淋巴结比率作为pN2期NSCLC患者生存预测指标,类似结果也报道于其他研究[26]。此外,相关研究表明手术切除范围、原发灶大小、包膜外侵、年龄等可能是NSCLC患者的独立预后因素[8,10,27-28]。而大多数研究结果未确定与局部复发相关的独立因素[29]。基于本研究结果,多站pN2 NSCLC患者局部复发风险高,可能更适于PORT等积极处理,以降低局部复发风险从而转化为生存获益。另外,阳性L比率>1/3,低分化患者易于局部复发,建议此类患者积极予以PORT。而对于高龄患者,可能由于化疗周期数较少或其自身易复发特性导致局部复发率较高,但由于研究人数较少,无法得出确切结论,之后将进一步扩大样本量分析。总之,N2站数、阳性淋巴结比率及分化程度可能更益于预测N2患者局部复发。
虽然较多研究已经详细描述III-pN2期NSCLC患者术后生存及局部复发率,但其失败模式分析的相关证据不足,以至于PORT靶区无明确的统一共识。因此,我们尝试探索pN2期NSCLC患者术后局部复发模式为放疗靶区提供参考依据。本研究表明,不同肺叶局部复发情况不同,大部分右侧肿瘤以同侧复发为主,而左侧肿瘤易累及对侧纵隔,尤其是LNs4R。这可能是由不同肺叶的淋巴引流途径决定的,右侧肿瘤淋巴结转移最常累及同侧气管旁,而左侧肺癌的转移途径较为复杂,血管前、主动脉旁、AP窗转移多见[29]。Kelsey等[30]根据原发灶所在不同肺叶分析术后局部复发位置分布,这与我们的结论基本一致。Feng等[14]研究发现,左侧肺癌最常见的LNs失败部位为4R,其次为7、4L、6、10L和5区;右侧肺癌最常见的部位为2R,其次为10R、4R和7区。Billiet 等[4]研究显示局部复发多见于LNs7(18%)、4R(16%)及10R(16%),右侧肿瘤以单侧LNs复发为主,左侧肿瘤以双侧局部复发多见。
根据术后局部复发模式特点,推测PORT靶区勾画应根据肿瘤所在不同肺叶而相应变化。也有研究详细描述了基于术后不同阳性淋巴结CTV勾画需要包括哪些LNs,其中LNs4、LNs7基本存在每个CTV中[17]。Kepka等[31]认为对于pN2患者,由于术中淋巴结采样存在微小侵袭的风险,临床医生应谨慎处理pN2患者靶体积的过度缩小。2018年ESTRO ACROP[32]提出,PORT CTV应包括切除累及纵隔解剖淋巴结区、支气管残端、同侧肺门及LNs4/7。本研究回顾性分析105例患者局部复发模式表明,除了支气管残端、同侧肺门和阳性LNs外,LNs4、LNs7复发频繁,建议PORT CTV常规包括上述区域。此外,对于上肺叶,LNs2易累及,而对于左侧肺叶,主肺动脉窗也常复发。
本文进一步根据术后病理证实阳性淋巴为基础研究不同阳性淋巴结的局部复发区域特点得出:1)无论阳性淋巴结所在纵隔LNs,支气管残端、同侧肺门、LNs4L、LNs4R及LNs7局部复发频率均较高;2)局部复发频率符合解剖淋巴结引流途径规律,无论LNs5及LNs6何者病理证实阳性淋巴结,其两LNs的复发率均较高;对于阳性LNs4患者,其邻近LNs、LNs2及LNs7复发率高;以阳性LNs2为基础,LNs4及LNs1复发率高,而LNs7复发率较低(<10%);此结论也支持相关研究者高危淋巴结引流区域照射理论。因此,我们基于III-pN2期NSCLC患者术后局部复发区域特点,并根据不同肺叶肿瘤而设计PORT CTV勾画范围(图3),可以看出CTV基本囊括高危复发区域。另外对于上肺叶,由于LNs2易复发,建议PORT CTV 勾画包括LNs2。
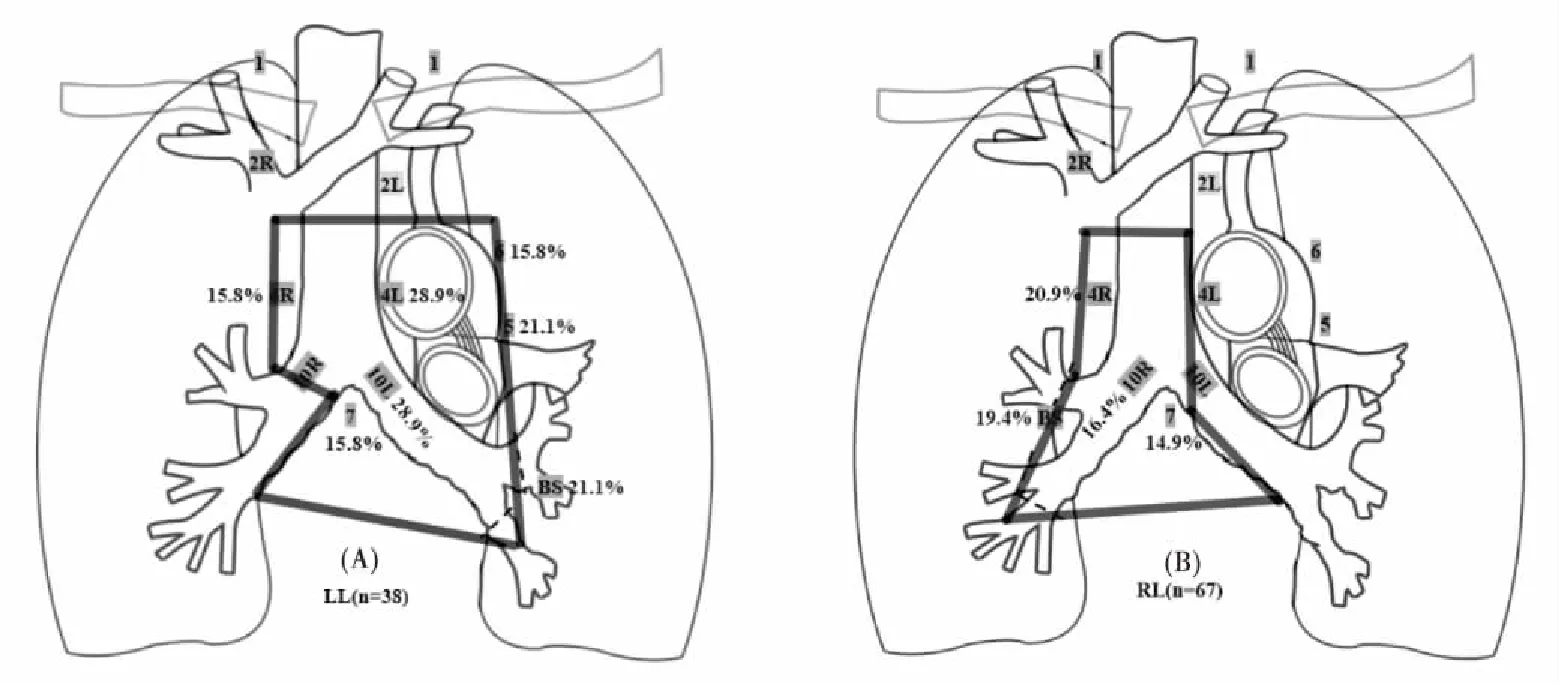
图3 左右侧肺癌术后放疗设计野及复发模式图;Figure 3. Locoregional Recurrence Patterns and Proposed PORT Fields for Lungs after Operation for Lung CancerA: Locoregional recurrence pattern and proposed PORT fields for the left lung after operation for lung cancer; B: Locoregional recurrence pattern and proposed PORT fields for the right lung after operation for lung cancer.PORT: Postoperative radiotherapy; LL: Left lung; RL: Right lung.
间接证据显示PORT能杀死术后微小肿瘤细胞[4],从而减少远处转移。本研究中,大多数局部复发患者诊断时即伴有远处转移,首次局部复发时伴远处转移患者占总局部复发患者比率为76.0%。这些患者倾向于具有较大原发病灶、较多淋巴结站、脉管癌栓等,可能需要积极局部控制及全身治疗。由于患者样本有限,我们没有继续探索。期待未来有更多典型研究来发现这类患者的共性,从而找到最合理的治疗方案。
本研究存在一定局限性,首先,本研究是回顾性研究,在随访间隔和复发时的影像学评估方面没有标准化;此外,病理和外科医生估计转移性淋巴结数量,主观差异不可避免;另外绝大部分复发的患者都是通过CT诊断的,没有进行病理证实。
综上,III-pN2期NSCLC患者是一组异质性较高的群体,多站pN2组、阳性LN比率>1/3、分化程度差是局部复发的高危因素,此类患者推荐积极予以PORT。另外我们建议III-pN2 NSCLC患者的PORT CTV应根据原发肿瘤所处左、右侧不同肺叶来设计。除支气管残端、同侧肺门及阳性淋巴结区域外,左肺PORT CTV常规包括 LNs4、LNs7、LNs5及LNs6;右肺PORT CTV常规包括 LNs4R及LNs7。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
