皱纹盘鲍与绿鲍杂交种生长比较
2020-03-05黄洪龙
黄洪龙
(1.福建省水产技术推广总站,福建 福州 350002;2.厦门大学海洋与地球学院,福建 厦门 361100)
绿鲍(Haliotisfulgens)产于美洲太平洋亚热带沿岸,属大型鲍、暖水性种类,且经济价值高,在温度变化范围为9~30℃的海洋环境中可以繁殖生长,生长最适温度在18~24℃,与福建水温条件相适宜[1]。绿鲍的适应性比较强,对于养殖环境要求不高,而且是一种容易在人工控制下进行性腺发育和繁殖的优良品种[2]。国内外对于绿鲍的研究报道相对较少,Leighton等研究发现绿鲍发育比较快,可以用绿鲍来选育生长速度比较快的品系[3]。皱纹盘鲍(Haliotisdiscushannai)是我国鲍科动物中最重要的养殖种类,其自然分布海域仅限于江苏以北的辽东、山东半岛的黄海侧和渤海海峡及其部分岛礁周围[4]。20世纪70年代,陈木等成功解决了皱纹盘鲍的人工育苗技术,并将皱纹盘鲍从北方海区引种至福建进行养殖[5]。
鲍的种间杂交育种工作开展较早,自从Owen等发现北美洲太平洋沿岸主要鲍种间存在着自然杂交现象[6],许多学者先后开展了鲍种间杂交实验,而且有些杂交种因性状优良,已开始产业化运用于生产中。然而,随着鲍养殖业的发展,很多问题也相继出现,种质退化、疾病频发等造成经济效益严重下滑,优良养殖品种的不足成为制约鲍养殖业可持续发展的瓶颈[7]。因此,开展鲍的遗传改良研究成为当务之急,也将为鲍养殖产业的可持续发展提供重要技术保障。鉴于绿鲍所表现的耐高温特性,与皱纹盘鲍在耐温性等性状具有互补性,因此通过利用引进美洲沿岸的绿鲍与福建现有养殖的皱纹盘鲍进行杂交,培育出生长快、耐高温、抗逆性强的品种,这对于改善我国鲍养殖品种结构和推动整个鲍养殖业的产业链发展有重要意义。
1 材料与方法
1.1 实验材料
2015年7月开展的苗种养殖实验,所用绿鲍(FF)、皱纹盘鲍(DD)、杂交F1(DF)、回交F1(DD×DF、DD×FD),为2014年12月在晋江福大鲍鱼水产有限公司养殖基地家系桶培育的苗种。从家系桶中挑出5个组合养殖群体(其他组合数量不足),每个群体150只,并随机挑选每个组合的30只幼鲍测量其壳长。实验从2015年7月开始,到2016年4月结束,5个组合鲍起始壳长数据见表1。

表1 绿鲍与皱纹盘鲍杂交、回交后代的起始壳长数据
注:同一行上标不同表示差异显著(P<0.05)。下表同此。
Notes:Means in each line with different superscripts differed significantly(P<0.05).The same as below.
1.2 实验方法
授精及孵化实验设置的杂交、回交组合见表2。从皱纹盘鲍和绿鲍亲本群体中挑选性腺饱满、体表无损伤、生长发育较好的个体进行人工催产,亲鲍催产采用阴干结合紫外线照射过的海水刺激的方法。将亲鲍单独放在10 L容器中排精、产卵。在操作的过程中,同种的雌雄个体间保持10 m以上的距离,同时在每一步操作前用淡水清洗所有的容器及滴管,严防同种受精,每次实验用的精子浓度先使用血球计数板进行确认。与此同时,在进行每次杂交实验前,取一次性塑料杯,往里放入未受精的卵子,6 h后进行镜检,如果发现受精卵有卵裂,表明该次实验的卵子已受到污染,应加入淡水中停止该实验。授精后每隔1 h洗卵1次,直至幼体发育至担轮幼体阶段后,进行优选。按10×104个/m3的密度将幼体均匀地泼入家系桶中进行采苗,实验用育苗家系桶规格为长1.1 m、宽0.9 m、深1.0 m,采苗器材用聚乙烯波纹板,育苗用海水经过两层砂滤,盐度为30~31。采苗后的管理按常规育苗方法进行。

表2 皱纹盘鲍与绿鲍杂交、回交组合
注:DD:皱纹盘鲍;FF:绿鲍;DF:皱纹盘鲍作为母本、绿鲍作为父本的杂交F1;FD:绿鲍作为母本、皱纹盘鲍作为父本的杂交F1。
Notes:DD:Haliotisdiscushannai;FF:Haliotisfulgens;DF:Haliotisdiscushannai♀ ×Haliotisfulgens♂;FD:Haliotisfulgens♀ ×Haliotisdiscushannai♂.
苗种养殖实验在晋江福大鲍鱼水产有限公司养殖基地进行,在2015年3月初家系桶中波纹板上的藻类数量减少到不能满足稚鲍生长需求,因而采用大蒜素水溶液进行稚鲍剥离。剥离后的稚鲍直接转入铺有四角砖的家系桶中进行流水培育并大量充气,每天傍晚投喂人工配合饲料,而后第二天上午全部换水,并彻底冲洗池底和池壁,去除残饵。2015年7月,将鲍苗(平均壳长2 cm)移入鲍笼养殖,鲍笼规格为长42 cm、宽31 cm、高12 cm,每5层塑料笼1串,养殖密度为每笼30粒,每个组合鲍养1串,并且标记铭牌。容器养殖在长7.5 m、宽3.0 m,高1.0 m的水泥池内进行,水泥池为南北走向2%找坡,实验从2015年7月开始,一直持续到2016年4月为止,养殖池中进行流水培育并大量充气,每隔5~7天投喂龙须菜(Gracilariaverrucosa)或海带(Laminariajaponica)至每次稍有剩余量。
1.3 数据处理
1.3.1 受精率测定
实验在6孔组织培养板中进行,每个实验水平重复6孔,设置1个空白对照孔(即不加入精子),以监测卵子是否被同种精子污染,24 h后如果空白对照孔出现浮游幼体则表示卵子在实验前已经被污染,反之则未被污染。综合预实验结果,实验中每孔卵子数控制在100个。人工授精后,在室温条件下孵育,2 h后统计受精率。受精率为已分裂的卵数占总卵数的百分比。在受精卵发育到2细胞期之后,每个组合在显微镜下计数分裂的卵数。
受精率(%)=卵裂的个数/总卵数×100%
1.3.2 孵化率测定
2013年水利部小浪底水利枢纽管理中心(简称枢纽管理中心)认真贯彻落实党的十八大精神及中央水利决策部署,按照水利部提出的“争创一流的工作业绩、取得一流的综合效益、建设一流的职工队伍、培育一流的企业文化、打造一流的水利水电品牌、形成一流的水利枢纽管理中心”(简称“六个一流”)的目标要求,把握好“担当、务实、转变”的主题,持续推进“管好民生工程,谋求多元发展”战略,深化改革,强化管理,加快发展,取得了十分显著的成绩。
搅拌使孵化盆中的受精卵在水中分散均匀,用1 mL移液管从每个孵化盆中取样计数卵数,定量每个孵化盆中的卵数。担轮幼虫孵化后,将上浮的幼虫转移至另一个盆中,定量该盆的幼虫数,记为孵化幼虫数。孵化率为孵化幼虫数占受精卵数的百分比,每个组合分别设置6个重复。
孵化率(%)=孵化幼虫数/受精卵数×100%
1.3.3 壳长测定
壳长测量过程中,避免撬动对鲍生长的影响,每隔1个月,对每串每笼的个体进行拍照,并用Photoshop对照片进行处理,得出壳长数据,直至实验结束。此外记录死亡的个数,记录每天的海水温度,并用SPSS 18.0软件统计分析测量的数据。
2 结果
2.1 皱纹盘鲍与绿鲍杂交种的受精率及孵化率
皱纹盘鲍与绿鲍杂交F1的受精率及孵化率如表3所示。由表3可知,水温在24℃时,皱纹盘鲍与绿鲍自繁F1受精率较杂交F1高,存在显著性差异(P<0.05)。正交F1受精率较反交F1高,存在显著性差异(P<0.05)。
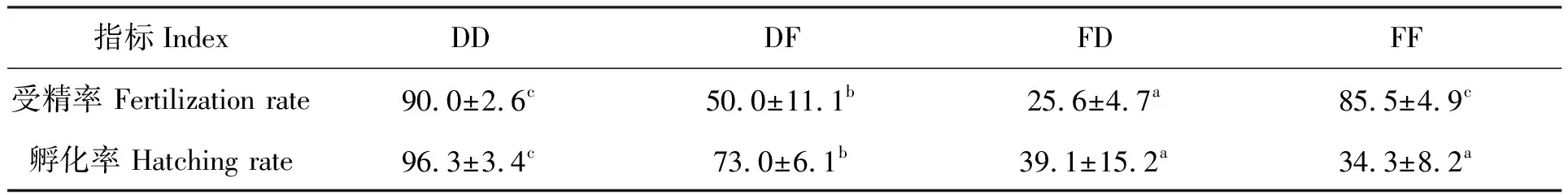
表3 皱纹盘鲍与绿鲍杂交F1的受精率及孵化率
绿鲍和皱纹盘鲍杂交F2的受精率及孵化率如表4所示。由表4可知,水温在24℃时,皱纹盘鲍与绿鲍杂交F2,DF为母本的受精率低于FD为母本的受精率,存在显著性差异(P<0.05)。

表4 绿鲍和皱纹盘鲍杂交F2的受精率及孵化率
皱纹盘鲍与绿鲍回交F1的受精率及孵化率如表5所示。由表5可知,水温在24℃时,皱纹盘鲍与绿鲍回交F1,DD×FD的受精率最高为(86.7±5.8)%,DF×FF的受精率(53.8%±10.0)%次之。DD×DF、FD×FF受精率分别为(35.0±6.2)%、(27.5±0.6)%,而FF×FD、DF×DD、FD×DD不受精。

表5 皱纹盘鲍与绿鲍回交F1的受精率及孵化率
2.2 皱纹盘鲍与绿鲍杂交种的壳长
绿鲍与皱纹盘鲍杂交、回交子代不同时期的壳长情况如图1所示。由图1可知,刚开始时,DD、FF、DF、DD×DF、DD×FD平均壳长差异不大,随着养殖时间的增加,DD×DF、DD×FD的最后壳长增加量要优于DD和FF。在2015年7月到2015年12月期间,当时的水温为23~27℃,DF的生长明显优于其他4个组合,存在显著性差异(P<0.05)。在2016年2月到2016年4月期间,当时的水温为13~18℃,DD×DF的生长明显优于其他4个组合,存在显著性差异(P<0.05)。总体上,经过275 d的培育,DF、DD×DF、DD×FD的壳长增加量优于DD和FF,且存在显著性差异(P<0.05)。
2.3 皱纹盘鲍与绿鲍杂交种的存活率
在相同养殖条件下,各组合鲍的存活率比较结果如表6所示。由表6可知,经过275 d的跟踪统计,自繁组合F1、杂交组合F1、回交组合F1的存活率都高于90%,不存在显著性差异(P>0.05),这与陆基工厂化养殖条件较为适宜有关。
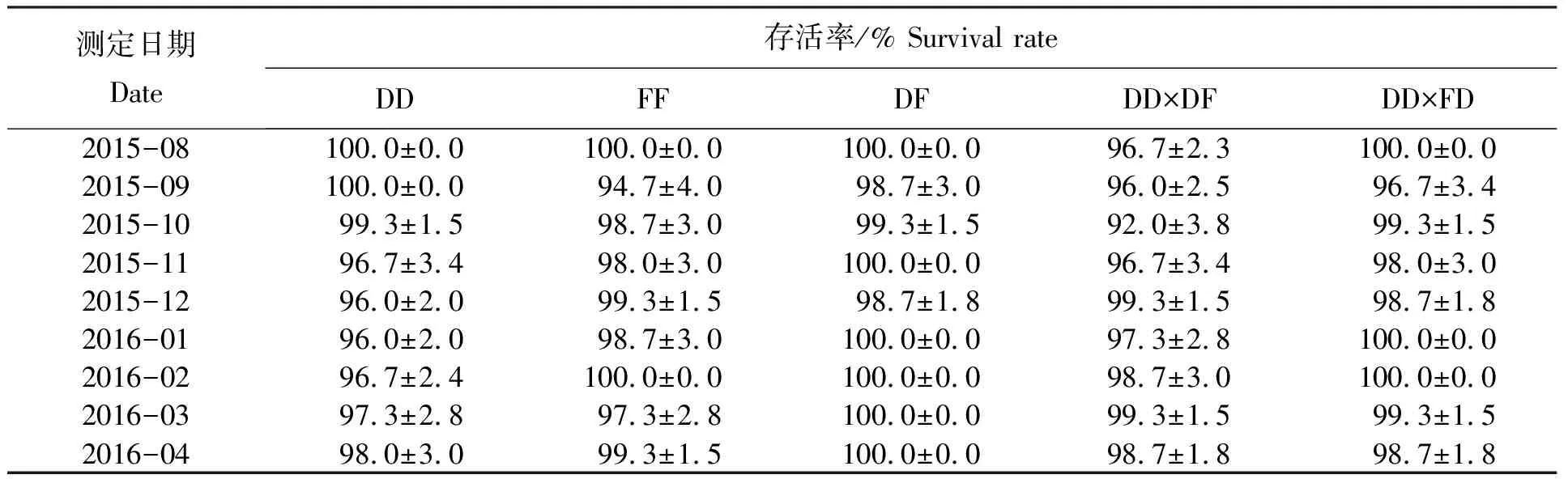
表6 相同养殖条件下各组合鲍的存活率比较
在相同养殖条件下,各组合鲍死亡的壳长和数量结果如表7所示。由表6和表7可知,经过275 d跟踪统计,DD、FF、DF、DD×DF和DD×FD的存活率都高于90%,且各月死亡的都是壳长较小的个体。因此,在相同的养殖条件下,不论是自繁组合F1、杂交组合F1、回交组合F1,小个体鲍均较容易死亡。
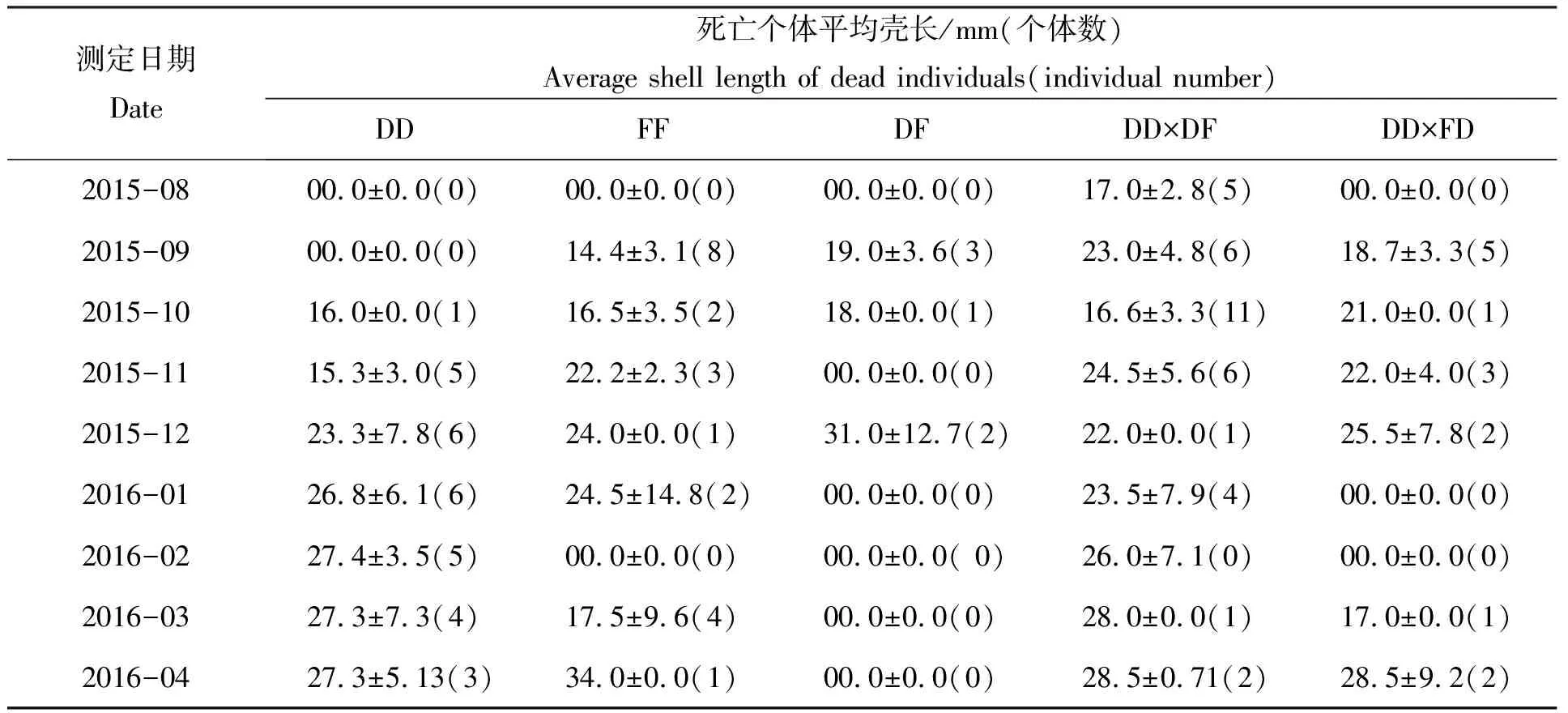
表7 相同养殖条件下各组合鲍死亡的壳长和数量
3 讨论
3.1 授精及孵化实验
在海洋无脊椎动物中,近缘种之间的种间杂交较为常见,但是种间杂交受精率往往比较低,想要获得较高的受精率则需要对授精条件进行优化[8-10]。骆轩研究了温度对西氏鲍与皱纹盘鲍杂交受精的影响,结果表明,皱纹盘鲍自繁组合的受精率受水温变化影响较小,西氏鲍自繁组合的受精率则受水温变化的影响较大,当授精水温在18~20℃时,受精率均达到90%以上,而当水温为22℃时,受精率则迅速下降,仅为44.3%。西氏鲍与皱纹盘鲍杂交的受精率在不同水温条件下变化较大,认为杂交受精率的高低受到西氏鲍繁殖适温性的影响,同时在西氏鲍与皱纹盘鲍杂交过程中,对西氏鲍亲本的性腺促熟及杂交过程的水温控制极为重要[11]。范飞龙研究了在水温为22℃时,皱纹盘鲍和绿鲍的自繁F1的受精率达到最高值,分别为71.62%和66.73%;当温度低于18℃或者高于26℃时,皱纹盘鲍和绿鲍自繁F1的受精率都低于20%,两者的最适授精水温为20~24℃[12]。本研究通过在相同条件下比较皱纹盘鲍、绿鲍及其杂交种的受精率及孵化率,发现皱纹盘鲍与绿鲍的杂交种受精率较其父、母本低,存在显著性差异(P<0.05),如表3所示;在杂交F2中,FD×FD受精率高于DF×DF,存在显著性差异(P<0.05),如表4所示;在回交F1中,DD×FD受精率最高为(86.7±5.8)%,而FF×FD、DF×DD、FD×DD不受精,如表5所示。
不同生物种存在生殖隔离,这是一个重要的生物过程。虽然有许多机理还是未知的,但已研究清楚了物种之间的生殖隔离的两种方式,即前合子生殖隔离和后合子生殖隔离[13-14]。前者包括生境隔离、时间(季节)隔离、行为隔离、机械隔离及配子隔离(不成熟、不受精);后者包括杂交后代不育、不受精。绿鲍和皱纹盘鲍是两个不同的物种,尽管在贝类人工繁殖中有其杂交和繁育的可行性,但其属于种间杂交,根据生殖隔离原理,其受精率极其低下,胚胎畸形极多,幼虫成活率相当低下,属于正常现象。从表3、表4和表5可知,皱纹盘鲍与绿鲍的杂交可受精,因此,绿鲍与皱纹盘鲍不存在后合子生殖隔离,而海洋环境中可能是通过前合子生殖隔离方式避免种间杂交。在配子隔离之前,生殖隔离和物种形成可能已经发生,因为精子和卵子识别的分子机制是随着时间推移而分化的[15]。Leighton等发现白鲍提供卵子、红鲍提供精子的受精率几乎为100%,而其反交的受精率却低很多[16]。如表3中,DF受精率为(50.0±11.1)%,FD受精率为(25.6±4.7)%;如表5中,DD×DF受精率为(86.7±5.8)%,DF×DD不受精;FF×DF受精率为(18.6±9.1)%,DF×FF受精率(53.8±10.0)%,表明杂交种的受精率存在非对称性,其受精率的差异可能与配子的亲合力有关。
3.2 苗种实验
实验动物的初始壳长往往会对实验期间的生长造成影响,表现为初始壳长作为协变量时对因变量具有显著影响[17]。协方差分析能在剔除协变量影响的情况下正确评估实验因素的影响。本实验中,自繁组合F1、杂交组合F1、回交组合F1的初始壳长有显著性差异(表1),因此,对各实验阶段壳长等指标进行分析时,将其作为协变量,以避免得到不可靠的实验结论。
存活率作为杂交育种的主要目标性状之一,在水产养殖过程中直接关系到养殖的经济效益。对于双壳类贝类种间杂种存活率的报道,大多是幼虫存活率不高,在变态之前就夭折或者是获得很少量的稚贝,在此之后全部死亡[18-19]。本研究通过比较皱纹盘鲍、绿鲍及其杂交种的存活,发现皱纹盘鲍、绿鲍及其杂交种的存活率都在90%以上,没有显著性差异(P>0.05),这与养殖过程中较适宜的养殖条件有关。由表6和表7可得出结论,不论是父本、母本还是杂交种,在相同养殖条件下小个体比较容易死亡,温度较高的8、9和10月鲍个体的死亡个数相对增多。
培育新品种过程中,另一个重要经济指标即生长速率。骆轩通过研究西氏鲍和皱纹盘鲍杂交,结果显示西氏鲍与皱纹盘鲍正反交F1在生长方面表现出一定的杂种优势,即生长速度比皱纹盘鲍自繁组合快,且随着养殖日龄的增加,西氏鲍与皱纹盘鲍的正、反交F1在生长方面的杂种优势率逐渐增加,表现为养成期>幼鲍期>稚鲍期[11]。范飞龙通过对皱纹盘鲍与绿鲍的自繁F1及杂交F1的周年跟踪,发现在平均水温为24.7℃的5月,与其他3个组合相比,皱纹盘鲍自繁组合日均生长速率最低,说明皱纹盘鲍不耐较高水温,而绿鲍自繁F1在8月的日均生长速率最高,且显著高于其他3个组合,说明绿鲍适宜在较高水温下生长,在10月,正交F1表现出一定的杂种优势[12]。本研究发现,在养殖275 d内,杂交鲍较其父本、母本均有较快的生长速度,表明在此阶段内,杂交后代具有超亲优势。在2015年7月至2016年1月,绿鲍自繁F1、正交DF比皱纹盘鲍自繁F1的壳长生长要快,在2016年1月至2016年4月期间,绿鲍自繁F1、正交DF比皱纹盘鲍自繁F1的壳长生长要慢,说明皱纹盘鲍不耐较高水温,绿鲍更适宜于在较高水温下生长(图1)。变异是育种工作的基础,在丰富的遗传变异种中更容易选择出有利变异,从而培育出具备优良生产性状的品种[20],因此杂交鲍具备了较高的育种价值。所获得的皱纹盘鲍与绿鲍杂交DF、回交DD×DF和DD×FD在生长方面表现出了一定的优势,并且随着养殖日龄的增加,DF、DD×DF和DD×FD在生长方面的杂种优势率逐渐增加(图1)。本研究经275 d的实验期发现杂交苗要比自交苗生长快;杂交苗、自交苗的存活率在90%以上,存活率较高。
本研究发现,在2015年7月至2015年12月期间,正交DF的壳长比回交F1生长要快;在2016年1月至2016年4月期间,正交DF的壳长比回交F1生长要慢,总体来说,杂交F1和回交F1壳长生长要快于自繁F1,皱纹盘鲍与绿鲍杂交种具有较高的育种价值(图1)。结合图1的温度曲线,DF在2015年7月到2015年11月期间生长较快,而在2015年12月到2016年4月期间生长相对较慢,这可能与温度的下降有关,23~26℃可能为DF的最适温度。DD×DF在2015年7月到2015年11月期间生长较慢,而在2015年12月到2016年4月期间生长相对较快,这也可能与温度的下降有关,14~18℃可能为DD×DF生长的最适温度。绿鲍产于美洲太平洋热带沿岸,最适水温在18~24℃,因此杂交种DF生长可能的最适温度与绿鲍比较接近。
