昆虫嗅觉中枢系统对外周信号的整合编码研究进展
2020-03-04王桂荣
刘 伟, 王桂荣
(中国农业科学院植物保护研究所, 植物病虫害生物学国家重点实验室, 北京 100193)
昆虫种类繁多,是地球上重要的生物类群。复杂而灵敏的嗅觉系统在其寻找配偶、搜寻食物、定位生殖场所和逃避天敌等重要行为中起着不可或缺的作用。昆虫的嗅觉神经系统包括外周嗅觉神经系统和中枢嗅觉神经系统(图1)。触角(antennae)是昆虫外周主要的嗅觉器官,其表面密布着大量不同类型的感受器(sensilla)。外界气味分子通过感受器上的小孔扩散进感受器淋巴液,经气味结合蛋白(odorant binding protein, OBP)结合和运输到达嗅觉受体神经元(olfactory receptor neuron, ORN),并激活树突膜上的嗅觉受体(olfactory receptor, OR),在这里外界化学信号转化为电信号。外周嗅觉识别的神经和分子机制研究较多,也较为清楚,有很多相关的综述(Stocker, 1994; Vosshall, 2000; Benton, 2008; Nakagawa and Vosshall, 2009; Suetal., 2009; Wilson, 2013)。
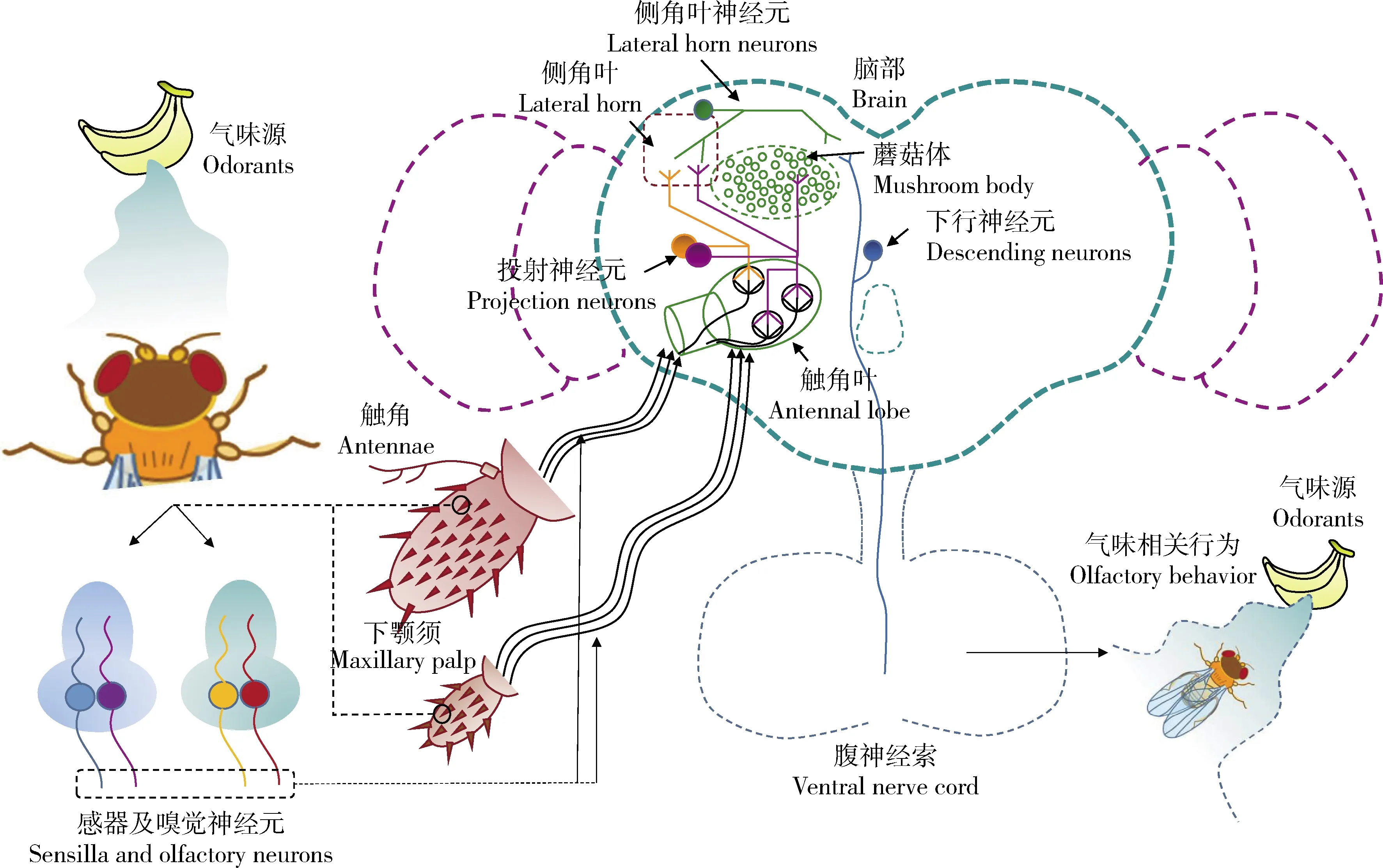
图1 昆虫(果蝇)神经系统中的嗅觉通路与对应的行为(改自Ruta et al., 2010和Bates et al., 2020)
当外界化学信号在外周嗅觉神经系统中转化为电信号后,这些电信号经嗅觉受体神经元的轴突传递汇聚至初级嗅觉中枢——触角叶(antennal lobe, AL)。不同来源的电信号在此被初步整合加工后经投射神经元(projection neuron, PN)投射到高级神经中枢蘑菇体(mushroom body, MB)和侧角叶(lateral horn, LH),高级嗅觉中枢对这些信息经过再次整合加工后直接或间接传递至下行神经元(descending neuron, DN),最终使昆虫产生相应的行为反应(图2)。相比较而言,中枢嗅觉神经系统对外周信号的整合编码研究较少,主要以模式昆虫黑腹果蝇Drosophilamelanogaster为研究对象;最近在鳞翅目昆虫中也取得一些进展,主要围绕经济昆虫家蚕Bombyxmori和部分农业害虫。因此,嗅觉中枢的研究不仅有助于我们理解昆虫脑部对于气味信息的复杂编码机制,而且能够促进我们对昆虫资源的利用和防治技术的开发。本文首先对气味信号在模式昆虫果蝇成虫中枢嗅觉神经系统的整合编码进行了综述,随后总结了鳞翅目昆虫中的相关的研究进展,并根据上述进展情况,对未来的研究方向进行了展望。

图2 果蝇中枢嗅觉神经系统对气味信息的编码整合(改自Bates et al., 2020)
1 触角叶的结构与内部神经的连接
触角叶是昆虫的初级嗅觉中枢,其结构和功能与脊椎动物的嗅球(olfactory bulb)类似,由一系列球状的神经纤维结构组成,这些结构被称为嗅小球(glomeruli)。单个嗅小球内主要汇聚了3种类型的神经元的突起,包括来自外周嗅觉器官上的嗅觉受体神经元轴突(果蝇成虫单侧触角叶内约有1 400个嗅觉神经元),与之对应的投射神经元树突(果蝇成虫单侧触角叶内约有条345个投射神经元),以及连接不同嗅小球的局域神经元树突(local neurons, LN,果蝇成虫单侧触角叶内约有200个局域神经元)(Batesetal., 2020)。嗅觉受体神经元轴突与投射神经元的树突之间形成大约几十个化学突触连接,负责信号的向下传递。而局域神经元则连接不同的嗅小球,使信号在嗅小球间进行传输(Wilson, 2013)。
果蝇外周嗅觉神经元与嗅小球的连接方式通常为一对一,即表达同类嗅觉受体的嗅觉受体神经元通常连接相同嗅小球(Vosshalletal., 2000; Wangetal., 2003),并且触角单侧同类嗅觉受体神经元能够投射到两个触角叶对称的嗅小球位置上(Stockeretal., 1990)。表达同类嗅觉受体的嗅觉神经元数量通常为10~100个(Shanbhagetal., 1999; de Bruyneetal., 2001),这些嗅觉神经信号在单个小球汇聚后由对应的投射神经元接收。由于这样的信号传输过程能够被乙酰胆碱受体抑制剂所阻断,表明嗅觉受体神经元-投射神经元的突触连接为胆碱能(cholinergic)突触(Kazama and Wilson, 2008)。
果蝇触角叶中的局域神经元是一类特殊的神经元,其缺乏轴突(Wilson, 2013),抑制性的局域神经元释放γ-氨基丁酸,从而抑制嗅觉受体神经元和投射神经元的兴奋(Ngetal., 2002)。兴奋性的局域神经元虽然释放乙酰胆碱(Shangetal., 2007),但其与投射神经元的连接不是化学突触,而是通过细胞桥联(gap junction)与对应的投射神经元形成电突触(electrical synapses)(Huangetal., 2010)。
2 化学气味在触角叶区域的投射
2.1 气味的基本投射——吸引(attraction)和驱避(aversion)
化学气味通过激活表达在外周嗅觉受体神经元上的嗅觉受体,将信号投射到触角叶中的特定嗅小球。例如,顺-11-十八碳烯乙酸酯(11-cis-vaccenyl acetate, cVA)是果蝇雄性释放的性信息素,由分别表达OR67d和Or65a的两种嗅觉神经元所感受,随后分别投射至触角叶处的DA1(dorsal anterior 1)和DL3(dorsal lateral 3)小球(Coutoetal., 2005; Kurtovicetal., 2007; van der Goes van Naters and Carlson, 2007)。气味在较低剂量时往往激活少量嗅小球,剂量越高嗅小球的激活数量越多(Wangetal., 2003)。气味对果蝇的吸引和驱避由该气味对应的触角叶投射神经元所决定。在低浓度,吸引气味往往激活DM4, DM5和DM2,而驱避气味往往激活DL5, D和DL1;在高浓度时,吸引气味没有特定的激活区域,而驱避气味则特异激活D, DA4, DL1, DL4, DL5和DC3(Knadenetal., 2012)。
2.2 气味投射引起的侧向兴奋——增效(synergism)
当多个嗅小球间通过兴奋性局域神经元相连时,激活其中一个能够导致其他嗅小球的信号被增强,这种现象被称为侧向兴奋(lateral excitation)。有研究报道,利用基因编辑手段敲除果蝇特定的嗅觉受体后,仍能在对应投射神经元上记录到气味刺激引起的电生理信号,表明侧向兴奋现象的普遍存在(Olsenetal., 2007; Rootetal., 2007; Shangetal., 2007)。侧向兴奋由乙酰胆碱能局域神经元(兴奋性局域神经元)引起,但这个过程不需要乙酰胆碱的释放,而是需要细胞桥联介导的电突触(Yaksi and Wilson, 2010)。侧向兴奋能够解释混合气味的增效现象,例如醋能够增强果蝇雌虫对cVA的行为反应,并且促进其对雄虫求偶的接受。当醋与cVA混合,触角叶中cVA特异嗅小球DA1的投射神经元反应明显增强,这种增强需要细胞桥联形成的电突触,缺乏细胞桥联时DA1神经元不能提高对cVA的反应,并且雌虫降低了接受求偶行为的速度(Dasetal., 2017)。
2.3 气味投射引起的侧向抑制——拮抗(antagonism)
如果几个嗅小球间通过抑制性局域神经元相连,激活其中一个便会导致其他嗅小球的反应信号下降,这种现象称为侧向抑制(lateral inhibition)。已有大量研究发现侧向抑制信号的存在,例如向混合气味加入新的气味时,往往会对已经激活的投射神经元产生较强的抑制(Silbering and Galizia, 2007; Olsenetal., 2010)。特定投射神经元甚至能被激活对应嗅觉受体神经元的气味所抑制(Olsen and Wilson, 2008)。然而,阻断其他小球的输入信号能明显减弱这种抑制(Olsen and Wilson, 2008; Asahinaetal., 2009)。侧向抑制由γ-氨基丁酸能神经元(GABAergic neuron)引起,并且γ-氨基丁酸和γ-氨基丁酸受体在这个过程中起主要作用(Sibering and Galizia, 2007; Olsenetal., 2010)。侧向抑制可以解释吸引气味与驱避气味混合引起的拮抗,例如在果蝇中,乙酸乙酯能够激活DM1, DM2, DM3和DM4小球,从而产生吸引作用。苯甲醛对于果蝇是一种驱避气味,其能够激活DL1和DL5两个小球。DL1通过抑制性局域神经元(HB4-93),向DM1和DM4释放γ-氨基丁酸,同时抑制嗅觉受体神经元的输入和PN的输出信号,DL5则通过另一条抑制性局域神经元(NP3056),释放γ-氨基丁酸到DM3,抑制嗅觉受体神经元的输入信号。因此,两种气味混合时,吸引信号受到抑制,使得混合物具有驱避效果(Mohamedetal., 2019)。
3 气味信息在蘑菇体中的处理
3.1 蘑菇体的结构
蘑菇体是昆虫的高级嗅觉中枢,与脊椎动物的梨状皮质(piriform cortex)类似,蘑菇体由蘑菇体冠(calyx)、蘑菇体柄(pedunculus)和蘑菇体叶(lobes)3部分构成。蘑菇体内部主要由凯尼恩细胞(Kenyon cell, KC)组成,在果蝇中,单侧蘑菇体包括大约2 000个凯尼恩细胞,34~35个左右的蘑菇体输出神经元(mushroom body output neurons, MBONs)以及100~130个左右的多巴胺能神经元(dopaminergic neuron, DAN)(Asoetal., 2014; Batesetal., 2020)。嗅小球中的投射神经元轴突与凯尼恩细胞的树突在蘑菇体冠内连接,凯尼恩细胞的轴突在蘑菇体柄内延伸,分别汇聚于蘑菇叶的分支中(α, α’, β, β’和γ)(Tanakaetal., 2004; Linetal., 2007; Asoetal., 2014; Batesetal., 2020)。蘑菇体输出神经元和凯尼恩细胞在蘑菇体叶中形成突触连接,多巴胺能神经元的轴突再与这些突触连接汇聚(Asoetal., 2014)。蘑菇体通过蘑菇体输出神经元将信号输出到多个脑区,包括:环绕蘑菇体的网状区(crepine)、上位内侧前脑区(superior medial protocerebrum, SMP)、上位中前脑区(superior intermediate protocerebrum, SIP)、上位侧前脑区(superior lateral protocerebrum, SLP)和侧角叶。
3.2 蘑菇体中气味信息的编码
触角叶中气味信息经过投射神经元传递到蘑菇体,投射神经元轴突与蘑菇体冠中的凯尼恩细胞相连。嗅小球对投射神经元的连接方式通常为特异的,但投射神经元进一步连接至凯尼恩细胞却是随机的,不同个体间变化较大(Caronetal., 2013),所以难以根据气味种类对凯尼恩细胞进行反应类型的区分(Murthyetal., 2008)。单个凯尼恩细胞平均接受大约7条投射神经元的气味信息,然而与投射神经元不同,凯尼恩细胞对气味的反应谱较窄,单种气味仅激活神经元细胞总数的5%左右(Turneretal., 2008; Honeggeretal., 2011)。凯尼恩细胞神经元的轴突将气味信息进一步传递到蘑菇体输出神经元,蘑菇体输出神经元则对气味的反应谱较宽,这可能和各种凯尼恩细胞编码的气味信息在该神经元整合汇聚相关。并且,不同类型的蘑菇体输出神经元对气味的反应模式不同,有些类型在不同个体间保守,但有些类型则在不同个体间差异较大(Hige and Turner, 2015)。
3.3 蘑菇体中的气味学习和记忆
在果蝇中,蘑菇体主要在气味相关的学习行为中起到关键作用(Heisenberg, 2003; Keene and Waddell, 2007),气味信息通过蘑菇体内的凯尼恩细胞进行编码(Campbelletal., 2013),蘑菇体输出神经元将气味信息进一步输出,进而介导行为反应(Tanakaetal., 2008; Asoetal., 2014)。蘑菇体之所以能够调控学习记忆,得益于以下3点:嗅觉投射神经元与凯尼恩细胞的数量不对等产生的模式分离(pattern separation);蘑菇体输出神经元直接引起驱避或吸引的行为反应;多巴胺能神经元对凯尼恩细胞和蘑菇体输出神经元间突触的增强或抑制。
单侧触角叶投射到蘑菇体的投射神经元大约180个(约50种类型),其与大约2 000个凯尼恩细胞相连,由于果蝇能用仅50余种类型的投射神经元而识别上千种气味,对某种气味产生精确的记忆就需要将重叠的输入信号进一步分离(模式分离),而大量的凯尼恩细胞则满足了这样的需要(Modietal., 2020)。同种气味能够激活大于50%的投射神经元,但其仅能激活5%的凯尼恩细胞(Wilsonetal., 2004; Turneretal., 2008; Honeggeretal., 2011)。由于模式分离的存在,凯尼恩细胞对不同气味的反应模式差异较大,通过反应模式的差别能够预测果蝇对气味形成记忆的精确性(Campbelletal., 2013)。相反,通过实验的方法(例如,阻断APL神经元的抑制作用)降低凯尼恩细胞对不同气味反应模式的差别,即让其更重叠,能够降低果蝇对气味形成精确记忆的能力(Linetal., 2014)。
与编码各种气味信息的凯尼恩细胞不同,蘑菇体输出神经元能够直接介导刺激源对果蝇的吸引或驱避。例如,利用光遗传学的手段激活MBON-γ5β’2a,使得果蝇对激活光产生驱避;相反,利用同样手段激活MBON-γ1pedc,使其被激活光所吸引(Asoetal., 2014)。蘑菇体输出神经元如何将信息传导到下游神经元并引起行为的机制尚不清楚。目前的研究暗示其与输出神经元释放的神经递质有关,乙酰胆碱能和γ氨基丁酸能神经元一般导致吸引,而谷氨酸能神经元则导致驱避(Modietal., 2020)。
多巴胺能神经元向凯尼恩细胞和蘑菇体输出神经元形成的突触连接释放多巴胺,调控突触连接的信息传递。奖励或惩罚能够引起多巴胺的释放,随后使这些经历与气味联系,促进学习并形成记忆(Claridge-Changetal., 2009; Mao and Davis 2009; Asoetal., 2012; Burkeetal., 2012; Liuetal., 2012; Waddell, 2013; Cohnetal., 2015; Yamagataetal., 2015; Handleretal., 2019)。惩罚信息通过10个前脑后缘侧面(protocerebral posterior lateral 1, PPL1)多巴胺能神经元编码,然而奖励信息则通过120个前脑前缘中部(protocerebral anterior medial, PAM)多巴胺能神经元编码(Riemenspergeretal., 2005; Mao and Davis 2009; Liuetal., 2012; Linetal., 2014; Berryetal., 2015; Cohnetal., 2015; Yamagataetal., 2015)。编码奖励信息的多巴胺能神经元通常抑制凯尼恩细胞和编码驱避行为的蘑菇体输出神经元间的突触传递,反之亦然(Hige and Turner, 2015; Aso and Rubin, 2016)。这种抑制由凯尼恩细胞上的多巴胺受体DopR1介导,通过GaS引起cAMP上升,另外,当奖励或惩罚信息消失后,这种突触的传递反而会被增强,这种增强由凯尼恩细胞上的DopR2介导,通过Gaq引起内质网中的钙离子释放(Hanlderetal., 2019)。
4 气味信息在侧角叶中的编码
4.1 侧角叶的结构
侧角叶是个相对复杂的神经纤维网状结构,与脊椎动物的杏仁体皮质(cortical amygdala)类似。在果蝇中,侧角叶包括大约1 400个神经元,超过165种细胞类型。这些神经元中包含大约560个侧角叶局域神经元(lateral horn local neurons, LHLNs),大约830个侧角叶输出神经元(lateral horn output neurons, LHONs),30%的侧角叶输出神经元与蘑菇体输出神经元汇聚,推测可能调控蘑菇体输出神经元的输出信息。侧角叶输出神经元将信号输出到不同脑区,包括SLP, SIP和SMP。侧角叶输出神经元通过下行神经元连接腹神经索的证据较少(Hsu and Bhandawat, 2016; Namikietal., 2018; Dolanetal., 2019),这表明嗅觉信息传递到腹神经索引发对应的运动行为可能还需要进一步的加工和处理(Dolanetal., 2019)。
4.2 侧角叶中气味信息的编码
同蘑菇体类似,侧角叶同样能够接收触角叶中投射神经元传递的信息,但其连接方式却为固定的模式(Fisek and Wilson, 2014)。例如,传递性信息素信号的投射神经元与侧角叶腹面相连,而传输其他气味信号的投射神经元则与侧角叶背面相连(Jefferisetal., 2007)。并且,特定的气味能够对应激活特定的侧角叶神经元,相对于触角叶的投射神经元,其对气味的反应更为广谱(Frechteretal., 2019)。
4.3 侧角叶与特定气味引起的行为关系
由于缺乏特异作用于该区域的神经遗传学工具,特定气味信息如何通过在侧角叶编码并向下传递引起嗅觉行为的研究较少(Dolanetal., 2019; Frechteretal., 2019)。由于触角叶至侧角叶的神经元连接通常是固定的,这与触角叶至蘑菇体神经元的随机性连接明显不同,暗示了其主要负责先天行为,例如气味引起的趋向运动行为。在果蝇成虫中,cVA通过Or67d嗅觉神经元感受,在触角叶中激活嗅小球DA1。DA1的投射神经元与侧角叶中的LC1和DC1神经元相连,DC1神经元为兴奋神经元,而LC1神经元为抑制神经元,其中,DC1通过下行神经元DN1直接与腹神经索相连,直接影响果蝇的行为,然而LC1则不直接与DN1相连,中间需要何种神经进行处理仍然未知(Rutaetal., 2010)。另外,果蝇成虫通过Or56a感受土臭菌素(gesomin),随后将信息传递到嗅小球DA2,DA2的投射神经元将信息素进一步传递到侧角叶中的AV1a1神经元,该神经元能够触发土臭菌素相关的产卵驱避行为,而AV1a1神经元进一步连接AVLP区域,与两条下行神经元相连,传递信息到腹神经索(Huovialaetal., 2018)。
5 鳞翅目昆虫嗅觉中枢系统对气味信号的整合编码
鳞翅目昆虫是昆虫嗅觉研究的较好模式之一。一方面,该类群体型较大,便于解剖操作;另一方面,该类昆虫不仅依靠独特的性信息素嗅觉感受系统完成交配,并且通过化学气味信号的识别定位寄主。研究鳞翅目昆虫中枢系统对气味信号的整合编码不仅有利于理解昆虫与环境的复杂生态关系,同时也有利于促进鳞翅目害虫行为调控剂的开发,发展新的害虫防治技术。相对于果蝇,在鳞翅目昆虫中进行基因编辑相对困难,尤其是难以有效地敲入转基因标记,目前仅有家蚕能够广泛地应用这类技术。所以,该类害虫的研究仍集中于鉴定气味相关的反应神经元,并且大量的研究还集中于初级嗅觉中枢触角叶。鳞翅目昆虫的性信息素投射到触角叶的特殊位置巨大嗅小球复合体(macroglomerular complex, MGC)区域(Boeckhetal., 1970; Hildebrandetal., 1980; Rospars, 1983, 1988; Arnoldetal., 1985; Christensen and Hildebrand 1987; Rospars and Hildebrand, 1992; Hansson, 1997),MGC区包括3~6个嗅小球,在不同物种中有所差别。例如,烟草天蛾Manducasexta触角叶中MGC区为3个垂直排列的小球(Hansson, 1997);海灰翅叶蛾Spodopteralittoralis、棉铃虫Helicoverpazea和欧洲玉米螟Ostrinianubialis触角叶中MGC区同样由3个嗅小球组成,包括1个较大嗅小球和周围包围的2个嗅小球(Christensenetal., 1991; Ochiengetal., 1995; Antonetal., 1997);黄地老虎Agrotissegetum、小地老虎Agrotisipsilon和烟芽夜蛾Heliothisvirescens则有4个嗅小球(Hanssonetal., 1992, 1995; Gemenoetal., 1998);粉纹夜蛾Trichoplusiani则在MGC区具有6个嗅小球(Toddetal., 1995)。鳞翅目昆虫的性信息素组分往往是两种化学物质以上的混合物,这些气味在MGC区投射的规律在不同物种中也不一致。例如,在家蚕中,主要组分投射于圈形体(toroid)区域(Hanssonetal., 2003; Sakuraietal., 2011);而在棉铃虫中,主要组分则投射于云状体(cumulus)(Wuetal., 2015)。
植物气味等非性信息素气味往往投射到其他嗅小球区域,统称一般嗅小球(ordinary glomeruli, OG)区域(Rospars and Hildebrand, 2000)。植物气味在这些区域投射的位置与其功能相关,例如在烟草天蛾中,产卵相关气味和取食相关气味在脑部明显分为两个激活区域(Bisch-Kadenetal., 2018)。另外,植物气味在脑部投射激活区域的强度还受到生理状态的影响,例如在海灰翅叶蛾中,交配之后其成虫触角叶对植物气味的反应发生明显变化(Saveeretal., 2012; Kromanetal., 2015)。
在果蝇中,多种气味在触角叶中的互作大多是通过侧向激活或抑制而影响投射神经元的反应,而在鳞翅目中,多种气味在特定嗅觉受体神经元上直接互作,从而改变嗅觉受体神经元向触角叶传递信号的强弱:例如,在烟芽夜蛾和小地老虎中,植物气味与性信息素混合后使得性信息素受体神经元对性信息素组分的反应降低,从而减弱触角叶MCG区的反应(Deisigetal., 2012; Pregitzeretal., 2012);在苹果蠹蛾Cydiapomonella中,梨酯和性信息素混合增强性信息素受体神经元对性信息素组分的反应,能够增强触角叶MGC区的反应(Tronaetal., 2013)。
同果蝇类似,气味信息在鳞翅目昆虫中经过触角叶处理后,向高级神经中枢蘑菇体和侧角叶进行传递。但限于技术手段,这方面的研究较为缺乏。目前,系统的研究报道主要集中于家蚕。例如,对于蘑菇体,家蚕性信息素由触角叶MGC区投射至蘑菇体的中心位置,而植物气味投射于蘑菇体的边缘位置(Namikietal., 2013)。对于侧角叶,家蚕性信息素的主要组分由触角叶中的MGC区域(Hanssonetal., 2003; Sakuraietal., 2011)向上投射到侧角叶区域的前脑内侧三角区域(delta area of the inferior lateral protocerebrum, △ILPC),随后继续投射到SMP区域,该区域与侧辅叶(lateral accessory lobe, LAL)相连,随后输出至运动相关的下行神经元(Namikietal., 2014)。而植物气味则从触角叶部位的一般嗅小球投射到侧角叶,随后继续投射到SLP区域(Namiki and Kanzaki, 2019)。
6 小结与展望
外周嗅觉信号在昆虫嗅觉中枢的整合编码对昆虫的生存与繁殖至关重要,果蝇由于其遗传操作技术的优势,使得该领域的研究较为深入。研究集中于初级嗅觉中枢对气味信息的整合与向下传递以及高级嗅觉中枢对这些信息的再次加工。而鳞翅目昆虫则由于遗传操作的限制,大部分研究仍然集中于触角叶内各类神经元的记录。对于果蝇,关于气味如何通过侧角叶整合并引起先天的行为反应仍较为薄弱。未来的研究应针对侧角叶区域开发有效的基因标记,系统解析该区域的神经编码,并鉴定相关行为所对应的下行神经元,以便阐明各类气味引起特异行为反应的神经机制。另外,多种气味对应的嗅觉神经元在蘑菇体、侧角叶及其更深层次的脑区中枢较为复杂,气味间的互作可能不限于触角叶,对于混合气味编码的研究应结合其他嗅觉中枢进行更全面的考虑。对于鳞翅目昆虫,技术的缺陷是限制其嗅觉中枢研究的重要因素。为了改进这一缺陷,未来的研究应集中于突破基因编辑技术,尤其是敲入有效的基因标记,例如将果蝇中的GcaMPs表达于鳞翅目害虫的脑神经中,方便有效而可重复的气味反应的记录;利用新的钙成像技术,如双光子钙成像,结合目前能够在鳞翅目害虫中有效应用的CRISPR-Cas9技术,鉴定重要化合物在触角叶中的感受通路;结合上述基因标记和新的钙成像技术,研究多种气味在鳞翅目昆虫脑中的互作机制,并探讨其与行为的关系,只有针对特定害虫在这些方面进行深入的研究,才能够将模式昆虫的研究结果用于害虫研究和防控的实践中,为未来加速筛选行为调控剂,促进反向化学生态学的发展提供技术支持和理论基础。
