意大利蜜蜂胸部肌肉的胚后发育
2020-03-04李兆英解书钦同利娟王舒闻
李兆英, 孙 婧, 张 敏, 解书钦, 同利娟, 王舒闻
(陕西学前师范学院生命科学与食品工程学院, 西安 710100)
肌肉作为后生动物重要的运动系统,其发育过程复杂但高度协调。昆虫的肌肉均为横纹肌,其结构基本上与脊椎动物骨骼肌相似;同时因为昆虫是一个较简单的模型系统,在肌肉发育的许多方面相对保守,所以通过对果蝇等模式动物的胚胎、幼虫和成体的研究,可以非常详细地描述肌细胞融合、细胞核定位、肌腱附着、神经支配和肌纤维形成等细胞过程。此外,全变态昆虫肌肉的发育过程和脊椎动物肌肉损伤修复有很大的相似之处,这些基本机制的研究在先天性肌肉疾病、衰老和癌症引起的肌肉萎缩等方面的应用使这一领域的发展成为焦点,故有关昆虫肌肉发育的相关研究一直受到广泛关注(罗礼智, 1996; Sambasivan and Tajbakhsh, 2007; Gunageaetal., 2017)。
关于昆虫肌肉发育的研究,黑腹果蝇Drosophilamelanogaster进行得较为系统和完善。在果蝇的胚胎发育过程中,由于基因的差异表达,肌细胞的祖先会迁移到中胚层的特定部位,并聚集成群。中胚层中的1~2个肌源细胞(myogenic cell)继续发育成为肌源性祖细胞(myogenic progenitor cells, MPCs),它们包含了产生特定肌肉所需的所有信息;而细胞群中其他的细胞则成为融合型成肌细胞(fusion-competent myoblasts, FCMs),它们主要通过同成肌细胞的融合,以增加肌纤维的质量以及肌细胞核的数量(Bate, 1990; Bayliesetal., 1998)。MPCs进行不对称分裂,生成奠基细胞(founder cells, FCs)和成虫肌祖细胞(adult muscle progenitor cells, AMPs)。FCs和FCMs相互识别并融合,形成合胞体肌纤维,最终形成幼虫的全部肌肉组织(Abmayr and Pavlath, 2012; Gunageaetal., 2014; Bothe and Baylies, 2016; Dengetal., 2018)。
果蝇成虫的胸部包含有大量的肌肉,它们保持着固定的模式,大多数同飞行相关,但是不同肌肉的形成方式并不相同。在变态发育过程中,大部分的幼虫肌肉降解消失,只有少量的幼虫肌肉保留下来,成为成虫肌肉的形成模板。成虫肌肉的形成依赖于在胚胎期就已形成的一类细胞——成虫肌祖细胞(AMPs)(Reedetal., 1975; Bateetal., 1991)。AMPs形成后会迁移至果蝇成虫盘的翼盘,在那里保持静止,直到幼虫中期快速分裂,形成若干个成肌细胞群——成体肌肉FCs和FCMs(Ruiz-Gómez and Bate, 1997)。在蛹发育早期,大部分的幼体肌肉降解,这些细胞从成虫盘迁移到特定的位置,相互融合形成成虫肌肉(Currie and Bate, 1991; Ruiz-Gómez and Bate, 1997; Abmayr and Pavlath, 2012; Gunageaetal., 2014; Bothe and Baylies, 2016)。果蝇的背腹肌(dorso-ventral muscles, DVMs)就是通过这样的机制形成的(Rivlinetal., 2000; Duttaetal., 2004, 2005)。而果蝇背纵肌(dorsal longitudinal muscles, DLMs)的形成则是通过另外一种机制:在幼虫肌肉组织溶解过程中,果蝇中胸的6块幼虫肌肉(每侧3块)被保留下来,作为成虫DLMs发育的模板。在蛹发育的16 h,幼虫的每条肌纤维纵分为2根,同时FCMs与残留的幼虫肌肉模板融合,形成多核肌纤维;到蛹发育的50 h左右,成虫肌肉基本形成(Fernandesetal., 1991; Roy and VijayRaghavan, 1999)。
对蜜蜂肌肉的研究主要集中在成年蜜蜂肌肉的组织结构上。Morison(1928)对成年西方蜜蜂Apismellifera的间接飞行肌、消化道、心脏、膈肌和生殖器官肌肉的组织结构、生理及生物化学进行了详尽的阐述;Snodgrass(1956)对蜜蜂成虫的肌肉系统进行了系统地描述;Correa-Fernandez和Cruz-Landima(2008)比较了西方蜜蜂A.mellifera工蜂、蜂王、雄蜂和无刺蜂Scaptotrigonapostica的飞行肌在发育过程中肌肉的形态、肌纤维的直径、数量等测量数据上的差异。而关于蜜蜂肌肉完整的胚后发育过程的研究,则未见报道。
本研究通过石蜡切片、苏木精-伊红染色(hematoxylin and eosin staining, HE染色)、BrdU免疫组织化学染色[5-bromo-2-deoxyuridine(BrdU)incorporation]等技术,对意大利蜜蜂Apismelliferaligustica(简称“意蜂”)肌肉的胚后发育过程及组织结构特点进行了比较研究,为蜜蜂肌肉的病理变化研究以及动物肌肉的发育及病理学的研究提供一定的理论证据,也为昆虫作为肌肉再生便利模型的可能性提供理论基础。
1 材料与方法
1.1 实验材料
实验所用的意蜂A.melliferaligustica工蜂幼虫、蛹及成虫均采自西安市长安区秦岭沣峪蜜蜂养殖户,所取试虫均来自同一蜂群。提取巢脾,采集各发育阶段的幼虫(1-5龄幼虫, 分别记为 L1-L5)、预蛹(prepupa, PP)、蛹(pupa, P)(1-9日龄蛹, 分别记为P1-P9)及成虫。根据戴氏定律(Dyar’s law),每头幼虫的龄期通过测量头壳的宽度来决定。其中L1-L5各10头,PP、P1-P5各10头,P6-P9各8头,成年工蜂10头。
1.2 HE染色组织观察
取意蜂工蜂的幼虫、蛹及成虫于多聚甲醛4℃固定过夜。梯度酒精脱水,二甲苯透明。石蜡包埋,连续切片,切片厚度5~7 μm,切片裱于涂有多聚赖氨酸的载玻片上,烘干备用。切片脱蜡后复水,HE染色,OLYMPUS(BX51)显微镜观察拍照。
1.3 BrdU免疫组织化学染色组织观察
1.3.1BrdU掺入处理:取意蜂工蜂幼虫、预蛹、1-9日龄蛹和成虫活体各5~8头,幼虫和预蛹直接从体背侧注射,蛹及成虫从附肢基部注射约3 μL浓度为25 mg/mL的BrdU(B9002, Sigma),掺入时间为8 h。
1.3.2组织切片观察:将BrdU处理过的幼虫、预蛹、蛹和成虫,于4%多聚甲醛4℃固定8 h。70%, 80%, 90%, 95%和100%梯度酒精脱水,石蜡包埋,连续切片,厚度为7 μm。切片裱于涂有多聚赖氨酸的载玻片上,烘干备用。
切片用二甲苯脱蜡,入梯度酒精复水;抗原修复,磷酸盐缓冲液(phosphate buffered saline, PBS)洗3次;3%过氧化氢封闭内源性酶10 min,Tris-HCl缓冲液(Tris-HCl buffered saline, TBS)洗3次;滴加正常山羊血清封闭液,37℃ 30 min;滴加小鼠BrdU单克隆抗体(1/200)(ab8039, ABCAM),湿盒中4℃孵育过夜,PBS洗3次。滴加生物素化山羊抗小鼠IgG,37℃ 120 min,PBS洗3次;滴加过氧化物酶37℃孵育30 min,PBS洗3次;二氨基联苯胺(3, 3′-diaminobenzidine, DAB)显色后镜检,中性树胶封片,Nikon数码显微成像系统(DS-5M)拍照。
阴性对照以PBS代替一抗,其余步骤同上。
2 结果
2.1 意蜂幼虫胸部肌肉的发育
意蜂胸部的部分肌肉在胚胎期就已经形成,在刚孵化的1龄幼虫(L1),可以看到背纵肌(DLMs)(图1: A)和腹纵肌(ventral longitudinal muscles, VLMs)以及足基部的肌肉(图1: B)附着在体壁内突(apodemes, Ap)上;它们具有典型的横纹肌形态,胞核圆形或椭圆形,位于肌纤维边缘。在胸部两侧靠近体壁的地方,有若干成肌细胞聚集,这些细胞呈四方形或多边形,直径约为5~6 μm,胞核圆形,内有深染的颗粒和核线;胞质中的肌原蛋白被伊红染成粉红色;它们的附近一般都有气管分布(图1: C)。有的成肌细胞开始拉长,形成肌纤维,胞核长椭圆形,位于细胞边缘。在成肌细胞周围围绕着许多小型的细胞,直径约为3 μm(图1: D)。
L2时,BrdU标记显示肌细胞处于分裂状态;大型的成肌细胞依然存在,它们中有的也在分裂增殖(图1: E)。背腹肌肌细胞开始形成肌纤维,胞核在肌纤维中整齐地排列成行(图1: E, F)。L2晚期,背腹肌纤维中间的胞核之间出现空泡(图1: G),后空泡逐渐变大,将肌纤维从中间分隔开,最终一条肌纤维分裂为2条(图1: H)。
L3时,肌细胞开始快速分裂,大量的BrdU阳性细胞出现在背部的肌纤维中,胞核变小(图1: I)。到L4时,背纵肌肌纤维纤细,直径约为10~20 μm,按照体节排布;在胸部的背纵肌和背腹肌的肌纤维中,仍能看的少量的BrdU阳性细胞(图1: J)。到末龄幼虫(L5),背纵肌和腹纵肌束已发育完好;腹侧靠近足的肌肉粗壮,肌肉束直径约为100~120 μm,已是典型的幼虫肌肉(图1: K)。
到预蛹(PP)早期,位于背侧的幼虫纵肌束仍然完好,直径约20 μm(图1: L),胞核大,椭圆形,直径约20 μm,内包含有许多大而深染的颗粒,位于肌肉束边缘肌纤维和肌膜之间的肌浆层中。在肌纤维的附近,还有一些小的核团,这些核圆形,直径约为5 μm。到预蛹晚期,意蜂幼虫胸部大部分的肌肉已消失,只在胸部的前侧和后侧靠近足的附近,能看到部分幼虫肌肉。
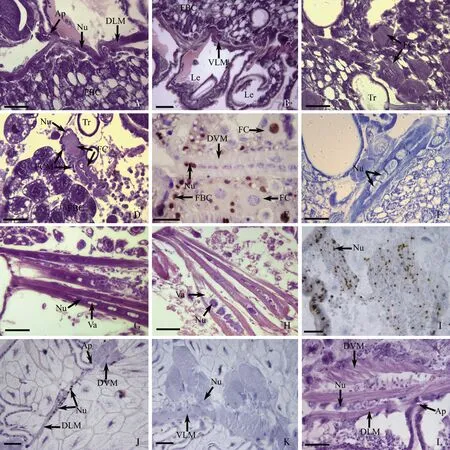
图1 意大利蜜蜂幼虫胸部肌肉的胚后发育
2.2 意蜂成虫胸部肌肉的发育
意蜂蛹发育初期(P1早期),在胸部背侧中央出现了一群细胞,呈水滴形(图2: A)。在“水滴”的基部,发出单个的成肌细胞,这些细胞向着同一个方向延伸,并逐渐开始生成肌丝(图2: B)。随着成肌细胞的延伸,肌丝逐渐排列整齐,但较松散;肌纤维束开始变粗,变长,并在肌纤维束周围形成膜,同其他肌纤维束相分隔(图2: C, D)。随后肌纤维束分散开来,呈纺锤形;肌丝排列规则而整齐,胞核分布在肌纤维束的内部和周围,每束肌纤维有15~20个胞核;肌纤维束长约为80 μm,宽约为30 μm,约有8~10列(图2: D);这时肌肉群的长度约为1 000 μm(图2: C)。P1晚期,意蜂胸部纵切显示,在背侧和腹侧各有一个肌肉群(图2: E),靠上部的肌肉群呈扇形,长度约为1 000 μm(图2: F)。扇形的基部,可见约8~10条细长的、含有胞核的原生质带从胸部的后方向前延伸(图2: F);到顶端,每一条原生质带变粗,胞质内形成排列整齐而紧密的肌丝,构成长方形的肌纤维束;这样的肌纤维束带约有9~10列(图2: F, L)。靠下部的细胞群呈梭形,长度约为1 000 μm,宽度约为500 μm;其两端同上部扇形的细胞群类似,为原生质细胞带,中间逐渐膨大为肌纤维束,同样有9~10列(图2: G)。

图2 意大利蜜蜂蛹胸部肌肉的胚后发育(Ⅰ)
到蛹发育的第2天(P2)(图2: H, K),背侧的肌肉群逐渐延伸(图2: I),其后端已和体壁形成连接(图2: K),其前端也最终会同前侧的体壁形成连接。每个肌肉束中,肌纤维长形,排列整齐,但较疏松,周围分布许多小型的核团(图2: M)。在胸部的前下侧,可以看到2个肌肉群。它们的下部附着在体壁内突上,向胸部前上方延伸、扩展呈扇形(图2: H, K, J);每个肌纤维束呈不规则的多边形(图2: N)。到P2晚期,已能看到蜜蜂成虫胸部肌肉分布的雏形(图2: O)。背侧肌肉群的两端都附着在体壁的内突上(图2: P);腹侧的2个肌肉群也以内突为核心,向胸部的前上方发散、延伸(图2: Q, R),并逐渐占据了胸部的前侧和腹侧(图2: O)。
到蛹发育的第4天(P4),在意蜂胸部的背侧(图3: A, B)、腹侧(图3: C)以及靠近足(图3: D)的肌肉束中,能看到许多BrdU标记的阳性细胞。体壁内侧的细胞在肌肉附着的地方伸长,细胞质形成丝状,与肌肉融合,在外骨骼和肌肉之间建立起联系(图3: B)。到蛹发育的第5天(P5),意蜂胸部的背侧(图3: E, F)和腹侧(图3: G, H)的横肌以及背纵肌(图3: I)已经形成,在肌肉束中仍有少量BrdU标记的阳性细胞(图3: F, H, I)。

图3 意大利蜜蜂蛹胸部肌肉的胚后发育(Ⅱ)
P6时,成虫胸部的肌肉系统已基本形成(图3: J, K),在肌肉束中已看不到分裂的细胞。背腹肌(图3: L)和背纵肌(图3: M, N)的形态相似。肌纤维排列成束,外包肌膜,细胞核在肌纤维中成行排列。在胸部腹侧,分布着控制足部运动的管状肌(图3: O),这些肌纤维非常纤细,直径只有约5 μm;且排列疏松,其间分布着许多小而圆的脂肪体细胞(图3: O)。到成虫时,意蜂胸部已形成典型的横纹肌(图3: P)。
3 讨论
3.1 意蜂幼虫肌肉的形成和发育模式
同脊椎动物类似,昆虫的成肌细胞也来自中胚层。在意蜂幼虫发育早期(L1-L2),有一些大型的细胞,它们多呈四方形或多边形,胞核大而圆,胞质中的肌蛋白被伊红染成粉红色,同周围的脂肪体细胞形成鲜明的对比,这些细胞应该是被称为奠基细胞(FCs)的成肌细胞。它们有的会在幼虫期分裂增殖,最终形成幼虫的肌肉。在FCs周围围绕着许多小型的细胞,这些细胞可能是FCMs,它们会同FCs发生融合,使肌纤维的质量以及细胞核的数量增加(Bate, 1990; Bayliesetal., 1998)。Duch等(2000)在对烟草天蛾Manducasexta背纵肌发育的研究中,也观察到了这些细胞的存在,它们在发育过程会分裂增殖;这些细胞在幼虫期一直存在,到蛹期,它们会聚集或迁移到特定的区域,但是作者没有指出这些细胞的来源。
成熟肌肉细胞的特征通常是存在许多的胞核,对果蝇肌肉发育的研究表明,肌肉的形成是通过FC同FCMs的融合形成的。每一块肌肉都含有一定数量的细胞和细胞核,FC融合FCMs的数量同该肌肉所包含的细胞核数量一致;而不同的肌肉类型,FC所融合的FCMs的数量是确定的。例如一个含有3个胞核的肌肉,是通过2次细胞融合形成的;而具有25个胞核的大型肌肉,则是通过24次细胞融合过程形成的,且这些融合过程是第次完成的,融合完成后就产生了最终的、可收缩的功能单位,即肌纤维(Bayliesetal., 1998; Gunageaetal., 2017)。关于肌肉细胞通过融合的方式形成肌纤维的机制,现在已经研究得非常清楚(Sink, 2006; Bothe and Baylies, 2016)。这一过程从果蝇到高等脊椎动物被保存下来,为研究肌纤维在体内的成熟提供了有价值的模型系统。在意蜂幼虫肌肉的发育过程中,在大型成肌细胞周围,也能看到了许多小核团,但是由于实验手段的限制,无法确定这些细胞与成肌细胞之间确切的相互作用。
蜜蜂幼虫肌肉的模式在胚胎晚期就已经建立,在化蛹前一直保持不变(Bate, 1990)。胸部的部分肌肉(背纵肌和腹纵肌)在胚胎期形成,并一直延续到预蛹期;背腹肌则是在幼虫期才开始发育的。蜜蜂幼虫肌肉的发育方式除了细胞融合外,还可以通过成肌细胞自身的分裂来增加肌细胞以及细胞核的数量,这种肌肉的形成方式,在蜜蜂幼虫胸部几乎所有的肌肉类型(背纵肌、背腹肌和腹纵肌)中都能看到。除此之外,背腹肌还有一种特殊的增加肌纤维数量的方式:肌纤维中间沿细胞核的位置形成空泡,慢慢的空泡变大伸展,最终一根肌纤维纵分为两根。而这种肌纤维数量的增加方式,在果蝇蛹早期的背纵肌中也能够见到(Fernandesetal., 1991),但在幼虫未见报道。
蜜蜂幼虫很少运动,它们主要依赖于工蜂的喂食,所以幼虫的肌肉系统不及自主取食的果蝇幼虫发达。意蜂背纵肌在整个幼虫阶段都呈现为纤细的线状,直径在10~20 μm,整齐地按照体节排布,这种状态一直存在并延续到预蛹期。这些背纵肌在维持幼虫形状以及蛹变态发育过程中起着重要的作用。但是腹侧肌群不同,它们是胸部肌肉中最发达的,尤其在足基部。那里的肌纤维粗大,由腹纵肌连接在一起。背腹肌的发达程度则介于两者之间。这可能同蜜蜂幼虫在蜂巢中的伸展、蜕皮、化蛹等活动有关。同极少运动的蜜蜂幼虫相比,果蝇幼虫各部分肌肉的发育则更加均衡。
3.2 意蜂成虫肌肉的形成和发育模式
昆虫中形成成虫肌肉的成肌细胞来源于中胚层,在胚胎期就已经形成,它们被称为AMPs。它们在果蝇的幼虫期存在于成虫盘中的翼盘(Bateetal., 1991; Currie and Bate, 1991),也被称为变表皮细胞(adepithelial cells),因为它们同成虫盘的表皮细胞密切相关,这些表皮细胞参与了成虫肌肉的形成(Lawrence, 1982)。但是Duch等(2000)对烟草天蛾M.sexta背纵肌发育的研究显示,那些成肌细胞并不是来自于翼盘。果蝇的AMPs形成后便处于静止状态,一直到幼虫发育中期开始增殖,并迁移到成虫盘休眠;变态发育开始时,大多数幼虫的肌肉组织开始溶解,而这些成肌细胞也退出休眠,并迁移到特定的位置,分裂、融合形成成虫的肌肉组织(Fernandesetal., 1991; Roy and VijayRaghavan, 1999)。
昆虫成虫肌肉的形成无外乎3种方式:(1)独立于任何幼体肌肉发育的成虫肌肉;(2)幼虫肌肉部分消失,部分作为模板形成成虫肌肉;(3)幼虫肌肉完全消失,取而代之的是成虫肌肉。在昆虫肌肉系统的形成过程中,这3种方式都有发生。研究表明,果蝇DLMs是在残留的幼虫肌肉模板的基础上发育而来的;胸部的DVMs以及腹部的肌肉则是在幼虫肌肉完全降解后,由成肌细胞重新形成(Fernandesetal., 1991; Bothe and Baylies, 2016);而成虫足部的肌肉则是完全独立发育的,因为它们在幼虫中并不存在。Beinbrech(1968)对伏蝇Phormiaregina以及Duch等(2000)对烟草天蛾M.sexta的研究也证实了这个观点。
Duch等(2000)对烟草天蛾M.sexta的研究显示,幼虫肌肉纤维退化的第1个迹象在游走期(wandering stage)的W3阶段的1 d后很明显,在化蛹时(P0),所有背侧体壁肌肉开始出现退化的迹象;BrdU标记显示,在W2期,未来背纵肌发育区的AMPs细胞核的积累增加;蛹发育2 d后,幼虫肌纤维完全退化,P3后肌纤维中无幼虫胞核存在;成虫肌肉的形成大约在蛹发育的第7天(Duttaetal., 2004)。在果蝇肌肉系统的发育过程中,除了幼虫的DLMs,其他幼虫肌肉的溶解发生在蛹发育早期(大约在化蛹后8 h);成虫间接飞行肌成肌细胞的融合开始于蛹发育的28-30 h;到50 h时,成虫肌肉的形成基本完成(Costello and Wyman, 1986)。意蜂幼虫肌肉的溶解大约发生在蛹早期(PP-P1);成虫胸部肌肉的雏形出现在蛹发育的前2 d(图2);到P4-P5时,成虫肌肉系统的模式已基本形成(图3)。从肌肉发育的时间线上来看,烟草天蛾、果蝇、意蜂基本类似。
本研究结果显示,蜜蜂胸部的肌肉主要源自蛹发育早期形成的2个肌细胞群。背侧扇形肌细胞群的基部是肌细胞的形成区——成肌细胞巢(myoblast nest),它更靠近胸部的背后侧。成肌细胞巢的细胞不断分裂,生成的肌细胞逐渐向背前侧延伸,并逐渐生成肌丝;肌丝从散乱排列到规则有序的成行排列,细胞核也从一个增加到十几个;最终多个肌细胞聚集形成长方形的肌纤维束;当肌肉群延伸到达体壁时,同体壁形成连接。这部分肌肉主要构成了意蜂的背纵肌。胸部的背腹肌及其他的肌肉,则应该源自蛹发育早期胸部腹侧的纺锤形肌细胞群,它具有2个成肌细胞巢(纺锤形的两端),正好同后续发育过程中的2个腹侧肌肉群相对应。这2个肌肉群出现在蛹发育的第2天,它们的基部分别附着在胸部前中部和下部的体壁内突上;它们发出的肌细胞群呈扇形,向胸部的前上侧不断延伸。成肌细胞巢中的细胞可能就是源自在胚胎时就已经形成的AMPs。在意蜂蛹发育的早期(PP-P1),它们迁移至这里,并进行后续的发育,但是它们是从哪里以及如何迁移而来,还需要进一步的实验证明。Lawrence(1982)的研究也显示了,果蝇胸部背侧肌肉群同腹侧肌肉群来源于成虫盘中不同的成肌细胞,它们沿着不同的神经、表皮或气管通路,到达指定的位置(Currie and Bate, 1991)。
意蜂成虫胸部的肌肉源于2个成肌细胞群中的3个成肌细胞巢,肌肉的这种发育模式在果蝇的相关研究中未见描述。此外,果蝇成虫DLMs是成肌细胞围绕幼虫残存的6个DLMs模板,并同它们融合后形成的(Fernandesetal., 1991)。在意蜂蛹发育的第1天(P1),虽然也能看到幼虫残留的DLMs,但是没有迹象显示它们成为了成虫DLMs的模板支架,也许它们只是提供了位置信息。作为昆虫纲中的代表种类,蜜蜂和果蝇分属于膜翅目和双翅目,它们在幼虫和成虫胸部肌肉的形成方式上呈现了不同的状态,这一方面可能同它们的物种差异(翅的类型等)有关,另一方面也可能是由于不同的研究方法造成的。
肌肉和肌腱细胞分别由中胚层和外胚层发育而来。蜜蜂肌肉与外骨骼的连接方式是在蛹发育的第2天就确定了,这个时间早于果蝇(蛹发育的第6天左右)。肌腱是由表皮的内陷形成的,皮下细胞在肌肉附着的地方伸长,细胞质形成丝状,这些未成熟的肌腱细胞可以将肌肉前缘引导向正确的连接位置,并与肌肉融合,在外骨骼和肌肉之间建立起联系(Bate and Rushton, 1993)。
昆虫的肌肉皆为横纹肌,结构基本上与脊椎动物骨骼肌相似,是一种合胞体结构,需经历单核细胞(成肌细胞)之间的相互融合。关于昆虫肌肉形成的研究,揭示了许多直接应用于脊椎动物肌肉发育、维持和修复以及肌肉疾病状态的重要细胞过程。在高等脊椎动物中,与果蝇AMPs相当的细胞是卫星细胞(satellite cell),它们可以促进肌肉的修复和生长。这些细胞从最初的成肌细胞群中分离出来,处于静止状态,并保持与肌纤维的密切接触,直到它们被激活以修复受损的肌纤维或进行其他的生长发育活动。分子生物学研究显示,这两种细胞群的激活都依赖于notc-myc信号,显示了从昆虫到脊椎动物肌源性程序的保守性。而关于昆虫肌肉形成过程中,细胞-细胞融合、细胞分化和去分化、细胞融合后细胞核的生长、成熟以及在肌纤维中的定位等的研究,也将为阐明人类肌肉疾病和肌肉再生的许多机制提供可借鉴的便利模型,同时也将揭示导致肌纤维这种特殊的合胞体器官出现的进化压力(Bothe and Baylies, 2016)。
