二化性家蚕滞育、非滞育和即时浸酸卵中糖代谢相关酶mRNA水平和活性的变化
2020-03-04沈广胜黄静怡王梅仙唐顺明沈兴家
许 瑾, 蒋 涛, 薛 鹏, 沈广胜, 黄静怡, 朱 娟,2,王梅仙,2, 唐顺明,2, 沈兴家,2,*
(1.江苏科技大学生物技术学院, 江苏省蚕桑生物学与生物技术重点实验室, 江苏镇江 212018;2.中国农业科学院蚕业研究所, 农业农村部蚕桑遗传改良重点实验室, 江苏镇江 212018)
滞育是指昆虫在卵、幼虫、蛹等不同发育时期所发生的个体发育进度变缓慢的现象(Renfree, 2015),是昆虫对环境条件长期适应的结果。滞育不仅能够帮助昆虫度过恶劣的生存环境,维持种群的生存,而且可以促使种群发育整齐,增加其交配的机会,有利于种群的繁衍(王力刚等, 2011)。
家蚕Bombyxmori是典型的以卵滞育的昆虫,在原肠胚阶段发生滞育(Yamashita and Yaginuma, 1991)。研究表明,对二化性家蚕在胚胎阶段进行25℃催青,其子代为滞育命运卵;15℃催青,其子代为非滞育命运卵;20℃催青并进行长光照,子代为非滞育命运卵,短光照则子代为滞育命运卵(Nakagakietal., 1991)。家蚕胚胎在发育过程中伴随着大量的细胞分裂和生长,其中,具有滞育命运的家蚕卵在产下后72 h(25℃)细胞分裂速度变缓并维持在G2期,进而逐渐开始进入滞育状态(梁瀚清等, 2014)。家蚕卵一旦进入滞育,只有经过一定的化学或物理刺激如浸酸、摩擦等才能解除滞育。
滞育的发动和解除伴随着大量代谢活动的进行(吴华静, 2018)。糖代谢是家蚕发育过程中存在较为广泛的一种基础代谢,包括糖的分解代谢和合成代谢,主要涉及糖酵解、柠檬酸循环、磷酸戊糖循环和糖异生等途径,而这些途径又是由一系列酶促反应构成的。例如,在糖酵解途径中己糖激酶(hexokinase, HK)能够促进磷酸基团的转移,将葡萄糖磷酸化生成6-磷酸葡萄糖,HK活性的升高有助于家蚕胚胎的发育,是家蚕发育的关键调节剂(Lin and Xu, 2016);磷酸果糖激酶(phosphofructokinase, PFK)负责催化6-磷酸果糖磷酸化生成1,6-二磷酸果糖,是家蚕卵在滞育过程中糖原分解为终产物甘油或海藻糖时起主要作用的酶(Kageyama and Ohnishi, 1971)。在糖异生途径中,磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase, PEPCK)可以推动草酰乙酸进一步转变为磷酸烯醇式丙酮酸,进而促进丙酮酸异生为葡萄糖,使得葡萄糖作为能源物质在漫长的滞育期被缓慢利用(王涛, 2018);家蚕山梨醇脱氢酶(sorbitol dehydrogenase, SDH)是调节山梨醇代谢的关键酶,山梨醇和甘油能作为防冻剂帮助蚕卵度过冬天寒冷的环境条件,随着滞育的终止,山梨醇在SDH催化下转化为糖原,为细胞生长提供能量(蒋涛等, 2017)。海藻糖酶(trehalase, TRE)能够水解海藻糖生成葡萄糖,而葡萄糖是家蚕进行糖酵解的原料,TRE对海藻糖代谢和家蚕卵的越冬、滞育、几丁质的合成以及竞争适应有关(沈兴家等, 2016)。但是,家蚕的滞育性与卵内糖代谢反应关联性的研究仍较少,尚不清晰。
为了探究家蚕胚胎发育早期卵内糖代谢与滞育的关联性,了解家蚕胚胎发育早期卵内糖代谢相关酶的表达调控特性,本研究以家蚕二化性品种“秋丰”为材料,制备滞育命运卵(diapause-destined eggs, DD)、非滞育命运卵(non-diapause-destined eggs, ND)和即时浸酸卵(immediately acid-treated eggs, IA),分别从基因转录水平和酶活性水平分析了家蚕胚胎发育早期卵内几种糖代谢相关酶表达水平的变化,以期为深入阐明家蚕的滞育机制提供参考。
1 材料与方法
1.1 供试昆虫
家蚕二化性品种“秋丰”由本实验室保存。以家蚕二化性品种“秋丰”活化越年蚕卵(丙2期胚胎)为材料,一部分蚕卵采用17℃暗催青,孵化后常规新鲜桑叶饲养,羽化后蛾区内交配产卵,制备非滞育命运卵(ND);另一部分卵25℃明催青,孵化后常规新鲜桑叶饲养,羽化后蛾区内交配产卵,制备滞育命运卵(DD)。将一部分DD在产下后经25℃保护20 h,随后用密度1.075 g/mL、温度为46℃的盐酸溶液浸泡5 min,漂洗后获得即时浸酸卵(IA),IA从浸酸后计算其发育时间。IA在浸酸前的发育同DD,为滞育发育;浸酸后打破蚕卵滞育,胚胎继续发育,与ND类似。3种家蚕卵分别在卵产下或即时浸酸后0, 2, 6, 12, 24, 48, 72和96 h取样,-80℃保存备用。
1.2 主要试剂
TRIzon总RNA提取试剂盒、HiFiScript gDNA Removal RT MasterMix反转录试剂盒和UltraSYBR Mixture试剂盒均购自江苏康为世纪生物科技有限公司,酶活性检测试剂盒购自苏州科铭生物有限公司。
1.3 cDNA合成
1.1节中ND, DD和IA 3种家蚕卵样品分别称取0.100 g,用液氮研磨,加入TRIzon提取总RNA,电泳检测总RNA质量,反转录合成cDNA,-20℃保存备用。
1.4 qRT-PCR检测
利用Oligo 7.0软件根据家蚕基因组中的基因序列设计引物(表1),引物委托浙江尚亚生物技术有限公司合成。选择家蚕己糖激酶基因BmHK(GenBank登录号: XM_004923446)、磷酸果糖激酶基因BmPFK(GenBank登录号: NW_004582016.1)、磷酸烯醇式丙酮酸羧激酶基因BmPEPCK(GenBank登录号: XM_021353172)、山梨醇脱氢酶基因BmSDH-1(GenBank登录号: D13371)和海藻糖酶基因BmTRE(GenBank登录号: S73271)进行qRT-PCR检测,以家蚕BmActin-3(GenBank登录号: X04507)为内参基因。

表1 qRT-PCR引物
反应体系(20 μL): 2×SYBR Premix Ex TaqⅡ10.0 μL, 50×ROX Reference Dye 0.4 μL, cDNA溶液2.0 μL,正反向引物(10 μmol/L)各0.8 μL, ddH2O 6.0 μL。扩增程序: 95℃ 5 min; 95℃ 10 s, 60℃ 30 s, 共40个循环。设置3个生物学重复。在LightCycler® 96荧光定量PCR仪(Roche)上运行。基因的相对表达量用2-△△Ct表示。
1.5 糖代谢相关酶的提取和活性测定
(1)将酶基因名称输入UniProt网站(https:∥www.uniprot.org/database),获得该酶基因的登录号(见1.4节);(2)将酶基因登录号输入NCBI网站(https:∥www.ncbi.nlm.nih.gov/guide/proteins/)中进行查阅,General protein information部分会显示出该酶蛋白的酶学编号;(3)根据酶学编号,选择酶活性检测试剂盒,以确保所测定的酶与酶基因完全对应。取1.1节中ND, DD和IA 3种家蚕卵样品分别称取0.100 g,用电动组织匀浆器进行冰浴匀浆,提取粗酶后用紫外分光光度法(Zhao and Shi, 2010)分别测定家蚕己糖激酶(HK, EC 2.7.1.1)、磷酸果糖激酶(PFK, EC 2.7.1.11)、磷酸烯醇式丙酮酸羧激酶(PEPCK, EC 4.1.1.32)、山梨醇脱氢酶(SDH-1, EC 1.1.1.14)和海藻糖酶(TRE, EC 3.2.1.28)的活性,进行3次独立试验。其中,HK的活性单位为每mg组织蛋白每分钟生成1 nmol的NADPH;PFK的活性单位为每mg组织蛋白每分钟消耗1 nmol的NADH;PEPCK的活性单位为每mg组织蛋白每分钟消耗1 nmol NADH;SDH-1的活性单位为每mg组织蛋白每分钟生成1 nmol NADH;TRE的活性单位为每mg组织蛋白每分钟催化生成1 nmol葡萄糖。
1.6 数据分析
应用SPSS 26.0软件进行统计学分析,实验数据用平均数±标准误(SE)表示,采用Graphpad Prism 5.0和Excel软件作图,采用Duncan氏多重比较方法检验3组蚕卵间差异显著性,P<0.05则认为差异显著。
2 结果
2.1 BmHK的mRNA水平和活性的变化
从qRT-PCR分析结果(图1: A)可以看出,0~96 h内,BmHK基因在家蚕即时浸酸卵(IA)、非滞育命运卵(ND)和滞育命运卵(DD)中的表达水平始终是IA>ND>DD, DD中的与IA和ND中的差异显著(P<0.05),其中DD中BmHK的表达水平最低,在0-24 h呈现逐渐上升趋势,24 h后逐渐下调;ND中BmHK的表达水平处于中间,在0-24 h呈现逐渐上调的趋势,但在48 h时有所下降,72 h时再次上升并达到峰值,96 h时下调至最低值;IA中BmHK的表达水平最高,在6 h时就达到较高水平,72 h时上升至最高值,然后开始下降。
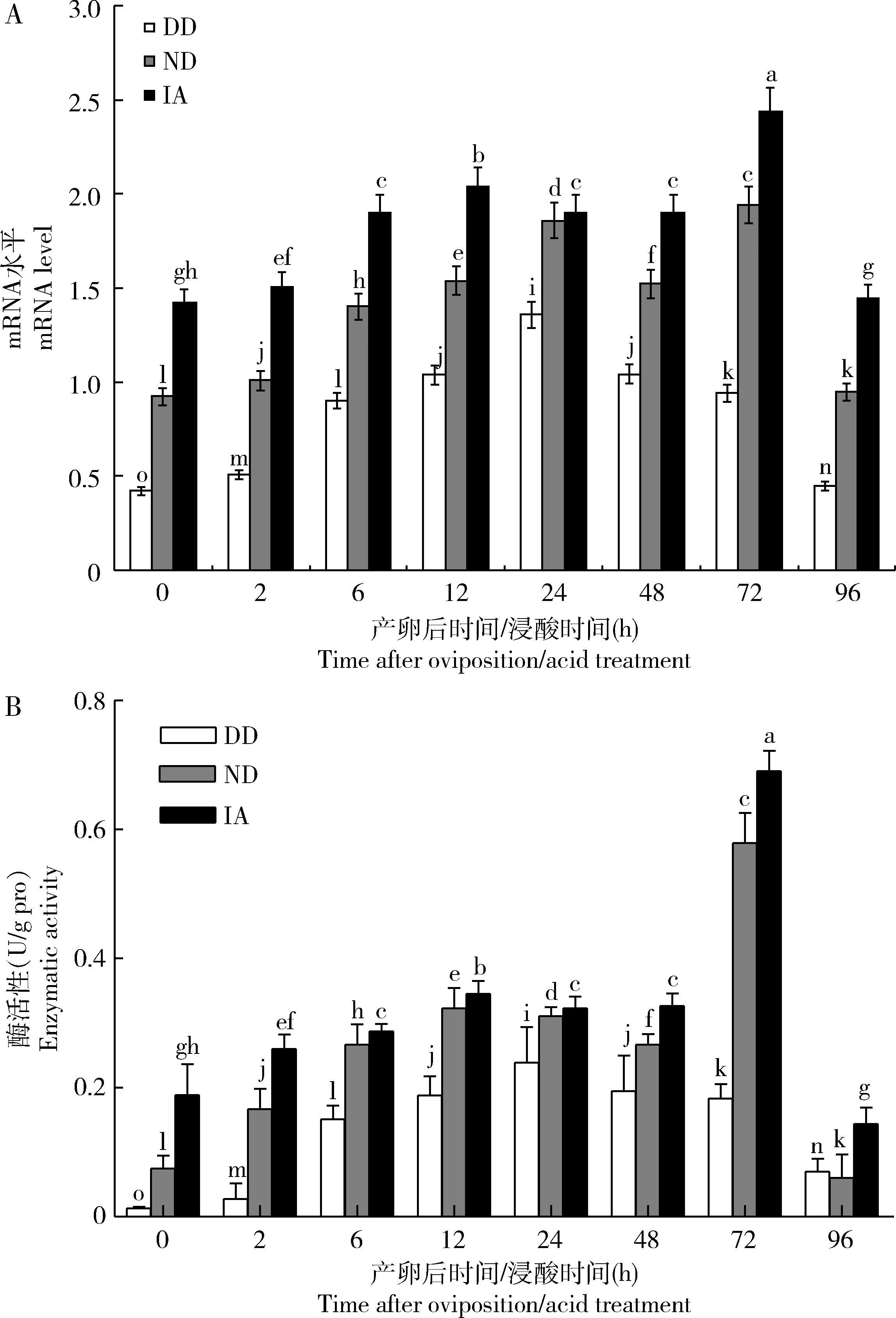
图1 家蚕滞育命运卵(DD)、非滞育命运卵(ND)和即时浸酸卵(IA)中BmHK的mRNA水平(A)和活性(B)
BmHK活性测定结果(图1: B)与qRT-PCR结果吻合,家蚕IA, ND和DD中BmHK活性始终是IA>ND>DD,且DD中的与IA和ND中的差异显著(P<0.05)。BmHK活性在DD中呈现出“上升-下降”的趋势,在24 h时活性最高;在IA和ND中都呈现出“上升-下降-上升-下降”的趋势,尤其是在72 h时活性最高。
2.2 BmPFK的mRNA水平和活性的变化
qRT-PCR分析结果(图2: A)显示,BmPFK在家蚕即时浸酸卵(IA)、非滞育命运卵(ND)和滞育命运卵(DD)中的表达水平为IA>ND>DD,其中DD和ND中BmPFK表达水平相对较低且变化趋势相似,即在0-48 h逐渐上升,48 h后逐渐下降;IA中BmPFK的表达在浸酸处理后2 h时迅速上调,与浸酸前(0 h)差异显著(P<0.05),且在12-48 h内维持高水平,在72 h开始表达水平逐渐下降。
BmPFK活性变化趋势(图2: B)与qRT-PCR结果基本一致,在DD中呈波动式变化,在ND中呈现“上升-下降”的变化趋势,在IA中呈现“上升-平稳-下降”的变化趋势。
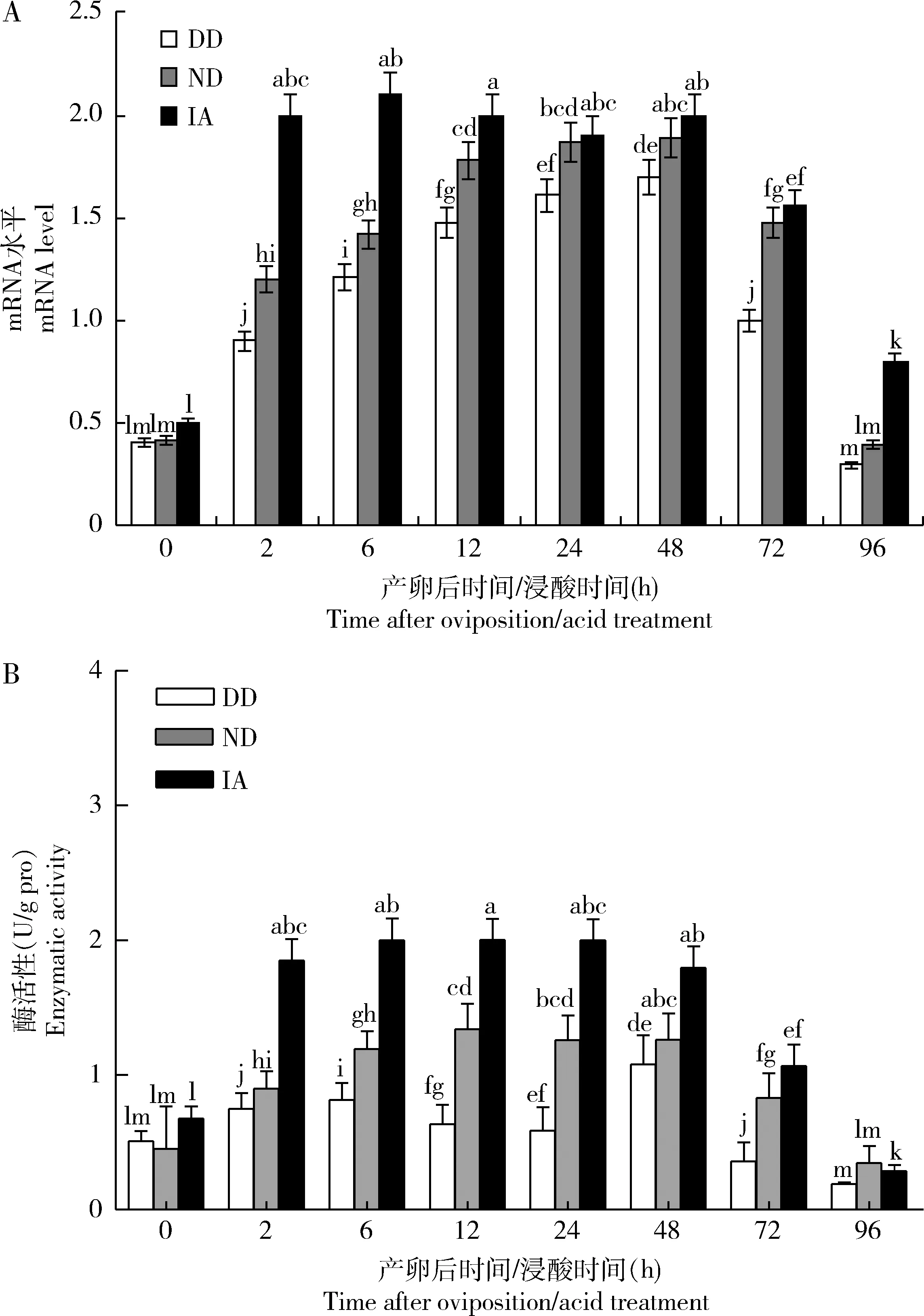
图2 家蚕滞育命运卵(DD)、非滞育命运卵(ND)和即时浸酸卵(IA)中BmPFK的mRNA水平(A)和活性(B)
2.3 BmPEPCK的mRNA水平和活性的变化
qRT-PCR分析结果(图3: A)显示,BmPEPCK在家蚕即时浸酸卵(IA)、非滞育命运卵(ND)和滞育命运卵(DD)的表达水平为:在DD中0-72 h变化不大,96 h显著升至最高值(P<0.05);在ND中0-2 h在较高水平,6-72 h降低并稳定在低水平,72 h后显著升高(P<0.05);在IA中0-2 h表达水平较高,6-72 h降低并稳定在低水平,96 h后达到峰值。
BmPEPCK活性测定结果(图3: B)与BmPEPCK表达水平的变化趋势较一致,且在3种家蚕卵的变化趋势也较一致,呈现出“上升-下降-上升”的变化趋势。
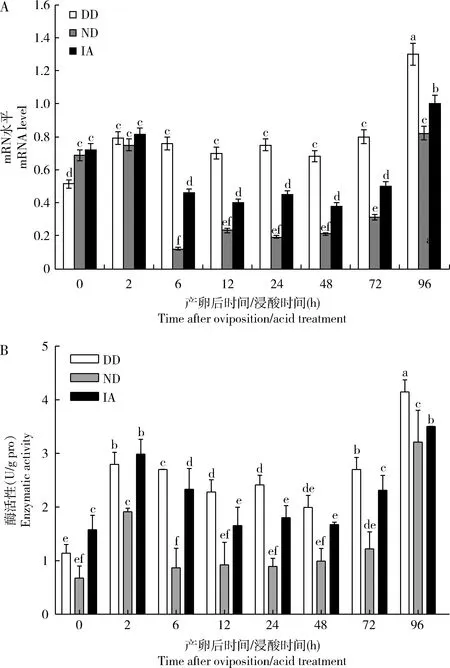
图3 家蚕滞育命运卵(DD)、非滞育命运卵(ND)和即时浸酸卵(IA)中BmPEPCK的mRNA水平(A)和活性(B)
2.4 BmSDH-1的mRNA水平和活性的变化
qRT-PCR分析结果(图4: A)显示,BmSDH-1在家蚕即时浸酸卵(IA)、非滞育命运卵(ND)和滞育命运型卵(DD)中表达水平为IA>ND>DD,其中在DD中的为先下降后上升,6-48 h趋于平稳,从72 h后逐渐下调;在ND中的为先上升,12-48 h趋于平稳,从72 h后逐渐上调;在IA中的为2 h时迅速显著上调并维持在高水平,96 h时再次显著上调(P<0.05)。
BmSDH-1在家蚕IA, ND和DD中活性测定结果(图4: B)与qRT-PCR结果一致,为IA>ND>DD,在DD中呈现出“上升-下降”的趋势;在ND和IA中为在2 h上升后,保持平稳。
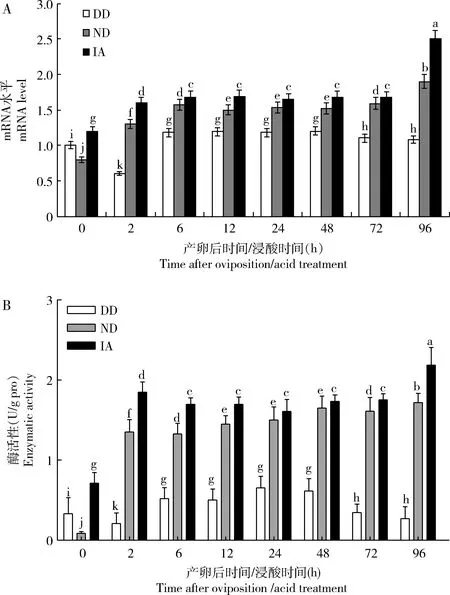
图4 家蚕滞育命运卵(DD)、非滞育命运卵(ND)和即时浸酸卵(IA)中BmSDH-1的mRNA水平(A)和活性(B)
2.5 BmTRE的mRNA水平和活性的变化
qRT-PCR分析结果(图5: A)显示,BmTRE在家蚕即时浸酸卵(IA)、非滞育命运卵(ND)和滞育命运卵(DD)中表达水平为ND>IA>DD,在DD中最低,在0-12 h和72-96 h的变化幅度较小,但在24-48 h的表达水平较高;在ND中的为在0-24 h基本呈现出上升趋势,24 h后逐渐下降;在IA中,12 h 达到峰值,其后虽有下降,但仍维持在较高水平。
BmTRE活性测定结果(图5: B)与qRT-PCR分析结果基本一致,总体上为ND>IA>DD,0-96 h三者差异显著(P<0.05),且在12 h DD中与在其他2种卵中的差异极显著(P<0.01)。
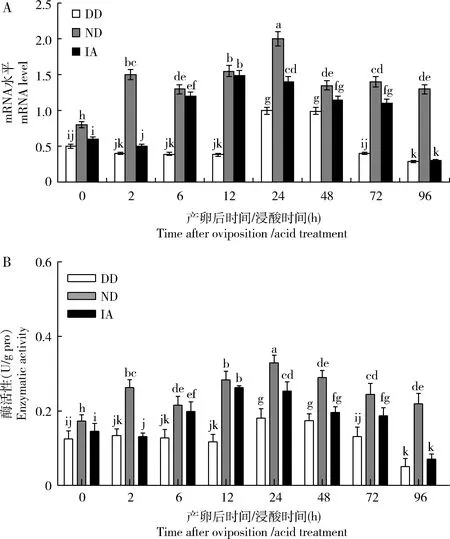
图5 家蚕滞育命运卵(DD)、非滞育命运卵(ND)和即时浸酸卵(IA)中BmTRE的mRNA水平(A)和活性(B)
3 讨论
家蚕是典型的鳞翅目模式生物,根据自然条件下一年发生的世代数将家蚕分为一化性、二化性和多化性(吕鸿声, 1991),其中二化性品种子代滞育性受亲代胚胎期环境条件的调控(黄君霆, 2003)。研究显示,不同滞育性蚕卵的糖代谢水平会有所不同(蒋涛等, 2017),但是对于卵内糖代谢水平与滞育的关系还没有系统的研究,为此我们分析了来自家蚕二化性品种的滞育命运卵(DD)、非滞育命运卵(ND)和即时浸酸卵(IA)中糖酵解、糖异生相关酶以及常见的昆虫特异性糖代谢相关酶的基因转录水平及活性变化。
本研究选取了糖酵解相关酶HK和PFK,通过分析其在二化性家蚕不同处理蚕卵中表达水平,进一步探索了糖酵解与家蚕滞育的关联。HK广泛存在于脊椎动物和无脊椎动物中,包括4种不同的亚型,在进化上高度保守并与多种生理活动密切相关(姚金美等, 2016)。在本研究中,家蚕ND和IA中BmHK的mRNA水平相比DD中的均显著上调,且ND和IA中BmHK的mRNA水平在72 h达到最大值(图1),说明ND和IA的胚胎发育迅速,需要通过大量的HK催化葡萄糖发生磷酸化,为ATP的生成提供底物,其体内糖酵解代谢活跃。Castro-Sosa等(2017)在果蝇(Drosophilidae)中也发现,非滞育型蛹中HK表达水平显著高于滞育型蛹(李毅平等, 2000)。推测家蚕ND和IA中BmHK活性显著高于DD的原因可能与6-磷酸葡萄糖的产生有关,研究表明,HK能够催化葡萄糖的磷酸化,产生6-磷酸葡萄糖,6-磷酸葡萄糖能够为糖酵解终产物丙酮酸的生成提供底物,从而促进蚕卵的发育。另外,HK在滞育解除过程中还能催化葡萄糖转化为氨基酸、脂肪等物质,产生大量能量,促进家蚕胚胎头部和胸节的分化(范兰芬等, 2011)。李毅平等(2000)对松针瘿蚊Thecodiplosisjaponensis越冬期间体内HK活性的研究显示滞育越冬期间HK的酶活力较低,这一结果与本研究结果相似,表明HK的表达水平和昆虫的滞育性密切相关。
PFK是糖酵解途径的限速酶,可分为两种:PFK1催化的产物为1,6-二磷酸果糖,PFK2的催化产物为果糖-2,6-双磷酸。本研究中,3组家蚕卵的BmPFK表达水平有显著差异,DD中BmPFK表达水平显著低于其余两种卵中的(图2),说明ND和IA卵的胚胎需要通过糖酵解生成1,6-二磷酸果糖和ATP,以满足其快速发育需求。成卫宁等(2009)关于麦红吸浆虫Sitodiplosismosellana滞育的研究也同样发现,PFK活性在滞育前后差异显著,滞育后PFK活力降低,滞育解除后PFK活力升高。本研究中推测ND和IA中BmPFK表达水平显著高于DD的原因可能与1,6-二磷酸的生成有关。大量试验证明,PFK能够催化6-磷酸果糖的磷酰基移位产生1,6-二磷酸果糖,1,6-二磷酸果糖作为中间产物为糖酵解的底物水平磷酸化提供原料,促进ATP的形成,为家蚕胚胎发育提供能量。在本研究中DD中BmPFK表达水平在产卵后48 h时突然出现峰值(图2),这可能与此时DD胚胎的胚盘快速发育成匙状胚胎(吕鸿声, 1991),出现短暂的细胞分裂速度加快,机体消耗的能量增多有关。据报道,果蝇中PFK基因的突变会对滞育的解除产生不利影响,该现象与果蝇的PFK基因中存在缺氧反应元件(HRE)有关,该元件能够在机体缺氧的条件下促进卵黄发育,有利于滞育的解除(陶萍和吴耀生, 2006; Zhaietal., 2016),推测家蚕PFK基因中可能也存在这样的调控元件在影响家蚕的滞育性。
PEPCK是调节糖异生的关键酶,催化糖异生的第一步,也是限速步骤,能够协助在需要能量的活动中动员能量底物,对维持体内葡萄糖稳定至关重要(蒋雯卿, 2011)。本研究中,家蚕DD中BmPEPCK的mRNA水平比ND和IA中的上调(图3),推测可能与磷酸烯醇式丙酮酸合成有关,通过糖异生过程储存更多能量以满足次年解除滞育后胚胎发育的需要。
研究表明,PEPCK能够催化草酰乙酸发生反应生成磷酸烯醇式丙酮酸,为糖异生终产物葡萄糖的生成提供反应原料,从而为滞育期胚胎的发育储备能量。严盈等(2009)发现滞育果蝇中PEPCK的活性显著高于非滞育果蝇,与我们的研究结果一致,证实了家蚕DD中发生了更高水平的糖异生反应。并且家蚕DD胚胎在逐渐进入滞育的过程中卵黄细胞向四周移动,以包围状态牢牢地附着在胚胎上,进而引起呼吸及其他生理变化的强度降低(Zhaietal., 2016),在此情境下PEPCK表达水平的升高可导致调动能源的速度减慢,卵内的代谢以能量的合成与贮存为主。卵内储备的能量越多,家蚕胚胎在恶劣环境中的存活时间就越长。
家蚕有3个SDH基因,即BmSDH-1,BmSDH-2a和BmSDH-2b,均位于家蚕第21号染色体,家蚕卵中山梨醇含量与滞育的发动和解除有着密切的关系(朱娟等, 2018),BmSDH-2a与BmSDH-2b不论是基因结构还是其编码蛋白结构都有很高的相似性,BmSDH-2a与BmSDH-2b的同源性高达96.4%,亲缘关系很近;而它们与BmSDH-1的同源性只有49.7%,亲缘关系较远,说明BmSDH-2a和BmSDH-2b可能具有相似的生理功能,而BmSDH-1 则存在较大差异。本研究中,对BmSDH-1基因的表达水平进行了检测,家蚕ND和IA中BmSDH-1的表达水平比DD中的上调(图4),这一结果可能与糖原的生成有关。ND和IA的胚胎发育过程中需要更多的SDH-1,将山梨醇氧化为D-果糖,参与糖代谢过程的中间反应,产生能量以满足胚胎发育的需要。研究表明,家蚕在滞育过程中,SDH-1基因的表达受到抑制,糖原大量转化为山梨醇,并在滞育卵中积累起来。山梨醇可与胚胎细胞中的自由水结合,自由水减少,使所有的活体功能停滞,从而抑制代谢水平(Niimietal., 1993)。滞育解除时由于细胞分裂较快,需要消耗大量能量,SDH催化山梨醇脱氢生成糖原,糖代谢向能源分解的方向进行。
海藻糖是家蚕卵重要的抗冻保护性物质,TRE在调节体内海藻糖含量方面有着十分重要的作用。在本研究中,家蚕ND与IA中BmTRE的mRNA水平高于DD中的(图5),推测其原因可能与葡萄糖的生成有关。ND和IA发育过程中需要较多的TRE将海藻糖水解成葡萄糖,满足胚胎发育需要。而DD的海藻糖含量需要在胚胎进入滞育后维持在较高水平,从而为次年解除滞育后胚胎发育提供能量,同时提高胚胎的抗逆能力。研究表明,当家蚕卵滞育被解除时,海藻糖会在TRE的催化下水解为葡萄糖,作为能源物质直接被胚胎发育利用,葡萄糖也可作为糖酵解的原料进入糖酵解途径,为胚胎发育提供能量。李毅平等(2000)对松针瘿蚊的研究发现,其越冬幼虫在进入滞育的过程中TRE活性较低以维持体内海藻糖较高含量,当滞育被解除时,TRE活性则升高,以分解体内积累的海藻糖,这与本研究结果相似,证实了滞育解除时需要TRE分解海藻糖。张顺益等(2015)对桃小食心虫Carposinanipponensis进行研究,发现桃小食心虫解除滞育后TRE活力显著升高,这些结果提示家蚕滞育的解除可能与TRE催化海藻糖的分解有关。
综上所述,不同发育命运的蚕卵中进行代谢的强度和类型不同,滞育命运卵主要偏向于能量储备,更多的进行能量和物质的贮存代谢,而非滞育命运蚕卵由于胚胎发育进程较快,更多的进行物质分解代谢,满足胚胎发育所需。本研究对糖代谢相关酶在蚕卵发育过程中表达水平变化的揭示将有助于对蚕卵滞育机制的进一步研究。
