高效液相色谱-串联质谱法测定水果中叶酸及其稳定性
2020-03-03叶晓利康文怀李巧玲李慧秦玲
叶晓利,康文怀,李巧玲,李慧,秦玲
河北科技大学生物科学与工程学院(石家庄 050018)
叶酸(Folic acid,FA或Folate)又称维生素B9,是天然存在的叶酸的总称,是人体正常发育和生长所必需的B族水溶性维生素,由喋啶(Pteridine)、对氨基苯甲酸(p-aminobenzoate)和带有一个或多个谷氨酸盐(Glutamate tail)三部分组成,叶酸分子结构及其衍生物如图1所示。叶酸是人体内关键的辅助因子,在核酸、蛋白质、甲硫氨酸、丝氨酸等生物合成和代谢的单碳转移反应中充当辅酶[1-2],其缺乏可以增加许多疾病的风险,如诱发神经管缺陷、脊柱裂、无脑畸形[3]、心血管疾病、儿童白血病[4]、巨幼红细胞性贫血[5]、老年人的神经认知衰退以及某些类型的癌症等[6-7],怀孕期间摄入叶酸可有效降低新生儿神经管缺陷的发生[8]。

图1 叶酸分子结构及其衍生物
人体自身不能合成叶酸,必须从日常膳食中获得[9],因此有必要寻找富含叶酸的食物。天然叶酸来源有绿叶蔬菜、豆类、谷类、水果、坚果、肝脏等[10-12]。水果是一类容易得到、加工简单或无需加工的日常食物,且富含水分和各种维生素,天然叶酸的含量相对较高。尽管许多食物含有丰富的天然叶酸,但叶酸不稳定,受温度、紫外线、溶液pH、储存时间、氧等因素影响[13-14],因此需要对叶酸的稳定性进行分析。检测叶酸的常用方法有微生物法[15]、荧光检测法[16]、高效液相色谱法,微生物法能检测叶酸及衍生物的总量,但高效液相色谱法、高效液相色谱-串联质谱法能测出单种叶酸的含量[17],且快速、灵敏度高。试验以常见的10种水果为原料,采用三酶法[18]提取水果中的叶酸(PteGlu)、四氢叶酸(H4PteGlu)、5-甲基-四氢叶酸(5-CH3-H4PteGlu),通过HPLCMS/MS进行测定,并选取不同的温度、处理时间、pH进行稳定性研究。
1 材料与方法
1.1 材料与试剂
水果(市售);PteGlu、H4PteGlu、5-CH3-H4Pte-Glu、LC-MS级乙腈、甲酸(上海安谱实验科技股份有限公司);2-巯基乙醇(成都艾科达化学试剂有限公司);抗坏血酸(天津市大茂化学试剂产);二硫苏糖醇(DTT):麦克林化学试剂有限公司;蛋白酶(链丝菌蛋白酶E)、α-淀粉酶(美国Merck公司);未过滤的大鼠血清、磷酸二氢钾(KH2PO4)、磷酸氢二钾(K2HPO4)、活性炭:中国国药集团化学试剂有限公司。
1.2 仪器与设备
安捷伦1290高效液相色谱-安捷伦G6420三重串联四级杆质谱仪(安捷伦科技有限公司);TGL-16高速冷冻离心机(湘仪离心机仪器有限公司);MHY-22769旋涡振荡器(北京美华仪科技有限公司);ME104E电子天平(梅特勒-托利多仪器有限公司);ZWY-100H/240恒温培养振荡器(上海智城分析仪器制造有限公司)。
1.3 方法
1.3.1 标准溶液的配置
用50 mmol/L磷酸钾缓冲液(pH 7,含有1%的抗坏血酸和0.2% DTT[19])制备0.1 mg/mL的3种叶酸标准溶液,作为储备液,再用缓冲液配制PteGlu、H4PteGlu和5-CH3-H4PteGlu的系列质量浓度:10,20,40,60,80和100 ng/mL。
1.3.2 色谱条件
色谱柱:Aglient UPLC Poroshell C18柱(75 mm×2.1 mm×1.7 μ m)。流动相:A为0.1%甲酸-水溶液,B为0.1%甲酸-乙腈溶液。流速:0.2 mL/min。进样量:1 μL。梯度洗脱程序:0~1 min(10% B),1~5 min(10%~80% B),5~10 min(80%~10% B),10~13 min(10% B)。柱温:30 ℃。
1.3.3 质谱条件
电喷雾正离子模式,多反应检测(MRM)模式;电喷雾电压4 000 V,离子源温度250 ℃,干燥气温度300 ℃,干燥气流量10 L/min。
1.3.4 样品的提取及含量的计算
取2.50 g水果于研钵中,加入5 mL 50 mmol/L磷酸钾缓冲液(pH 7,含有1%的抗坏血酸和0.2% DTT)进行研磨[20],之后放入10 mL的试管并在旋涡振荡器上混匀,将样品煮沸10 min,冰上冷却10 min,加入25 μL α-淀粉酶(20 mg/mL)混匀,放置10 min,加入200 μL蛋白酶(4 mg/mL)混匀,放恒温培养振荡器中(37 ℃,250 r/min,1 h),煮沸灭菌10 min,冰上快速冷却20 min,加入100 μL经活性炭处理过的大鼠血清[21],将样品于恒温培养振荡器中(37 ℃,250 r/min,1 h),冰上冷却20 min,离心(4 ℃,14 000 r/min,30 min)。取上清液,用超滤管(10 kDa Millipore)在离心机上过滤(4 ℃,12 000 r/min,30 min)[13],取滤液分析。每个样品重复3次,提取全过程在避光或弱光下进行。
提取溶液用HPLC-MS/MS进行检测,得出的峰面积带入标准曲线,得提取溶液中叶酸的溶度,并按式(1)计算叶酸的提取含量。

式中:m为叶酸的提取含量,μg/100 g;c为提取液的质量浓度,ng/mL;V为提取液的体积,mL;M为水果的质量,g。
1.3.5 叶酸的稳定性研究及叶酸回收率计算
分别用pH为6,7和8的磷酸钾缓冲液(50 mmol/L,含有1%的抗坏血酸和0.2% DTT)制备1 μg/mL的PteGlu、H4PteGlu和5-CH3-H4PteGlu 3种标准溶液,3种pH不同的标准溶液在室温(25 ℃)、37 ℃条件下分别放置4,8和12 h和在100 ℃条件下煮沸10,15和20 min,冷却后进行测定。3种叶酸回收率计算为处理后检测到的叶酸峰面积和未处理叶酸峰面积的百分比,如式(2)所示。

式中:s为处理后叶酸的峰面积;S为未处理叶酸的峰面积。
1.4 数据统计分析
所有试验数据采用SPSS Statistics 17.0软件进行方差分析(Analysis of variance,ANOVE),使用Origin 8软件进行统计并绘图。
2 结果与分析
2.1 色谱和质谱条件的优化
试验对流动相(乙腈-水溶液、0.1%乙酸乙腈溶液-0.1%乙酸溶液、0.1%甲酸乙腈溶液-0.1%甲酸溶液)进行了考察。结果表明,流动相采用加酸体系有助于化合物的离子化,使响应值增大,增加灵敏度;加入甲酸较乙酸分析时间短,峰形更好,如图2所示。因此选用0.1%甲酸乙腈溶液-0.1%甲酸水溶液作为流动相,以获得更好的分离效果和仪器响应。
在电喷雾正离子(ESI+)模式下,对3种叶酸标准溶液进行稀释和母离子全扫描,确定各分子离子峰;再以化合物的分子离子为母离子,对其子离子进行全扫描,选择信噪比高、峰形好、干扰小的离子对作为定量、定性离子对,对子离子的破碎电压、碰撞能量等参数进行优化,结果见表1。
2.2 工作曲线、定量检出限和回收率
试验以3种叶酸浓度为横坐标,以峰面积为纵坐标,绘制PteGlu、H4PteGlu、5-CH3-H4PteGlu的工作曲线,质量浓度为10~100 ng/mL,得到线性回归方程及相关系数,3种叶酸均有较好的线性关系。以信噪比(S/N)为3确定检出限(LOD),以信噪比(S/N)为10确定定量限(LOQ)。取橙子和猕猴桃,加入3种叶酸标品,质量浓度为40,60和80 ng/mL,按照1.3.4小节进行操作,每个添加浓度平行3次,计算平均回收率,结果如表2所示。检出限、定量限和回收率
2.3 常见水果中3种叶酸的提取含量
表3表示10种常见水果中PteGlu、H4PteGlu、5-CH3-H4PteGlu的含量。不同的水果PteGlu含量差异较大,含量范围在3.11~27.33 μg/100 g之间,其中猕猴桃、芒果、香蕉PteGlu含量相对较多,含量在20 μg/100 g以上,而橙子、柠檬、火龙果、葡萄PteGlu含量相对较少,含量在6 μg/100 g以下。水果中H4PteGlu的含量,猕猴桃中H4PteGlu的含量明显多于其他水果,含量约为26.87 μ g/100 g,剩余水果含量在10.65~12.46 μ g/100之间。葡萄中5-CH3-H4PteGlu的含量明显高于PteGlu、H4PteGlu,含量达到32.72 μg/100 g。猕猴桃中3种叶酸的总含量最高,达到63.09 μg/100 g,柠檬的含量最低,含量为27.47 μ g/100 g。
2.4 叶酸的稳定性
2.4.1 不同的温度、时间、pH对PteGlu稳定性的影响
图3表示不同的温度(A室温、B 37 ℃、C 100℃)、时间、pH对PteGlu稳定性的影响。由图3(A)可以看出,在室温条件下,随着时间的延长,PteGlu的保留率略有减少,不同pH对PteGlu的稳定性有影响,在pH 7和8较pH 6稳定。由图3(B)可以看出,在37 ℃条件下,时间对PteGlu稳定性的影响不大,PteGlu在pH 7较pH 6和8条件下稳定。由图3(C)可以看出,在100 ℃条件下,PteGlu在pH 7和8条件下保留率在87%以上,在pH 6时稳定性明显下降,保留率在65%左右,这可能是PteGlu在酸性高温条件下转化为叶酸的其他衍生物[22]。

图3 不同的温度、时间、pH对PteGlu稳定性的影响
2.4.2 不同的温度、时间、pH对H4PteGlu稳定性的影响
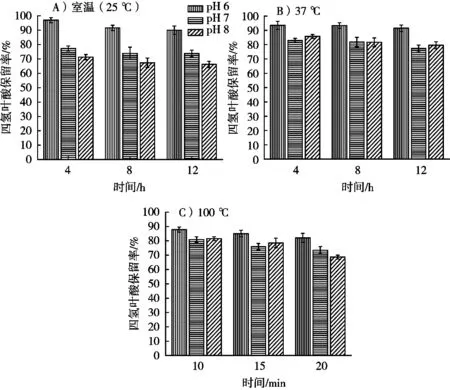
图4 不同的温度、时间、pH对H4PteGlu稳定性的影响
图4 表示不同的温度(A室温、B 37 ℃、C 100℃)、处理时间、pH对H4PteGlu稳定性的影响。由图4(A和B)可以看出,在室温和37 ℃条件下,时间对H4PteGlu的稳定性影响较小,但pH对H4PteGlu的稳定性较大,pH在6时,H4PteGlu的保留率在90%以上。在100 ℃条件下,随着煮沸时间的延长,H4PteGlu保留率逐渐降低,且在pH 6较pH 7和8稳定。H4PteGlu不稳定可能是H4PteGlu在中性或弱碱性条件下转化成5,10-CH2-H4PteGlu或H2PteGlu[13]。
2.4.3 不同的温度、时间、pH对5-CH3-H4PteGlu稳定性的影响
图5表示不同的温度(A室温、B 37 ℃、C 100℃)、时间、pH对5-CH3-H4PteGlu稳定性的影响。在pH 6的条件下,5-CH3-H4PteGlu在不同温度和时间下都很稳定,保留率在95%以上,但不同的pH对5-CH3-H4PteGlu稳定性的影响较大,这可能是5-CH3-H4PteGlu在中性和偏碱性条件下转换为5-CH3-5,6-H2PteGlu,使其保留率下降[23]。

图5 不同的温度、时间、pH对5-CH3-H4PteGlu稳定性的影响
3 结论
试验建立了HPLC-MS/MS测定水果中叶酸、四氢叶酸、5-甲基-四氢叶酸的方法。该方法灵敏度高、检出限低,5-甲基-四氢叶酸的检出限为1 ng/mL,叶酸、四氢叶酸的检出限均为2 ng/mL,相关系数R2均大于0.99,平均回收率在59.34%~65.67%之间。研究发现,10种水果中3种叶酸的含量差异较大,叶酸的含量范围在3.11~27.33 μ g/100 g之间,四氢叶酸的含量范围在10.65~26.87 μg/100 g之间,5-甲基-四氢叶酸的含量范围在8.33~32.72 μg/100 g之间,3种叶酸的总含量的大小为猕猴桃>香蕉>芒果>葡萄>梨>橙子>苹果>桔子>火龙果>柠檬。pH对3种叶酸稳定性的影响较大,温度和时间影响相对较小,叶酸在pH 7较稳定,四氢叶酸和5-甲基-四氢叶酸在pH 6较稳定。该研究为人们合理摄入叶酸提供参考依据,也为叶酸及衍生物的分析提供技术支持。
