氧化苦参碱对过氧化氢刺激的胰腺腺泡细胞高迁移率族蛋白B1表达和释放的影响
2020-03-02李仁礼向晓辉周子栋张文成夏时海
李仁礼 向晓辉 周子栋 张文成 夏时海
1武警后勤学院,天津 300309;2武警特色医学中心消化疾病研究所,天津 300162;3天津市肝脏胰腺纤维化与分子诊疗重点实验室,天津 300162
急性胰腺炎(AP)是由多种病因引起的胰腺的一种炎症状态,胰腺腺泡细胞受损和胰蛋白酶原的激活是AP发生的最初病理生理过程[1-2],其中细胞内活性氧(reactive oxygen species, ROS)与抗氧化系统失衡是胰腺腺泡细胞受损的主要因素[3]。活性氧主要包括单态氧(O)、超氧化物(O2-)、羟基(OH-)和过氧化氢(hydrogen peroxide, H2O2)等[3-4]。研究发现高浓度H2O2可引起细胞氧化应激损伤甚至坏死,伴随相关应激蛋白表达增加[5]。高迁移率族蛋白B1(high mobility group box 1, HMGB1)是一种高度保守的核蛋白,作为DNA伴侣蛋白参与DNA复制、重组、转录和修复,而细胞外的HMGB1作为一种损伤相关分子模式参与炎症和免疫反应,在多种疾病中发挥着复杂的病理生理功能[6-10]。然而H2O2在胰腺腺泡细胞HMGB1表达和释放过程中的作用机制尚不清楚。氧化苦参碱(oxymatrine, OM)是从苦参中提取出的一种生物碱,具有抗炎、抗病毒、抗纤维化等药理作用[11]。本课题组前期研究证实OM能抑制脂多糖诱导的胰腺腺泡AR42J细胞的炎症反应[12]。本研究观察OM对H2O2刺激后AR42J细胞HMGB1表达和分泌的影响,探讨HMGB1在AP发病机制中的作用。
材料与方法
一、H2O2作用于AR42J细胞的最佳浓度选择
AR42J细胞购于ATCC库(American type culture collection),常规培养、传代。采用四唑盐(MTT)比色法检测细胞存活率。取对数生长期细胞,常规消化后制成细胞悬液,以5×103个/孔接种于96孔板培养24 h,更换终浓度分别为0、0.04、0.08、0.16、0.32、0.64 mmol/L H2O2的培养液,每个浓度设置3个复孔,孵育24 h后每孔加入20 μl MTT溶液(5 mg/ml)继续培养4 h后,弃培养液,每孔加入150 μl的二甲基亚砜,震荡10 min,酶联免疫检测仪测定波长490 nm处的吸光值(A490值),绘制细胞生长曲线,确定H2O2作用于AR42J细胞的最佳浓度。
二、AR42J细胞分组与干预
取对数生长期AR42J细胞,以1.0×106个/孔接种于6孔培养板,随机分为对照组、H2O2组、H2O2+OM组。H2O2组及H2O2+OM组加入等容积的H2O2(H2O2最佳浓度),对照组加入等容积的三蒸水,H2O2+OM组在加入H2O2前0.5 h加入OM(终浓度0.5 g/L[12]),培养 24 h后收集细胞及细胞培养上清液。
三、AR42J细胞HMGB1蛋白表达量检测
应用RIPA蛋白裂解液抽提细胞总蛋白, BCA法定量蛋白,行常规蛋白质印迹法检测细胞HMGB1蛋白表达水平,以GAPDH作为内参。GAPDH抗体(1∶1 000)、HMGB1抗体(1∶1 000)均购自美国Proteintech公司,HRP标记山羊抗兔IgG(1∶1 000)、ECL发光液均购自北京Solarbio公司。应用Image J软件扫描条带,以目的条带与GAPDH条带灰度值比作为蛋白表达量。
四、AR42J细胞上清液HMGB1蛋白水平检测
收集6孔板中各组细胞培养液,3 000 r/min离心20 min,离心半径5 cm。收集上清液,采用酶联免疫吸附试验(ELISA)检测上清液中的HMGB1水平。HMGB1酶联免疫检测试剂盒购自南京建成生物工程有限公司,按说明书操作。使用ELISAcalc软件绘制标准曲线,计算样品浓度。
五、AR42J细胞内HMGB1蛋白定位检测
采用免疫荧光法检测HMGB1在细胞内的定位。取各组AR42J细胞爬片,4%多聚甲醛固定15 min,0.5% TritonX-100室温放置20 min,山羊血清封闭1 h,滴加HMGB1一抗(1∶75),4 ℃湿盒中孵育12 h,避光滴加羊抗兔IgG-FITC二抗(1∶250,北京Solarbio公司),37℃孵育1 h,滴加4′,6-二脒基-2-苯基吲哚(DAPI,即用型,北京Solarbio公司)核染10 min后进行封片,荧光倒置显微镜下观察,摄片,应用Image-ProPlus 6.0进行分析。
六、统计学处理

结 果
一、不同浓度H2O2对AR42J细胞生存率的影响
0、0.04、0.08、0.16、0.32、0.64 mmol/L H2O2处理AR42J细胞24 h后的生存率分别为100%、(96.24±6.21)%、(95.38±3.15)%、(77.20±3.65)%、(16.26±2.74)%、(2.72±0.16)%(图1)。0.04、0.08 mmol/L H2O2对AR421细胞的生存率无显著影响,0.16、0.32、0.64 mmol/L H2O2均能显著抑制AR42J细胞的生存率,差异有统计学意义(t值分别为10.83、52.95、10.57,P值均<0.05),因0.32、0.64 mmol/L H2O2处理后的细胞生存率太低,故后续实验选取0.16 mmol/L作为H2O2处理AR42J细胞的适宜浓度。
二、H2O2及OM对AR42J细胞HMGB1蛋白表达的影响
对照组、H2O2组、H2O2+OM组细胞培养24 h后,AR42J细胞HMGB1蛋白相对表达量分别为0.69±0.02、1.04±0.04、0.82±0.02(图2),H2O2组显著高于对照组,H2O2+OM组显著低于H2O2组,但仍高于对照组,差异均有统计学意义(t值分别为8.59、4.92、4.50,P值均<0.05)。
三、H2O2及OM对AR42J细胞HMGB1蛋白分泌量的影响
对照组、H2O2组、H2O2+OM组细胞培养上清液中HMGB1蛋白水平分别为(2.68±0.07)、(4.84±0.13)、(3.97±0.10)μg/L,H2O2组显著高于对照组,H2O2+OM组显著低于H2O2组,但仍高于对照组,差异均有统计学意义(t值分别为20.37、7.57、14.92,P值均<0.05)。

注:H2O2为过氧化氢
图1不同浓度H2O2对AR42J细胞生存率的影响
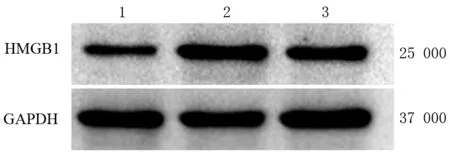
注:H2O2为过氧化氢;OM为氧化苦参碱;HMGB1为高迁移率族蛋白B1
图2对照组(1)、H2O2组(2)和H2O2+OM组(3)AR42J细胞HMGB1蛋白表达
四、H2O2及OM对AR42J细胞HMGB1蛋白胞内定位的影响
对照组、H2O2组、H2O2+OM组AR42J细胞胞质内HMGB1蛋白占细胞HMGB1蛋白总量的比例分别为(10.7±1.9)%、(35.7±2.5)%、(27.3±1.7)%(图3),H2O2组AR42J细胞胞质中HMGB1蛋白占比显著高于对照组,而H2O2+OM组AR42J细胞胞质中HMGB1蛋白占比显著低于H2O2组,但仍高于对照组,差异均有统计学意义(t值分别为11.31、3.90、9.29,P值均<0.05)。提示AR42J细胞HMGB1蛋白定位于胞核,H2O2处理后AR42J细胞内HMGB1蛋白由胞核向胞质移位,预先用OM干预能抑制HMGB1蛋白从胞核向胞质转移。
讨 论
胰腺炎早期以无菌性损伤为特征,胰腺腺泡细胞损伤甚至坏死,细胞内容物从受损或死亡的细胞中释放到细胞外,其作为损伤相关分子谱(damage associated molecular patterns, DAMPs),在AP的致病过程中起着核心作用[13-15]。DAMPs主要包括HMGB1、热休克蛋白(heat shock proteins, HSPs)、DNA、ATP等,它们具有类细胞因子、趋化因子或生长因子的活性,通过血液循环运输到全身各处,从而将局部组织损伤与全身炎症反应综合征(SIRS)联系起来,导致随后发生的多器官功能衰竭(MOF),甚至死亡[14,16]。HMGB1作为一种最典型和广泛研究的DAMPs,在AP的发展过程中起着非常重要的作用,它既可由应激细胞主动分泌,也可由死亡细胞被动释放,作为一种警报信号反映细胞的应激状态[17-18]。细胞实验表明,HMGB1能够通过TLR4或RAGE受体激活巨噬细胞、单核细胞、树突状细胞和T细胞等,释放TNF-α、IL-1β、IL-6等炎症因子,进而扩大和加重炎症反应[17-20]。动物实验表明,急性坏死性胰腺炎小鼠血清HMGB1水平明显高于正常小鼠[21]。临床研究表明,AP患者的血清HMGB1水平升高,且与疾病的严重程度呈正相关[22-23];而抑制HMGB1的表达和释放以及阻断TLR4或RAGE受体均能有效缓解胰腺炎症[18,20,24-27]。
ROS是细胞代谢过程中关键信号分子,调控包括蛋白酪氨酸磷酸酶(protein tyrosine phosphatases, PTPs)、酪氨酸激酶(protein tyrosine kinases, PTKs)、蛋白激酶C(protein kinase C, PKC)、MAPKs和NF-κB等多种信号分子,在细胞生存和死亡过程中发挥着关键作用[28]。H2O2作为活性氧中的一种,低浓度时能够引起细胞抗氧化防御系统激活,而高浓度则引起细胞氧化应激损伤甚至坏死[5]。本实验根据MTT结果,采用0.16 mmol/L H2O2诱导AR42J细胞氧化应激,结果显示H2O2组细胞内HMGB1蛋白表达和分泌到细胞上清液中的HMGB1均显著增多,表明H2O2能够诱导AR42J 细胞HMGB1表达和释放。H2O2处理AR42J细胞后发生了HMGB1由胞核向胞质再向胞外转移,提示HMGB1可能在胰腺炎的发病机制中起重要作用。应用OM干预后,HMGB1的表达和释放均较H2O2组显著下降,HMGB1蛋白由胞核向胞质的移位显著减弱,提示OM可能通过稳定核膜与胞膜进而减轻氧化应激所造成的细胞损伤。

注:H2O2为过氧化氢;OM为氧化苦参碱;HMGB1为高迁移率族蛋白B1;DAPI为4′,6-二脒基-2-苯基吲哚
图3H2O2及OM对AR42J细胞内HMGB1蛋白移位的影响 3A~3C:对照组;3D~3F:H2O2组;3G~3I:H2O2+OM组;3A、3D、3G为蛋白定位(免疫荧光,×400);3B、3E、3H为DAPI染色;3C、3F、3I为叠加
综上分析,鉴于细胞损伤和死亡所释放的DAMPs在AP致病过程中的重要驱动作用,提示HMGB1可能是治疗胰腺炎的重要靶点,而OM可能是改善胰腺炎症的有效药物。HMGB1结构和功能复杂,探讨HMGB1的作用机制能够更好地理解局部组织损伤与SIRS之间的关系,以便选择更有针对性的治疗方案,为胰腺炎的治疗提供新的策略。
利益冲突所有作者均声明不存在利益冲突
