胰腺神经鞘瘤三例的影像学特征并文献复习
2020-03-02钟婧娇詹茜张雪凤曹姝慧弓静
钟婧娇 詹茜 张雪凤 曹姝慧 弓静
海军军医大学附属长海医院影像医学科,上海 200433
神经鞘瘤又名雪旺细胞瘤(schwannoma),由来源于神经外胚层的雪旺细胞和中胚层的神经内膜增生形成,可发生于全身任何含有上述雪旺细胞和神经内膜的部位。神经鞘瘤生长部位以中枢神经系统为主,其次为颈部及四肢的大神经,消化系统少见,发生在胰腺的神经鞘瘤则更为罕见。胰腺神经鞘瘤源自胰腺迷走神经分支的交感神经纤维和副交感神经纤维[1-3]。目前关于胰腺神经鞘瘤的文献报道多集中于神经鞘瘤的病理诊断及肿瘤大小与良恶性的相关性[4-5],本研究着重分析3例胰腺神经鞘瘤的影像学资料,并结合文献复习,探讨其影像学特征,以提高对该病的认识,为临床诊断和治疗提供更多影像学依据。
资料与方法
一、临床资料
回顾性分析1989年1月至2019年1月间海军军医大学附属长海医院经手术病理证实的3例胰腺神经鞘瘤患者的临床(年龄、性别、症状)、病理(肿瘤组织大小、病理表现、免疫组织化学染色)及影像学(CT及MRI)资料。
二、检查方法
1.CT检查:采用东芝640层容积CT扫描仪进行平扫加增强扫描。检查前患者禁食8 h,扫描前20~30 min口服清水500 ml。取仰卧位,扫描范围从膈顶至盆腔。增强扫描采用CT专用高压注射器团注对比剂(非离子、双体型碘剂),注射速率为3.0 ml/s,分别于注射后20~25、60~70、110~130 s扫描获取动脉期、胰腺期和平衡期图像。重建层厚为0.25 mm。
2.MRI检查:采用Siemens 1.5T-MRI扫描仪进行平扫加增强扫描。检查前患者禁食8 h,扫描前20~30 min口服清水500 ml。取仰卧位,扫描范围从膈顶至盆腔。增强扫描采用MRI专用高压注射器团注对比剂(非离子、双体型碘剂),注射速率为3.0 ml/s,注射开始后20~25 s、60~70 s、110~130 s扫描获取动脉期、胰腺期和平衡期图像。重建层厚为0.25 mm。
三、文献检索
以“胰腺神经鞘瘤”或“胰腺”和“神经鞘瘤”为关键词检索重庆维普科技期刊数据库(Web版7.0)的中文文献,以“pancreatic schwannoma”或“pancreatic”和“schwannoma”为关键词检索PubMed及Springer Link数据库的英文文献,搜索时间范围从1989年1月至2019年1月。纳入的文献均为经穿刺或手术病理确诊的胰腺神经鞘瘤。排除标准:(1)确诊为胰腺神经鞘瘤,但无法获得全文信息,不能进行数据统计者;(2)重复报道的病例。
结 果
一、3例患者的临床、病理及影像学资料
病例1 患者女性,50岁。因“体检发现胰腺占位8 d”入院。患者无腹痛、腹胀,不伴发热、黄疸、恶心、呕吐、腹泻、黑便等症状,无家族性遗传病史。体格检查未见明显异常。实验室检查示血、尿常规及淀粉酶均在正常范围,AFP、CA150、CA19-9、CA242、CA724、CEA等肿瘤标志物均未见异常。手术切除胰腺组织1块,大小6 cm×4 cm×4 cm,切面呈多房囊性,壁厚0.2~0.3 cm,囊内含有淡黄色清亮液体及胶冻样物,与周围组织界限清楚;镜下见肿瘤细胞由梭形细胞束组成,实性区细胞密集,呈栅栏状排列,囊性出血区域细胞排列稀疏;组织切片免疫组织化学染色示S-100+,VIM+,ABC+,β-Tub+,SOX-10+,SMA-,NGFR少量+。
CT平扫+增强示胰尾部大小5.9 cm×4.2 cm囊状低密度灶,边界清晰,内见粗细不均分隔样成分,增强后分隔样成分强化。MRI平扫+增强示胰尾部肿块,T1WI低信号,T2WI高信号,内见粗细不均分隔样成分,增强后分隔样成分轻度强化(图1)。 靶征分析:肿瘤组织在T1WI呈完全低信号;T2WI呈部分低信号,部分高信号;肿瘤组织T1增强后可见与T2WI区域完全相反的信号特征,即T2WI低信号部分在T1增强后呈高信号(逐渐强化),与病理上Antoni A区分布相一致,而T2WI高信号部分在T1增强后呈低信号(未见强化),与病理上Antoni B区分布相一致。

图1病例1的CT及MRI图像 1A:CT平扫见胰尾部囊状低密度灶,内见分隔样成分;1B:MRI平扫见胰尾部肿块T1WI低信号,内部多发分隔样成分T1WI等信号;1C:MRI平扫见胰腺肿块T2WI部分低信号,部分高信号,分隔样成分T2WI低信号;1D:增强后分隔样成分轻度强化
病例2 患者男性,45岁。因“上腹胀3月”入院。无腹痛、腹泻、发热、黄疸、恶心、呕吐、黑便等消化道症状,无家族性遗传病史。体格检查未见明显异常。实验室检查示血、尿常规及淀粉酶均在正常范围,AFP、CA150、CA19-9、CA242、CA724、CEA等肿瘤标志物均未见异常。手术切除胰腺组织1块,大小4.5 cm×3 cm×2.5 cm,切面呈灰白、灰黄色,囊实性,与周围组织界限尚清;镜下见实性区梭形细胞增殖交错呈栅栏状,水肿变性区伴有出血、含铁血黄素沉积,扩张的微血管壁玻璃样变性;组织切片免疫组织化学染色示S-100+,VIM+,ABC+,β-Tub+,SOX-10+,CALP-,SMA-,NGFR-,CD34-,C-Kit-,Dog-1-,Ki-67-。
胰腺动脉CT平扫+增强示胰头部一囊实性肿块,大小3.2 cm×3.2 cm,边界清,实性部分轻度强化,周围血管呈推压改变。MRI平扫+增强示胰头钩突部囊实性肿块,T1WI等低信号,T2WI呈不均匀高信号,增强后可见实性区域轻度强化(图2)。靶征分析:肿瘤组织T1增强后可见与T2WI区域完全相反的信号特征,即T2WI低信号部分在T1增强后呈高信号(逐渐强化),与病理上Antoni A区分布相一致;而T2WI高信号部分在T1增强后呈低信号(未见强化),与病理上Antoni B区分布相一致。

图2病例2的CT及MRI图像 2A~2C:胰腺动脉CT增强造影示胰头一囊实性肿块,边界尚清,实性部分轻度强化,周围血管呈推压改变;2D~2F:MRI平扫+增强示胰头钩突部一囊实性肿块,T1WI等低信号,T2WI呈不均匀高信号,增强后可见实性区轻度强化
病例3 患者女性,54岁。因“结肠癌切除术中发现胰颈部占位1月余”入院。无消化道症状,无家族性遗传病史。体格检查未见明显异常。实验室检查示血、尿常规及淀粉酶均在正常范围,AFP、CA150、CA19-9、CA242、CA724、CEA等肿瘤标志物均未见异常。手术切除胰腺结节状肿物1枚,大小3 cm×2.5 cm×1.5 cm,切面呈灰白、灰黄色,实性,质软,表面包膜完整;镜下见实性区呈致密的细胞结构和网状纤维,形成Verocay小体,囊变区细胞稀疏排列,可见红细胞;组织切片免疫组织化学染色示S-100+,VIM+,ABC+,SMA-,CD34-,C-Kit-。
MRI平扫+增强示胰颈部一异常信号灶,约1.7 cm×2.0 cm,T1WI等低信号,T2WI混杂高信号,增强后可见肿块内部呈渐进性轻度强化,低于胰腺实质的强化(图3)。靶征分析:肿瘤组织T1增强后可见与T2WI区域完全相反的信号特征,即T2WI低信号部分在T1增强后呈高信号(逐渐强化),与病理上Antoni A区分布相一致,而T2WI高信号部分在T1增强后呈低信号(未见强化),与病理上Antoni B区分布一致。
二、病例资料汇总分析
英文检索到符合纳入标准的文献共61篇、65例[1,3,5-63],中文检索到符合纳入标准的文献共15篇、16例[64-77],加上长海医院3例,合计84例。84例胰腺神经鞘瘤患者资料汇总见表1。其中文献报道15例行内镜超声下细针穿刺术(EUS-FNA),8例穿刺结果与手术后病理结果一致;3例患者穿刺标本检查结果为胰腺神经鞘瘤,但未行手术;4例穿刺结果与手术后病理结果不一致(1994年1例,2016年1例,2017年2例),其诊断准确率为73.3%(11/15)。
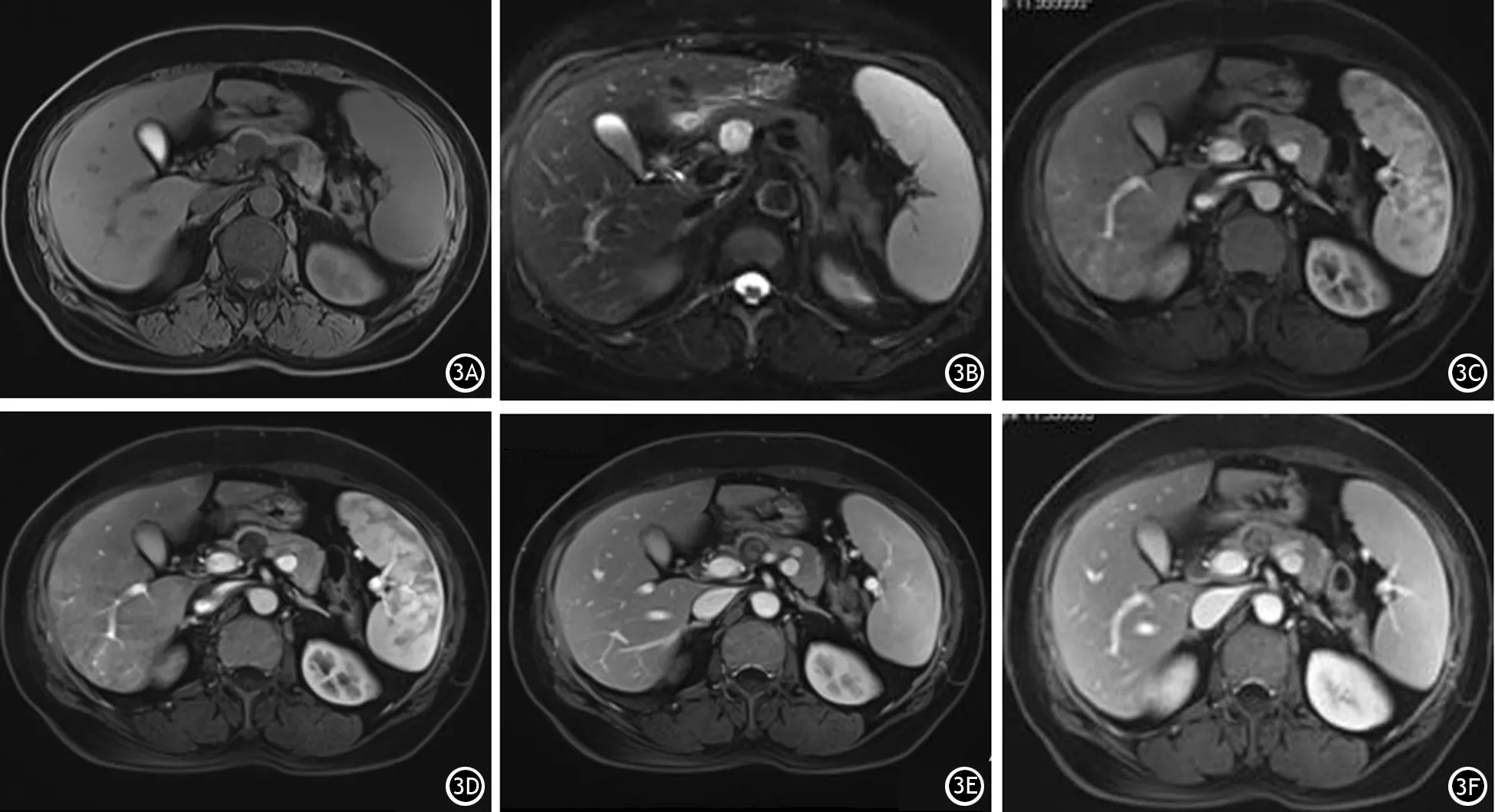
图3病例3的CT及MRI图像 3A、3B:MRI平扫示胰颈部一异常信号灶,T1WI等低信号,T2WI混杂高信号;3C~3F:MRI增强后可见肿瘤呈渐进性强化

表1 84例胰腺神经鞘瘤患者的临床、病理及影像学检查资料
讨 论
胰腺神经鞘瘤病例极为罕见[1,78-83]。近30年中外文献中,仅有81例关于胰腺神经鞘瘤的相关报道,加长海医院3例,共84例。胰腺神经鞘瘤女性占多,年龄17~78岁。肿瘤常位于胰头部,多发生退行性改变,包括囊肿形成、钙化、出血、透明质化和黄色瘤样浸润[15]。最常见症状是腹部隐痛或无症状,若临床检查有上腹部压痛,常提示囊肿较大。
肿瘤大体呈圆形、椭圆形或梭形,与胰腺周围组织界限清楚,常可见半透明的神经外膜和纤维组成的包膜。肿瘤可呈实性、囊性、囊实性,但以囊性变多见,伴发水肿变性,出血时切面可呈灰色、灰黄色[1,10,15]。镜下见肿瘤分为两种组织结构,Antoni A区及Antoni B区[1,5]。Antoni A区又称细胞密集区,为致密的细胞结构和网状纤维,可见细长、梭形、境界不清、核长圆形的细胞,互相紧密平行排列呈栅栏状或不完全的旋涡状,称Verocay小体,此区含有微小血管,增强后可见渐进性明显强化。Antoni B区又称细胞疏松区,为疏松的黏液样结构,细胞呈多形性。此区缺乏血管,极易发生中心性坏死、出血及钙化等表现,增强后不强化。Antoni A区和B区在肿瘤组织中可共存并相互移行,但部分肿瘤中也可出现以某一种结构为主的情况。切片免疫组织化学染色可见S-100蛋白、弹性蛋白、CD56呈强阳性,而细胞角蛋白AE1和AE3、平滑肌肌球蛋白、Desmin蛋白、CD34、CD117等指标均为阴性[20]。
目前诊断胰腺神经鞘瘤主要依靠病理免疫组织化学检查,实验室检查对肿瘤诊断没有帮助。术前影像诊断对胰腺神经鞘瘤具有挑战性,通常接受腹部超声、CT、MRI等一种或多种检查。
腹部超声检查示肿瘤为低回声团,内见囊性成分,或者直接显示囊性团块。超声引导下的细针穿刺(FNA)检查有助于术前准确诊断,但假阴性率较高。此外,细针穿刺容易导致肿瘤细胞播散、种植,因此对其应用存在争议[25,84]。Yu等[85]研究了8个经组织学确诊的胰腺神经鞘瘤的FNA穿刺结果,仅有1例诊断正确,主要原因可能为:(1)FNA穿刺较难获得足够有代表性的样本;(2)即使获得样本,但在当时的医疗水平下,组织学诊断困难。随着技术的革新及免疫组织化学技术的发展,准确的定位穿刺及免疫分析水平都明显提高,相信FNA的诊断正确率一定会提高。
CT检查可清晰显示肿瘤大小、形态及与胰腺周围组织的关系。由于胰腺神经鞘瘤特殊的病理结构,Antoni A区与B区相互移行交织,导致肿瘤内部密度不均匀(Antoni A区密度大,Antoni B区密度小),CT图像可见密度不均匀的肿瘤团块,增强后部分区域呈渐进性强化,部分区域不强化[24]。目前通过CT检查只能了解肿瘤的密度及大小,对胰腺神经鞘瘤的影像诊断及鉴别诊断并无太大帮助。
MRI表现为T1WI低信号,T2WI高信号,增强后多数肿瘤T1WI逐渐增强[14,29]。Novellas等[22]分析了胰腺神经鞘瘤患者的MRI平扫及增强的特征,提出MRI检查对胰腺神经鞘瘤的辅助诊断具有重要意义。Koga等[86]回顾分析比较了196例患者共223个神经鞘瘤肿瘤的病理表现与超声、CT、MRI 3种检查的对应关系,提出了“靶征”的定义(MRI上的双相或三相征象,即其征象与宏观和微观表现相关),总结出神经鞘瘤的MRI靶征:(1)肿瘤组织在T1WI呈完全低信号;T2WI呈部分低信号,部分高信号。(2)T1增强后可见与T2WI区域完全相反的信号特征,即T2WI低信号部分逐渐强化,呈高信号,而高信号部分未见强化,呈低信号。MRI的这种特征表现完全与神经鞘瘤的病理解剖特征一致:T2WI低信号,增强后逐渐强化部位为病理检查的Antoni A区;T2WI高信号,增强后未见强化部位为病理的Antoni B区。这种MRI靶征诊断胰腺神经鞘瘤的灵敏度为59%,特异度为100%。本研究统计的84例病例中仅35例患者接受了MRI平扫及增强检查,MRI资料完整病例共12例,采用MRI靶征分析上述病例,结果所有患者MRI影像均出现靶征特点。
2/3的胰腺神经鞘瘤发生出血、坏死、钙化等变性,形成囊肿,使胰腺神经鞘瘤与其他胰腺囊性病变类似,因此,胰腺神经鞘瘤需要与胰腺囊性病变进行鉴别。总之,胰腺神经鞘瘤病例罕见,术前诊断困难,提高对该病的影像学特征的认识,将有助于提高该病的术前诊断率及指导临床进行精准治疗。
利益冲突所有作者均声明不存在利益冲突
