一株马铃薯干腐病拮抗菌芽孢杆菌的筛选、鉴定及生防因子初探
2020-03-02贾鹏莉胡英杰
贾鹏莉,沈 硕,胡英杰
(青海大学/青海省农林科学院/青海省马铃薯育种重点实验室/青藏高原生物技术教育部重点实验室,青海 西宁 810016)
0 引言
【研究意义】马铃薯是全球第四大重要的粮食作物,在贮藏过程中,马铃薯容易被多种病害所侵袭[1]。其中,马铃薯干腐病是马铃薯贮藏期主要的真菌性病害之一,由多种镰刀菌(Fusarium spp.)引起[2]。据统计,每年由马铃薯干腐病造成的马铃薯贮藏期产量损失一般为6%~25%,最高可达60%[3−5]。生产中对这种病害的防治以化学防治手段为主,常用的药剂有苯醚甲环唑·嘧菌酯、霜脲·锰锌、戊唑醇等,但长期使用化学药剂防治,造成菌株抗药性、环境污染和农药残留等严重问题[6−8]。生物防治具有安全无毒、不污染环境和不易产生抗药性等优点[9−10]。因此,利用微生物等天然资源及其产生的天然产物对马铃薯干腐病进行生物防治具有重要的意义。【前人研究进展】已报道的可对马铃薯干腐病进行生物防治的生防菌有芽孢杆菌(Bacillus spp.)[11−12]、放线菌(Actinomyces spp.)[13−14]和木霉菌(Trichoderma spp.)[15]等生防菌株,以及寡雄蛋白(Oligandrin)[16]和蓝桉精油[17]等活性物质。白酒糟醅是以谷物为原材料经发酵、蒸馏、提取酒精等加工过程后所残余的废渣物料。近年来,白酒糟醅多应用于食品[18]、饲料[19]及抗癌[20]等方面的研究。已有研究显示,青稞白酒糟醅在抑草、抑菌和抗病毒等方面具有生物活性[21−22]。【本研究切入点】目前,有关生防细菌抑制植物病原真菌的报道越来越多,但有关生防细菌抑制马铃薯干腐病病原菌活性方面的报道还很少,本课题组前期发现1株分离自青稞白酒糟醅的菌株JZ2-1-12对马铃薯干腐病病原菌具有抑制活性[23]。【拟解决的关键问题】在前期研究的基础上,对9株分离自青稞白酒糟醅的菌株进行抑菌活性筛选,采用形态学、生理生化特征及分子生物学方法对活性菌株进行鉴定,并研究活性菌株发酵液分泌抑菌物质的能力及其萃取物的抑菌活性和稳定性,以期为微生物来源的马铃薯干腐病生防菌剂及保鲜制剂的开发提供新的理论依据和技术支持。
1 材料与方法
1.1 供试材料
1.1.1 菌 株 供 试 菌 株JZ3-4-7、JZ2-1-6、JZ3-1-4、JZ3-1-10、JZ3-2-2、JZ3-1-23、JZ3-5-1、JZ3-1-14和JZ3-1-15分离自青稞白酒糟醅。马铃薯干腐病病原真菌青9B-4-6(Fusarium solani)、青9D-2-6(Fusarium oxysporum)、 65C-4-3(Fusarium sambucinum var.intermedium)和 65D-5-2(Fusarium acuminatum)分离自马铃薯薯块病样,均纯化并保存至青海省农林科学院生物技术研究所微生物实验室4 ℃冰箱。
1.1.2 培养基 牛肉膏蛋白胨培养基[24],PDA培养基[25],淀粉培养基[26],酪蛋白培养基[26],葡聚糖酶培养基[27],羧甲基纤维素培养基[28]。
1.1.3 主要仪器 电子天平(梅特勒-托利多仪器有限公司)、高压蒸汽灭菌锅(华粤企业集团有限公司)、电热恒温干燥箱(上海齐欣科学仪器有限公司)、生化培养箱(上海一恒科学仪器有限公司)、全温摇瓶柜(常州金坛精达仪器制造有限公司)。
1.2 菌株活化
将分离自青稞白酒糟醅的菌株从4 ℃冰箱取出,划线接种于牛肉膏蛋白胨培养基平板上,接种完毕的平板放于37 ℃恒温培养箱中倒置培养48 h,备用。
1.3 活性菌株的筛选及稳定性评价
采用平板对峙法[12],测定9株分离自青稞白酒糟醅的菌株对4株马铃薯干腐病病原真菌的抑菌活性。计算公式如下:
抑菌率= [(对照菌落直径−处理菌落直径)/对照菌落直径]×100%
为了确定活性菌株的稳定性,将初筛得到的有抑菌活性的菌株进行稳定性评价,方法同上。分别将供试拮抗菌和病原真菌对峙培养7 d和14 d后,测量抑菌带宽度,计算14 d时抑菌带宽度缩小率(VF),比较各活性菌株的抑制稳定性。稳定评价标准[29]:“--”:VF≥70%,不稳定;“−”:50%≤VF<70%,较不稳定;“+”:20%≤VF<50%,较稳定;“++”:VF<20%,稳定。计算公式如下:
VF=[(7 d抑菌带宽度值−14 d抑菌带宽度值)/7 d抑菌宽带值]×100%
1.4 活性菌株的鉴定
1.4.1 活性菌株的形态学鉴定 将活化后的活性菌株接种于NA培养基上,观察其生长的菌落形态特征,包括形状、光泽、隆起形状、透明度、边缘等,以及菌体形态特征(包括革兰氏染色、芽孢形态),根据《伯杰氏细菌鉴定手册》[30]和《常见细菌系统鉴定手册》[31]对菌株进行形态学鉴定。
1.4.2 活性菌株的生理生化特征 根据《伯杰氏细菌鉴定手册》[30]和《常见细菌系统鉴定手册》[31]对活性菌株进行葡萄糖氧化发酵,柠檬酸盐利用试验,接触酶,糖、醇类发酵,石蕊牛奶测试,明胶液化,甲基红(M.R),硝酸盐还原,V-P测定,O-硝基苯-β-D吡喃半乳糖苷酶(ONPG)测定等试验。
1.4.3 活 性 菌 株 的 分 子 生 物 学 鉴 定 活 性 菌 株DNA提取根据上海生工生物工程(上海)股份有限公司的柱式细菌DNA提取试剂盒的程序操作。选择通用的细菌16S rDNA引物F27(5′-AGAGTTTGAT CCTGGCTCA GG-3′)和P1541(5′-AAGGAGGTG GTGATCCAGCCG CA-3′)。PCR扩增体系为:10×Buffer 2.5 μL,dNTP(10 mmol·L-1)2 μL,模板DNA 1 μL,引 物 各1 μL,Taq DNA聚 合 酶0.2 μL,水补足至25 μL。PCR反应条件如下:94 ℃ 5 min;变性94 ℃ 40 s,退火55 ℃ 45 s,延伸72 ℃ 80 s,35个循环;72 ℃ 10 min。反应结束后,取5 μL PCR产物进行琼脂糖凝胶电泳检测,回收产物送至上海生工生物工程公司测序。将得到的16S r DNA序列在网站https://www.ezbio cloud.net/上进行序列对比,用MEGA 7.0软件,采用Neighbor-Joining方法(Bootstrap值为1 000次),绘制系统发育进化树[32]。
1.5 活性菌株发酵液的制备及菌株生防因子分析
将筛选到的活性菌株接种到装瓶量为400 mL的牛肉膏蛋白胨液体培养基中,置于37 ℃、180 r·min−1恒温摇瓶柜中振荡培养5~7 d,收获发酵液,然后将其经布氏漏斗减压过滤去除菌体,得到去菌体发酵液,备用。
采用平板透明圈法[33],分别在淀粉培养基、酪蛋白培养基、葡聚糖酶培养基、羧甲基纤维素培养基上打3孔(直径6 mm),每孔加活性菌株发酵液100 μL,3次重复。以只加NA液体培养基为对照组。30 ℃培养48~72 h,向淀粉酶培养基中加入2 mL的碘液,将碘液均匀覆盖平板,静置10 min,观察平板上出现透明圈情况。同时观察酪蛋白酶培养基、葡聚糖酶培养基和羧甲基纤维素培养基出现透明圈的情况。
采用排油圈法[34],取适量橄榄油加入苏丹Ⅲ染色剂混匀,向培养皿(直径9 cm)中加入60 mL纯水及缓慢加入染色的橄榄油,水面形成一层油膜,向培养皿油膜中心持续滴加活性菌株发酵液,观察是否形成排油圈。以只滴加NA液体培养基为对照组。检测活性菌株发酵液是否有脂肽类物质生成。
1.6 活性菌株发酵液萃取物的制备及其抑菌活性测定
取去菌体发酵液600 mL置于3 000 mL的分液漏斗中,依次用等体积的氯仿、乙酸乙酯和正丁醇对发酵液依次进行等体积萃取,萃取液经旋转蒸发得萃取物;将萃取物预溶于二甲基亚砜(≤0.1%),并用无菌水分别配成质量浓度为1.25、2.50、5.00、10.00和20.00 mg·mL−1的萃取物溶液,经0.22 μm微孔滤膜抽滤3次,以等体积的二甲亚砜(≤0.1%)溶液作为空白对照,重复3次。采用牛津杯法[35],测定发酵液有机溶剂萃取物的抑菌活性。计算公式如下:
抑制率=[(对照菌落直径-处理菌落直径)/对照菌落直径] × 100%
根据张志祥等[36]的方法,用毒力回归方程求得活性菌株萃取物对马铃薯干腐病病原真菌的抑菌中浓度(EC50)。
1.7 菌株发酵液提取物的稳定性测定
选取20 mg·mL−1的正丁醇萃取物溶液作为研究对象,以马铃薯干腐病病原菌青9D-2-6作为指示菌,采用牛津杯法分别检测正丁醇萃取物溶液对病原菌青9D-2-6抑菌活性的稳定性[37],重复3次。
1.7.1 热稳定性 将质量浓度为20 mg·mL−1的正丁醇萃取物溶液分别进行40 、60、80、100 ℃水浴处理及121 ℃高压蒸汽灭菌锅处理60 min,以未加热处理的溶液作为对照。
1.7.2 酸碱稳定性 将质量浓度为20 mg·mL−1的正丁醇萃取物溶液分别用浓度为1 mol·L−1的盐酸和1 mol·L−1的氢氧化钠分别调节pH值为5、6、7、8、9,以未调节pH值的溶液作为对照。
1.7.3 紫外稳定性 将质量浓度为20 mg·mL−1的正丁醇萃取物溶液置于254 nm的紫外灯下20 cm处分别照射1、3、5、7、9 h,以未经紫外照射处理的溶液作为对照。
1.8 数据统计分析
采用IBM SPSS Statistics 24.0进行数据统计分析,结果均以平均值±标准差表示。采用Duncan氏新复极差法进行差异显著性(a=0.05)检验。
2 结果与分析
2.1 抑制马铃薯干腐病病原真菌活性菌株的筛选
采用平板对峙法,对9株分离自青稞白酒糟醅的菌株(JZ3-5-1、JZ3-1-15、JZ3-1-14、JZ3-1-10、JZ3-1-4、JZ2-1-6、JZ3-4-7、JZ3-2-2、JZ3-1-23)分别进行抑制马铃薯干腐病菌(青9D-2-6、65D-5-2、青9B-4-6、65C-4-3)活性测定。由表1可得,供试的9个菌株中,JZ3-5-1、JZ3-1-14、JZ3-1-10、JZ3-1-4、JZ2-1-6、JZ3-2-2和JZ3-1-23对病原真菌几乎无抑菌作用,JZ3-1-15和JZ3-4-7对病原真菌具有中等的抑菌作用,其中JZ3-1-15对病原真菌青9D-2-6的抑制率为57.24%,对青9B-4-6的抑制率为51.92%,对65C-4-3的抑制率为50.18%,对65D-5-2的抑制率为49.83%(表1)。由上述结果可知,供试菌株中,JZ3-1-15对病原真菌青9D-2-6的抑菌活性最高。
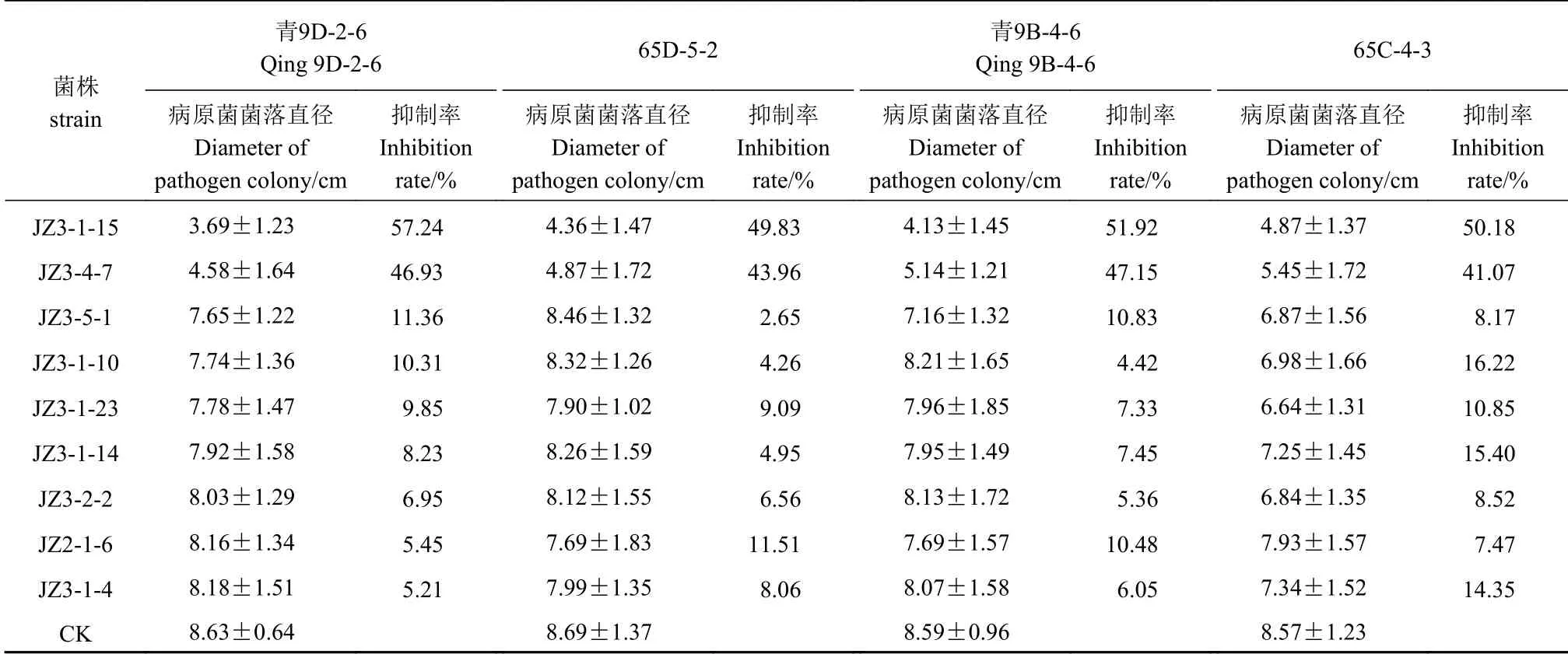
表 1 分离自青稞白酒糟醅的菌株抑制马铃薯干腐病病原真菌的活性Table 1 Inhibitory activity of strains from distiller's grain against pathogens of potato dry rot
2.2 活性菌株的稳定性评价
对菌株JZ3-1-15和JZ3-4-7进行抑菌活性的稳定性评价。由表2可知,JZ3-1-15对病原菌的抑菌带缩小率为0.78%,根据1.3评价标准,稳定性为“++”;JZ3-4-7对病原菌的抑制活性的抑菌带缩小率25.75%,根据1.3评价标准,稳定性为“+”;两者稳定性差异显著(P<0.05)。可见,菌株JZ3-1-15对病原菌的抑菌作用最稳定。
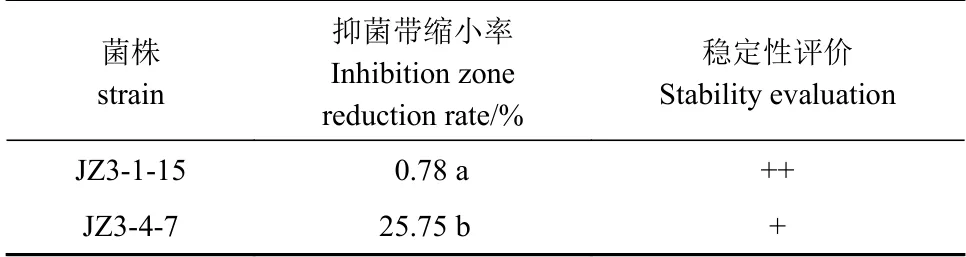
表 2 供试菌株对马铃薯干腐病病原真菌抑菌活性的稳定性Table 2 Stability of antimicrobial activity of strains from distiller's grains against pathogens of potato dry rot
2.3 活性菌株的鉴定
2.3.1 形态学鉴定 如图1所示,菌株JZ3-1-15在NA培养基上培养24 h后呈乳白色,单菌落形态呈圆形或椭圆形,边缘整齐,不透明,表面光滑、湿润,明显向上突起,黏液状;培养72 h后表面出现褶皱,边缘不规则,呈雾状散开;革兰氏染色后镜检呈蓝紫色、杆状,表明该菌株为阳性菌。
2.3.2 生理生化鉴定 由表3可知,菌株JZ3-1-15可使明胶液化,石蕊牛乳凝固,可利用蔗糖、甘露醇及麦芽糖,有氧或无氧分子均参与分解葡萄糖,可以产生ONPG,硝酸盐还原、接触酶试验均呈阳性。而不能利用柠檬酸,甲基红、V-P试验均呈阴性。
2.3.3 分子生物学鉴定 将菌株JZ3-1-15测序得到的16S rDNA序列提交至网址https://www.ezbiocloud.net/上与数据库中已知的16S rDNA序列进行比较,并下载与菌株JZ3-1-15的16S rDNA序列同源性大于95%的序列,使用Mega(7. 0)软件,根据Neighbor-Joining方法构建系统发育树(图2)。鉴定结果表明,菌株JZ3-1-15与菌株贝莱斯芽孢杆菌(Bacillus velezensis)聚类同一分支,亲缘关系最近,相似度高达99.78%。结合JZ3-1-15的形态特征、生理生化特征和16S rDNA序列分析结果,最终将JZ3-1-15鉴定为贝莱斯芽孢杆菌(Bacillus velezensis),Genbank登录号为MT682887。
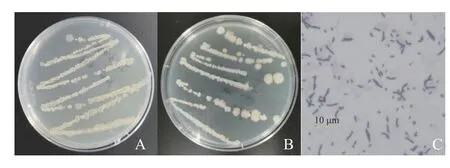
图 1 菌株JZ3-1-15的培养性状及革兰氏染色特征Fig. 1 Culture and gram-staining characteristics of JZ3-1-15
2.4 活性菌株生防因子分析
采用透明圈法,测定菌株JZ3-1-15发酵液的产酶能力。如图3所示,菌株JZ3-1-15发酵液在酪蛋白培养基(图3A)、淀粉培养基(图3B)和羧甲基纤维素培养基(图3C)上均有明显酶解圈产生,且在酪蛋白培养基和淀粉培养基上酶解圈边缘界限清晰,酪蛋白培养基上的酶解圈明显较大,羧甲基纤维素培养基上酶解圈边缘界限模糊,说明JZ3-1-15发酵液产蛋白酶较多,淀粉酶次之。如图3D所示,在葡聚糖培养基上未有透明圈产生,说明JZ3-1-15发酵液不具有产葡聚糖酶的能力。
采用排油圈法,测定JZ3-1-15发酵液是否具有产生表面活性功能的脂肽类物质的能力。如图3E所示,有明显的排油圈产生,说明菌株JZ3-1-15发酵液具有产脂肽类物质的能力。
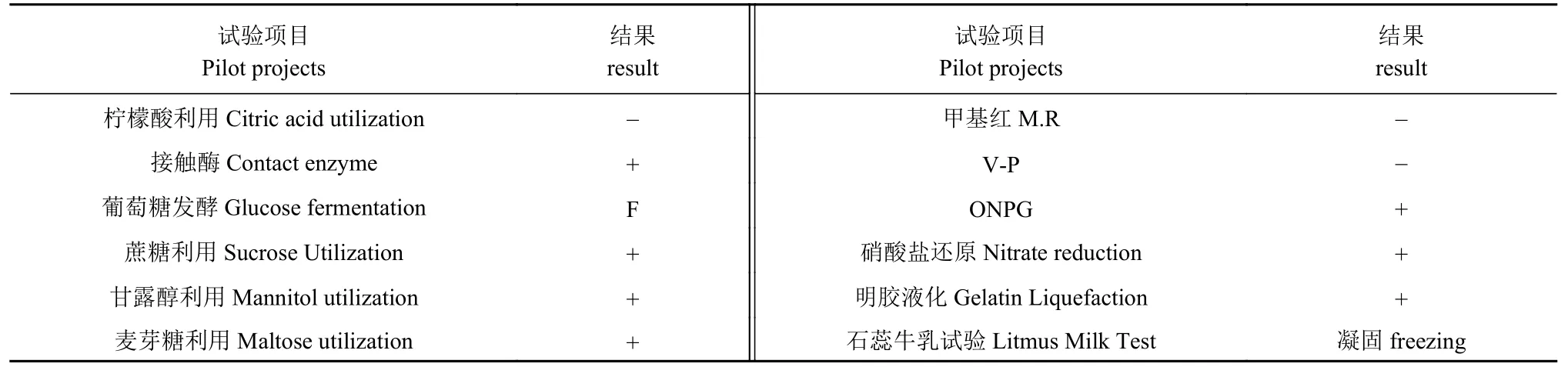
表 3 菌株JZ3-1-15的生理生化特征Table 3 Physiological and biochemical characteristics of JZ3-1-15
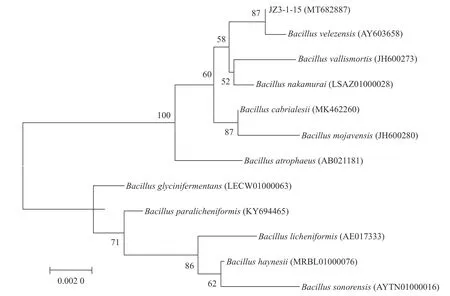
图 2 基于16S rDNA序列构建的菌株JZ3-1-15系统发育分析Fig. 2 Phylogenic analysis on JZ3-1-15 based on 16S rDNA sequence
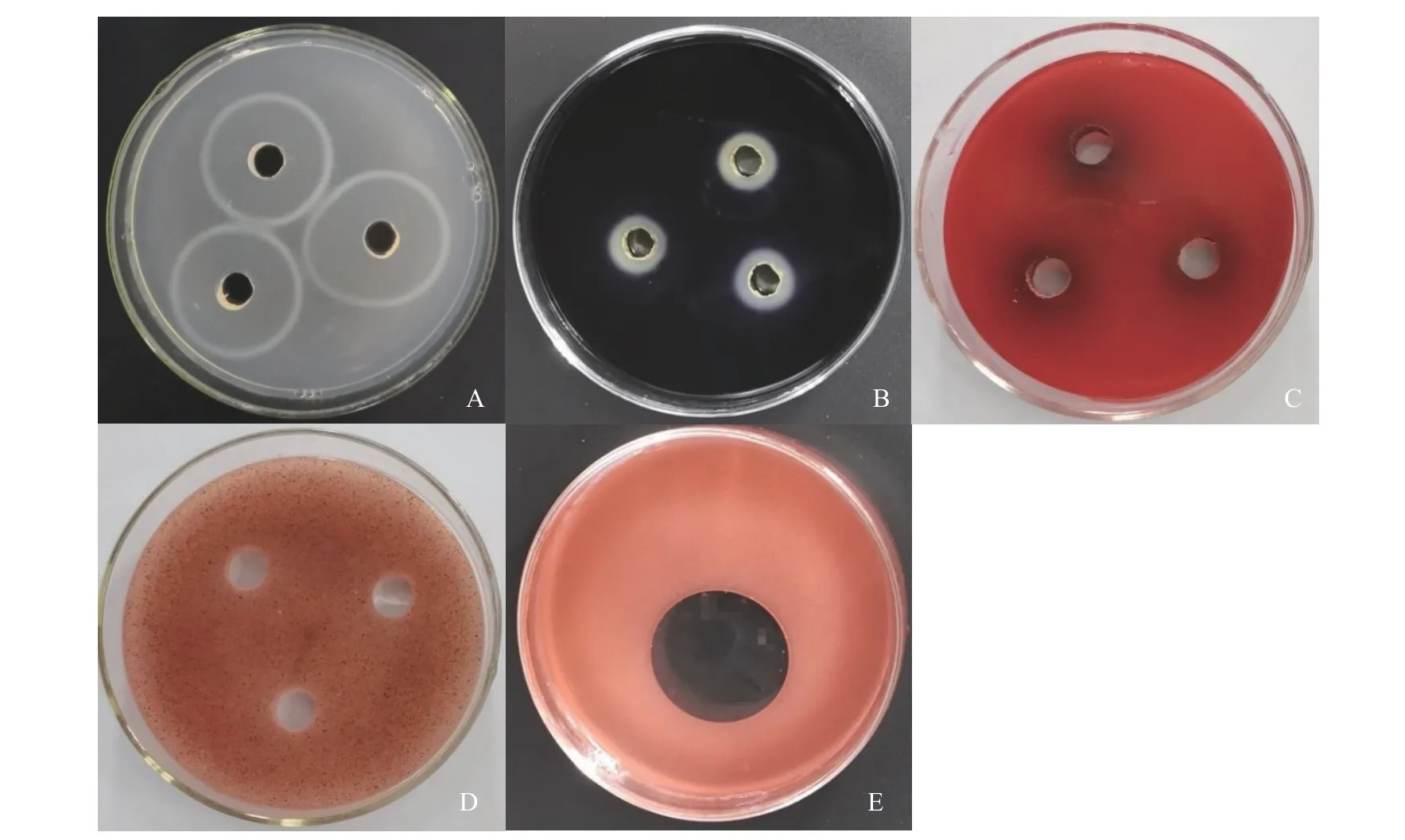
图 3 菌株JZ3-1-15发酵液生防因子分析Fig. 3 Biocontrol factors of JZ3-1-15 fermentation broth
2.5 活性菌株发酵液萃取物的抑菌活性
通过牛津杯法,测定活性菌株JZ3-1-15的发酵液萃取物对病原真菌青9D-2-6的抑菌活性及EC50。由表4可知,当乙酸乙酯、氯仿和正丁醇萃取溶液质量浓度为20 mg·mL−1时对病原真菌的抑菌活性最高,抑制率分别为62.67%、67.52%和80.07%。当氯仿和正丁醇萃取物溶液质量浓度为10 mg·mL−1时,对病原真菌仍具有较高的抑菌活性,抑制率分别为52.42%和61.41%。由显著性分析结果可知,当乙酸乙酯、氯仿和正丁醇萃取溶液质量浓度为20 mg·mL−1时 与1.25、2.5、5、10 mg·mL−1时 差 异 显 著(P<0.05)。由毒力回归方程可知:乙酸乙酯、氯仿和正丁醇萃取物溶液对病原真菌青9D-2-6抑制活性的EC50分别为14.06、8.88和5.18 mg·mL−1。可见,JZ3-1-15发酵液正丁醇萃取物溶液对病原真菌青9D-2-6的抑菌力更强。
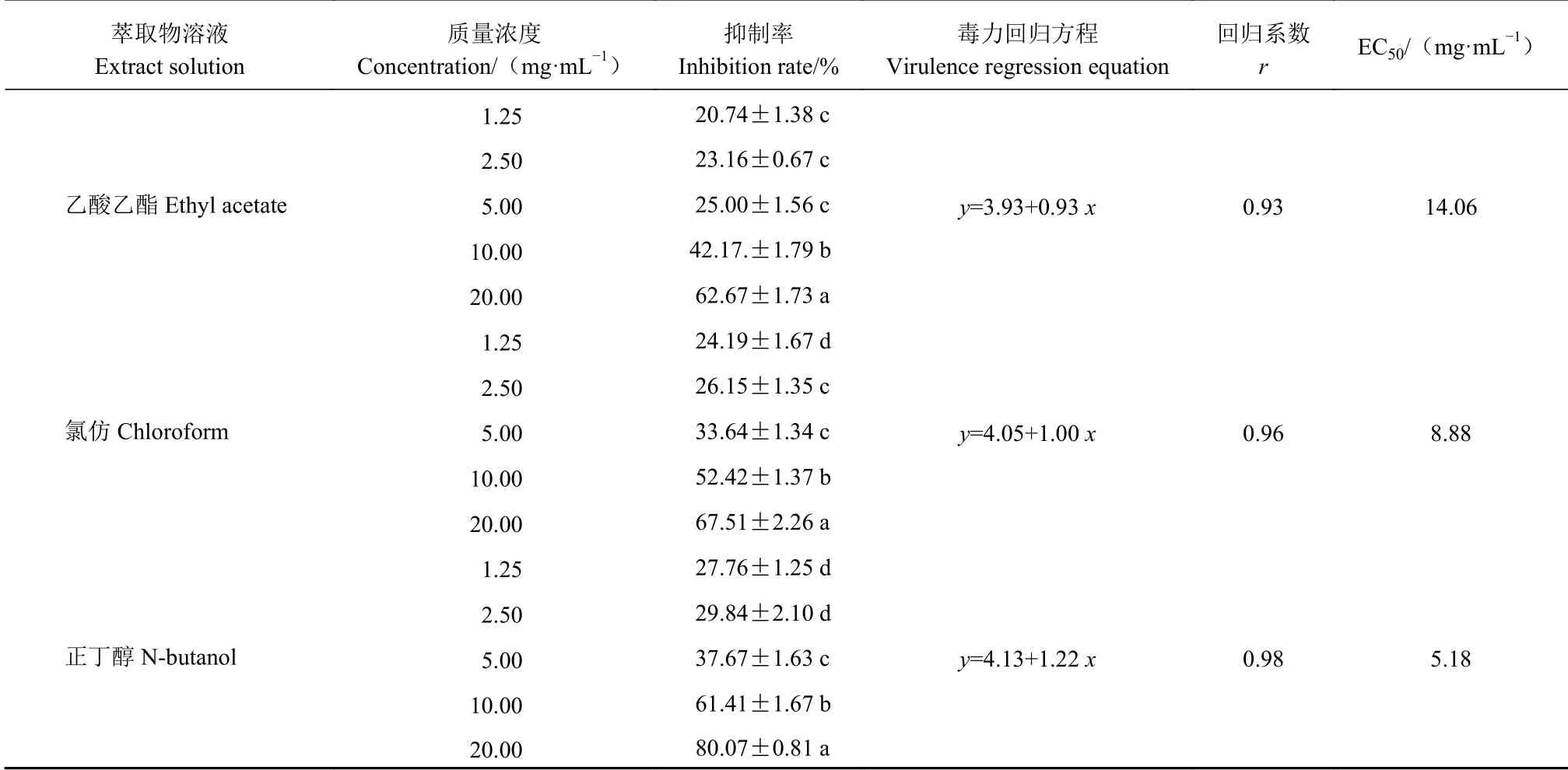
表 4 菌株JZ3-1-15发酵液萃取物对病原真菌青9D-2-6的抑菌活性Table 4 Inhibitory activity of crude extract from JZ3-1-15 fermentation broth against Qing 9D-2-6
2.6 活性菌株发酵液萃取物的稳定性
由图4可知,在试验设计浓度下,JZ3-1-15发酵液正丁醇萃取物对温度、pH值和紫外线稳定性均良好。在80 ℃高温下,正丁醇萃取物抑制率能达到70%以上;当温度上升至121 ℃时,抑制率仍达65%以上,说明菌株JZ3-1-15发酵液正丁醇萃取物中的抑菌物质耐高温;pH值对菌株JZ3-1-15发酵液正丁醇萃取物中的抑菌物质有较小影响,pH=4时抑制率为59.28%,pH=8时抑制率为63.24%,抑制率虽然有小幅下降,但仍在55%以上。说明强酸、强碱对菌株JZ3-1-15发酵液正丁醇萃取物中的抑菌物质有较小的影响;紫外线对菌株JZ3-1-15发酵液正丁醇萃取物中的抑菌物质几乎无影响,抑制率均接近80%,抑制率浮动小于5%。
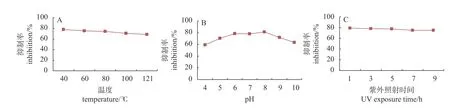
图 4 温度(A)、pH值(B)和紫外线(C)对JZ3-1-15发酵液萃取物的抑菌活性影响Fig. 4 Effects of temperature (A), pH (B), and uv (C) on antibacterial activity of crude JZ3-1-15 fermentation broth extract
3 结论与讨论
马铃薯干腐病是贮藏期病害最常见的真菌病害之一。目前,国外对马铃薯干腐病的生物防治已取得了较大进展[38],但国内对马铃薯干腐病进行生物防治的报道相对较少,甚至利用白酒糟醅对马铃薯干腐病进行生物防治的研究报道仍处于空白。本研究基于本课题组前期发现1株分离自青稞白酒糟醅的菌株JZ2-1-12对马铃薯干腐病病原菌具有抑菌活性,继续对分离自青稞白酒酒糟的9个株菌进行了马铃薯干腐病病原菌的拮抗筛选,发现菌株JZ3-1-15对4株马铃薯干腐病病原菌均具有较强、较稳定的抑菌活性,其发酵液正丁醇萃取物对马铃薯干腐病的抑菌活性最高,且发酵液正丁醇萃取物在不同温度、pH值和紫外线处理下均有较高的稳定性。这就表明JZ3-1-15能产生具有抑制马铃薯干腐病活性的次级代谢产物,且不易受外界环境影响,该菌株具备开发为马铃薯干腐病生防菌剂的潜力。
经形态学、生理生化特征及分子生物学方法对JZ3-1-15进行鉴定,确定JZ3-1-15为贝莱斯芽孢杆菌(Bacillus velezensis)。芽孢杆菌(Bacillus spp.)是人们发现最早的拮抗细菌之一,因其具有生长快、抑菌谱广、抗逆性强、对人畜安全、环境相容性好等优点而备受植物保护和环境保护专家的关注[39]。贝莱斯芽孢杆菌是近几年国内外分离得到的芽孢杆菌属的一个新种,该菌与枯草芽孢杆菌具有很高的亲缘性,大量菌株是作物生物防治的首选生物药剂[40]。据报道,贝莱斯芽孢杆菌对烟草黑胫病菌、水稻条斑病菌、西瓜枯萎病菌、番茄灰霉病菌、草莓炭疽病菌、小麦赤霉病菌等植物病原菌具有显著的抑菌作用[41−45];其氯仿萃取物可以促进玉米、豌豆和胡豆的根长和芽长生长,且获得的干物质可以延缓玉米叶片衰老,提高植株抗逆性,促进玉米生长[46]。另外,贝莱斯芽孢杆菌定殖于小麦根部,会导致171个蛋白和3 127个基因表达发生显著变化,且诱导SA转导途径中的PR1抗性基因表达,形成类似SAR的诱导系统抗性(ISR)[47]。本研究发现筛选出的菌株JZ3-1-15具有分泌淀粉酶、蛋白酶和纤维素酶的能力,这表明JZ3-1-15能产生具有抑制马铃薯干腐病活性的次级代谢产物,且产生的次级代谢产物可能为脂肽类物质,与刘安等[28]的研究结果一致。因此,对JZ3-1-15后续的研究重点可放在对该菌株次级代谢产物的分离、纯化及活性次级代谢产物抑菌机制的研究。该研究结果有望将青稞白酒酒糟开发成一种新型、高效、低毒的微生物资源,可以为植物病害的生物防治和农业可持续发展奠定坚实基础。
