炭疽菌侵染后刺葡萄果皮酵母双杂交cDNA文库构建
2020-03-02刘鑫铭陈清西
雷 龑,谢 倩,陈 婷,刘鑫铭,陈清西
(1. 福建农林大学园艺学院,福建 福州 350002;2. 福建省农业科学院果树研究所,福建 福州 350013)
0 引言
【研究意义】国际葡萄与葡萄酒组织(OIV,www.oiv.int)2018年的数据表明,我国是世界第二大葡萄种植国,同时也是世界第一大鲜食葡萄消费国和第五大葡萄酒消费国[1]。但葡萄在栽培生产过程中会受到各种真菌病害的侵染,严重制约了葡萄产业的发展。其中,葡萄炭疽病(Grape ripe rot),是葡萄露地栽培过程中危害葡萄果实的主要真菌病害之一[2]。构建葡萄炭疽菌侵染后的葡萄果皮酵母cDNA文库,可为筛选葡萄炭疽病侵染过程中的互作蛋白提供材料基础。【前人研究进展】葡萄炭疽病主要为害近成熟的果实,严重时病穗率可达50%~70%,葡萄产量及品质都受到严重影响[3,4]。近十年的研究主要集中在葡萄炭疽病病原菌的分类鉴定和遗传多样性等方面。先前的研究认为胶孢炭疽菌(Colletotrichum gloeosporioides)是葡萄炭疽病的唯一病原菌,随着对葡萄炭疽病研究的增多,学者们发现葡萄炭疽病在中国的病原菌主要是C. viniferum。Yan等通过采集北京、河北、山西、山东等地的感染炭疽病的酿酒葡萄病果,分离了34个炭疽菌株系,其中27个属于C. viniferum,且属于C. viniferum的株系表现出更高的致病力[5];Lei等采集了贵州及福建的62个病原菌样品,分离出50个炭疽菌株,其中48个菌株属于C. viniferum[6]。研究人员发现C.viniferum也是引起韩国葡萄炭疽病的病原菌[7]。我国具有丰富的野生葡萄资源,其中刺葡萄(Vitis davidii Föex)是抗葡萄炭疽病的重要种质资源。王跃进等[8]对中国野生刺葡萄宁-5、宁-6、济南-1、洛阳-4、塘尾、雪峰、福建-4等葡萄株系进行了抗炭疽病鉴定,结果表明刺葡萄对炭疽病有极强的抗性,并获得了刺葡萄抗炭疽病基因的分子标记OPC15-1300。因此,利用刺葡萄抗病性强的特点,从中挖掘出相关的抗炭疽病基因,对于减轻葡萄炭疽病的发生、开展葡萄抗病品种选育具有十分重要的意义。【本研究切入点】先前的研究主要集中于葡萄炭疽菌的分类鉴定,但关于葡萄抗炭疽病的分子机理还鲜有报道。目前,尚未见到关于葡萄炭疽菌侵染后的葡萄果皮酵母cDNA文库的报道。【拟解决的关键问题】本研究采用SMART体系构建葡萄炭疽菌侵染后的葡萄果皮酵母cDNA文库,以期为筛选葡萄炭疽病侵染过程中的互作蛋白提供材料基础。
1 材料与方法
1.1 试验材料
前期的研究中获得了葡萄炭疽菌菌株C. viniferum(FJ017)[6]:2015年7月,从福建省福安市溪柄镇葡萄种植园中,采集巨峰葡萄(V. vinifera × V.labrusca,Kyoho)上自然发病、具有典型炭疽病症状的果实样品;在室内参照方中达[9]的方法挑取炭疽菌单孢子分离菌株,25 ℃培养在PDA培养基上,经过3次单孢纯化培养后得到纯化菌株。
以福建省福安市穆云乡溪塔村的刺葡萄福安(V.davidii accession,Fu'an)果实为试验材料。随机选取生长良好的9株刺葡萄(每3株为1个生物学重复),每个重复采集成熟度一致的葡萄果实42粒(每株14粒),将果实用70%的酒精表面消毒1 min后通过针刺法接种炭疽菌C. viniferum[6,10],收集接种后0、1、3、7 d的果皮,液氮冷冻,储存于−80 ℃冰箱,用于进一步分析。
1.2 主要试剂
文库构建试剂盒:SMART cDNA Library Construction Kit(Clontech Code No.634901)、文库检测试剂盒:Advantage 2 PCR Kit(Clontech Code No.639206)、文库纯化试剂盒:TaKaRa MiniBEST DNA Fragment Purification Kit(TaKaRa Code No.9761)、酵母双杂交试剂盒:Matchmaker Gold Yeast Two-Hybrid System(Clontech Code No.630489)、酵母转化试剂盒:YeastmakerTMYeast Transformation System 2(Clontech Code No.630439)、文库质粒提取试剂盒:NucleoBond Xtra Midi EF(MN Code No.U0420B)、DNA连接酶试剂盒:DNA ligation Kit(TaKaRa Code No.6022)、纯化柱:CHROMA SPIN-1000-TE(Clontech Code No.636079)、一缺液体培养基:SD/-Trp with Broth(Clontech Code No.630308)、YPDA培养基(Clontech Code No.630306)、一缺固体培养基:SD/-Trp with Agar(Clontech Code No.630309)、二 缺 固 体 培 养基:SD/-Leu/-Trp with Agar(Clontech Code No.630317)、四缺固体培养基:SD/-Ade/-His/-Leu/-Trp with Agar(Clontech Code No.630323)、金担子素A:Aureobasidin A(Clontech Code No.630499)、X-α-Gal(Clontech Code No.630462)。
1.3 酵母双杂交文库的构建
1.3.1 RNA质量检测 对刺葡萄刺伤接种葡萄炭疽病菌,于1、3、7 d取样,取等量样品,液氮研磨后混合成一个总样品,用氯化锂沉淀法提取RNA,用NanoDrop测量分析总RNA的质量。RNA的完整性使用1.5%琼脂糖凝胶电泳检测。
1.3.2 cDNA合成 使用SMART cDNA Library Construction Kit和 Advantage 2 PCR Kit,参照说明书,将3个不同时期提取的RNA等量混合,取1 μg合成cDNA。cDNA的合成效果采用1.5%琼脂糖凝胶电泳对5 μL cDNA进行检测。
1.3.3 酶切与短片段去除 使用TaKaRa MiniBEST DNA Fragment Purification Kit对上述获得的cDNA 进行纯化,最终溶解于ddH2O中。将溶解产物用SfiI进行酶切处理。使用CHROMA SPIN-1000-TE对酶切后cDNA过柱析出,去除短片段,经PCI/CI净化处理后,乙醇洗涤,ddH2O溶出。
1.3.4 载体连接与库容检测 上述过柱后的cDNA,与pGADT7-SfiI三框载体,参照DNA ligation Kit说明书按比例混合,12 ℃,O/N连接。连接完毕后,进行连接产物纯化,得到初级cDNA文库。取少量初级文库连接产物,电转化法转入感受态细胞HST08;涂布在Amp抗性LB平板,37 ℃过夜培养;统计平板上菌落数,推算初级文库库容。
1.3.5 文库质粒提取 根据库容检测数据,3种读码框各取50万克隆的量,电转化到感受态细胞 HST08中,涂布于10个24.5×24.5 cm LB平板,37 ℃过夜培养。检测转化获得的扩增克隆数目。回收扩增菌落,采用NucleoBond Xtra Midi EF试剂盒进行文库质粒提取。
1.3.6 酵母感受态细胞制备 将Y2HGold菌株在YPDA固体培养基上划线,30 ℃条件下培养,长出单菌落后,挑选直径为2~3 mm的菌落于YPDA液体培养基中,30 ℃、180 r·min−1培养12 h。吸取5 μL培养后的菌液于YPDA液体培养基中培养,直至OD600为0.15~0.30后,700 g离心5 min,加入100 mL YPDA液体培养基重悬菌体,同样条件下培养至OD600为0.40~0.50。室温下将活化的菌液700 g离心5 min,弃上清液,加入30 mL无菌蒸馏水重悬,700 g离心5 min,弃上清液,重复一次,加入1.1×TE/LiAc 1.5 mL进行重悬,瞬时离心15 s,弃去上清液,最后加入600 μL 1.1×TE/LiAc轻弹混匀后待用。
1.4 Y187酵母文库制作
将文库质粒(20 μg)转入Y187酵母菌株中,将转化产物涂布于100个SD/-Leu平板,30 ℃条件下培养3 d。使用含25%甘油的Freezing Medium刮取菌落,收集菌液50 mL即为酵母文库。
2 结果与分析
2.1 RNA质量检测
在刺葡萄接种葡萄炭疽病菌的第1、3、7 d分别取样,液氮研磨后混合成一个总样品,提取总RNA。用NanoDrop 测量分析总RNA的质量见表1。取300 ng RNA进行1.5%琼脂糖凝胶电泳,如图1所示,通道1、2、3条带均明晰,表明RNA质量良好,可用于下一步试验。
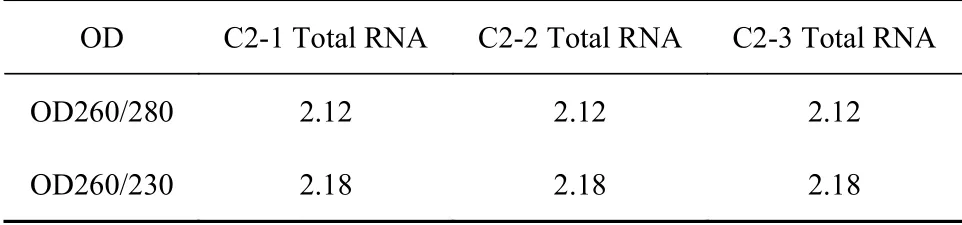
表 1 总RNA质量分析Table 1 Quality of total RNA
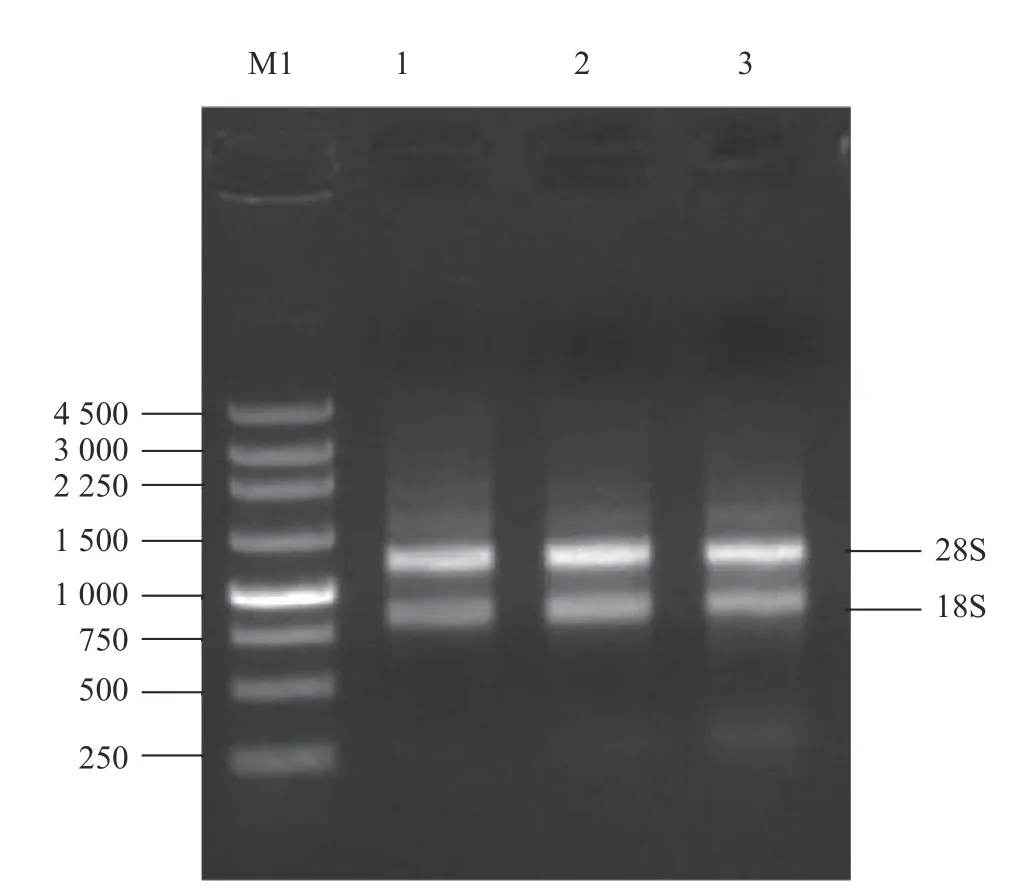
图 1 刺葡萄接种炭疽病菌后的RNA电泳检测Fig. 1 RNA extracted from V. davidii pericarps infected by C.viniferum
2.2 酵母cDNA文库构建
以炭疽病菌侵染后的刺葡萄果皮RNA为模板,反转录合成cDNA,使用试剂盒将cDNA纯化,随后将纯化产物(双链cDNA)酶切处理及短片段去除,获得质量良好的cDNA(图2、3)。将其克隆至 pGADT7三框质粒载体,经纯化精制,获得初级cDNA文库。通过Amp抗性LB平板上生长的细胞菌落数,推算初级文库库容。结果表明,初级文库库容约为5.2×106cfu,读码框1文库约1.5×106cfu,读码框2文库约2.2×106cfu,读码框3文库约1.5×106cfu,重组率约为97.92%,插入的片段长度主要分布在 400~2 000 bp,具有良好的多态性(图4)。对初级cDNA文库扩增后,取100 ng扩增文库质粒进行1.5%琼脂糖凝胶电泳,条带单一且明显(图5)。将上述提取成功的文库质粒,取20 μg转化到Y187酵母菌中,制作扩增的酵母文库。酵母cDNA文库菌液稀释后,涂布在SD/-Leu平板上30 ℃条件下培养3 d。文库滴度(cfu·mL−1)=培养基上克隆数×稀释倍数/涂板体积,依此计算,获得的Y187酵母文库滴度约为6.0×107cfu·mL−1(图6),可用于后续的互作蛋白筛选。
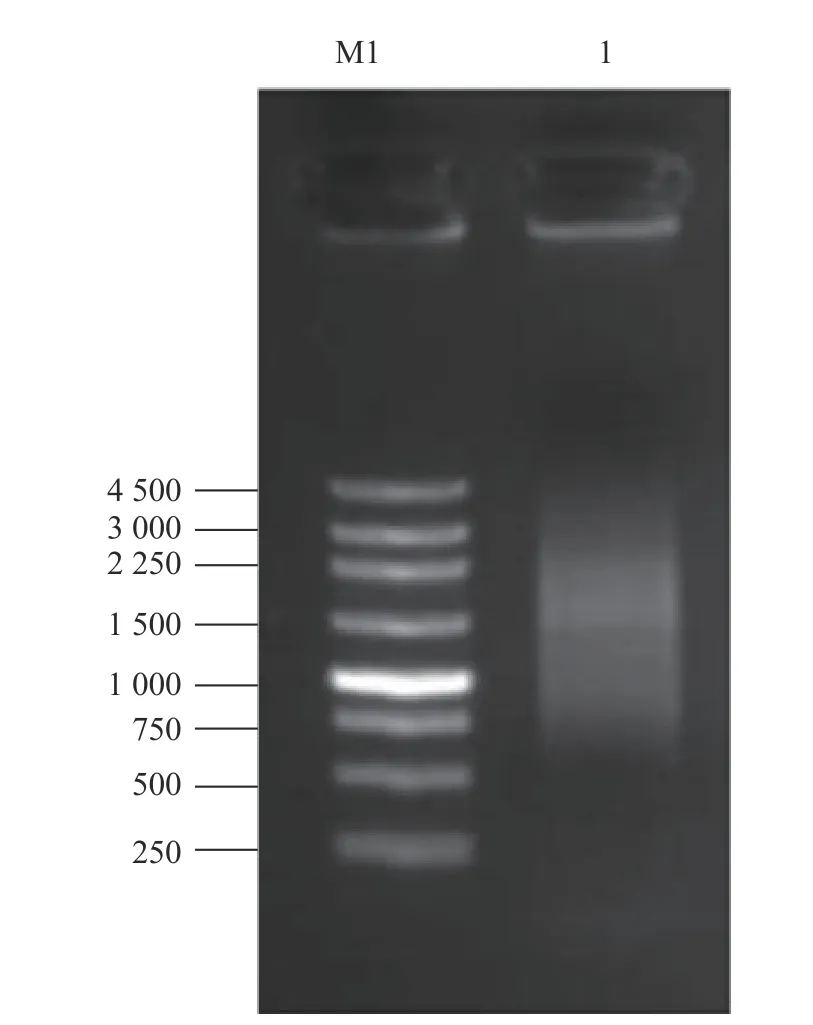
图 2 cDNA合成检测Fig. 2 Detection of cDNA
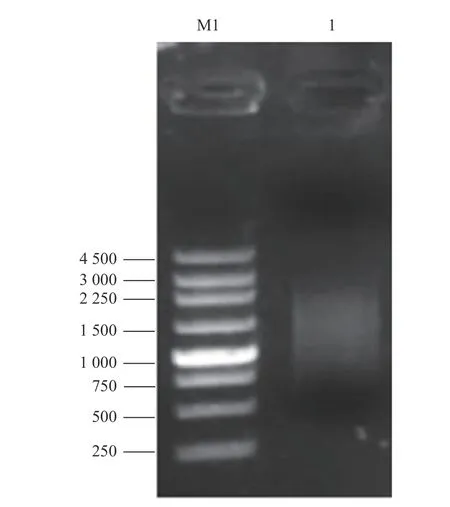
图 3 纯化后cDNA检测Fig. 3 Examination on purified cDNA
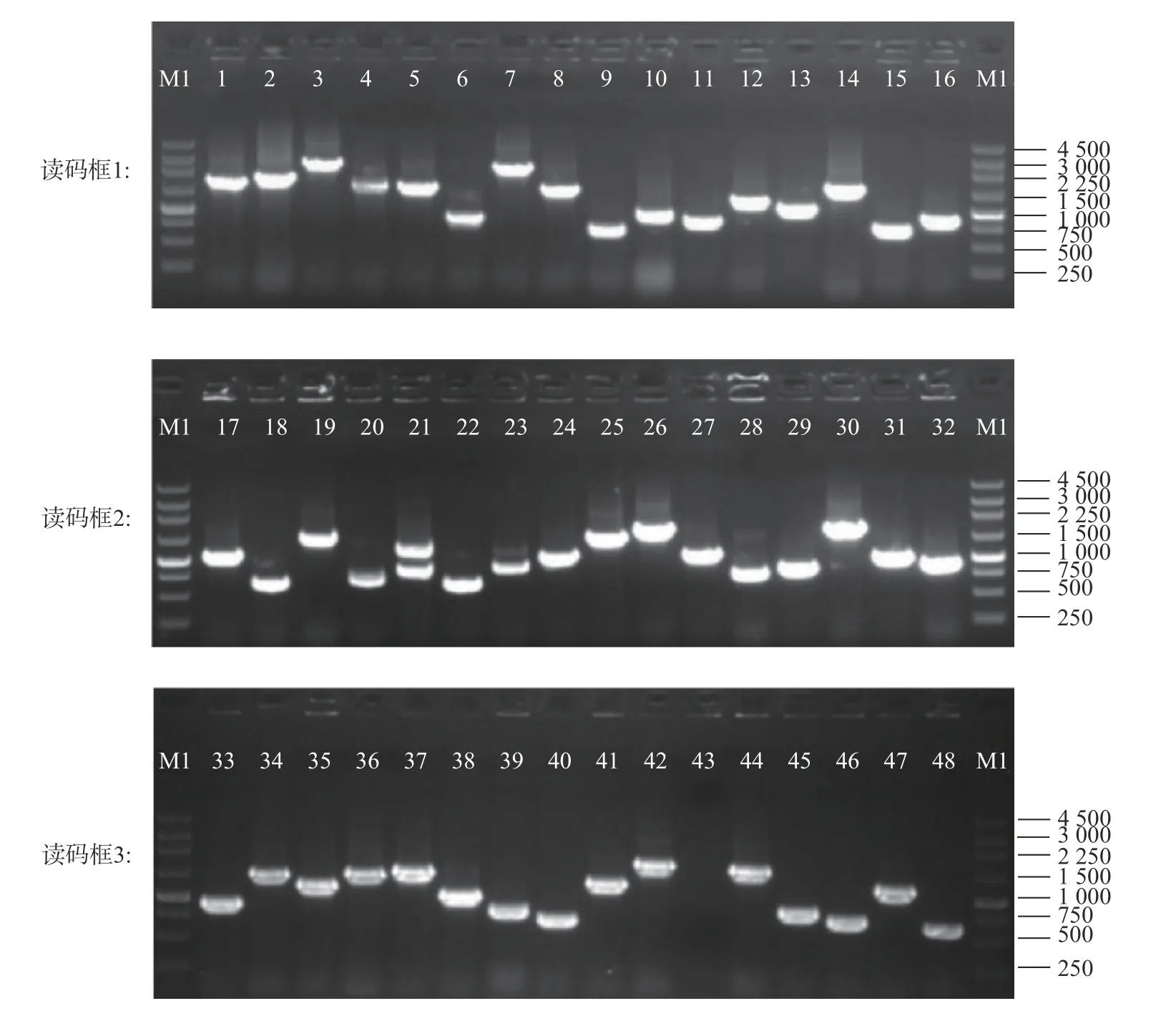
图 4 酵母cDNA文库插入片段检测Fig. 4 Detection of inserted fragments in yeast cDNA library
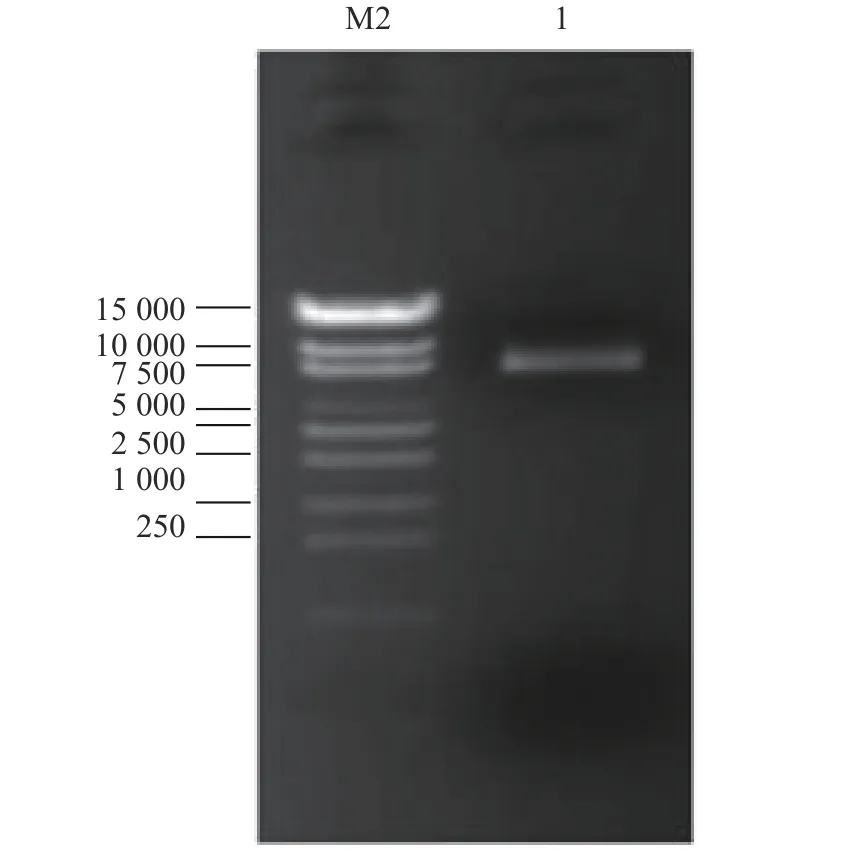
图 5 扩增文库质粒Fig. 5 Amplified plasmid library
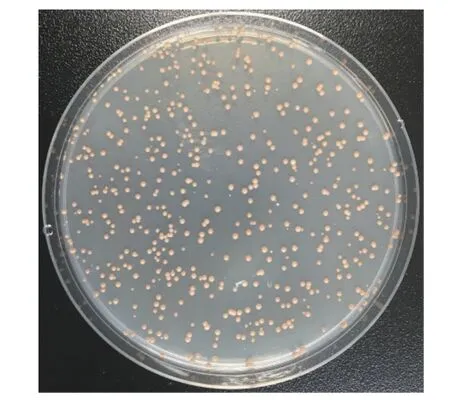
图 6 酵母cDNA文库菌液在SD/-Leu平板上的菌落生长情况Fig. 6 Clones of yeast cDNA library on SD/-Leu plate
3 讨论与结论
炭疽病是影响南方葡萄产业的重要病害,刺葡萄是高抗炭疽病的重要野生葡萄资源,深入挖掘刺葡萄抗炭疽病相关基因,研究其参与炭疽病胁迫响应的抗病机制,对定向改良葡萄抗病性具有重要意义。酵母双杂交是Fields and Song[11]提出验证2个蛋白互作的经典方法,关于葡萄炭疽病侵染下的葡萄果皮酵母cDNA文库至今未见报道。前期的研究中,本课题组获得了炭疽菌菌株(FJ017),以葡萄炭疽病侵染下的刺葡萄福安果皮为材料,提取葡萄炭疽菌侵染后1、3、7 d的葡萄果皮总RNA,采用SMART 技术构建了cDNA 文库,并对文库进行了鉴定。
对于感染炭疽病的刺葡萄果皮,采用氯化锂沉淀的方法可以较好地提取到高质量的RNA。刺葡萄果皮含有大量的多酚和多糖物质,RNA提取较为困难,但高质量的RNA是构建酵母cDNA文库的前提条件[12,13]。本研究中采用氯化锂沉淀的方法,提取到的刺葡萄RNA,28S和18S没有明显的降解,且没有多糖、蛋白质等杂质的污染,因此可以用于后续的酵母cDNA文库的构建。
SMART的方法适用于炭疽菌侵染下的葡萄果皮酵母cDNA文库构建。目前,构建酵母双杂交cDNA文库的方法主要有SMART的方法和Gateway的方法[14]。相较于Gateway的方法,SMART的方法更为经典,技术更加成熟,其对建库所用的RNA起始使用量较少,因为后续的使用中不再对RNA中的多糖、DNA、蛋白质等物质进行分离,因而对建库所用RNA质量要求较高。本研究中,由于刺葡萄果皮RNA较难提取,故而采用了SMART的方法,尽可能提取高质量的RNA以保证后续建库的质量。本研究中以获得的高质量RNA为材料,采用SMART的方法成功构建了炭疽菌侵染下的葡萄果皮酵母cDNA文库,较好地发挥了SMART方法的优势,也为今后构建类似的酵母cDNA文库提供参考依据。
文库建成后需要进行评价,评价的标准主要是文库的库容,对于Clontech公司的SMART文库构建标准来说,文库容量应至少达到1×106cfu[15],而本研究中的文库库容量达到了5.2×106cfu,满足了建库要求。另一个标准是cDNA序列的完整性,SMART的方法要求重组率大于85%且插入片段的大小应当在200 bp以上[13,14],本研究中所建文库重组率为97.92%,插入的片段长度主要分布在 400~2 000 bp,且多态性较高,说明所建文库合格,为后续筛选葡萄炭疽病侵染过程中的互作蛋白奠定基础。
