高脂诱导BRL-3A细胞胰岛素抵抗中氧化应激的作用
2020-03-02董雨函海春旭李文丽
金 磊,杨 帆,董雨函,王 帅,王 欣,海春旭,李文丽
(空军军医大学预防医学系军事毒理学与防化医学教研室,特殊作业环境危害评估与防治教育部重点实验室,陕西省自由基生物学与医学重点实验室,西安 710032;#共同第一作者;*通讯作者,E-mail:liwenli@fmmu.edu.cn)
2型糖尿病(type 2 diabetes mellitus,T2DM)目前是全世界重大的公共卫生难题,日趋受到人们的重视。研究表明,脂毒性和氧化应激与2型糖尿病的发生密切相关[1]。胰岛素抵抗(insulin resistance,IR)是指生理剂量胰岛素在机体内产生生物学效应低于正常,主要表现为胰岛素敏感靶器官(肝脏、骨骼肌及脂肪)对胰岛素介导的糖、脂质、蛋白质代谢能力下降。目前公认的“共同土壤”学说认为IR是代谢综合征、高血压、高尿酸血症、2型糖尿病、心脑血管疾病等聚集发病临床症候群的共同发病基础[2]。长期IR人群出现心脑血管意外等终点事件的概率明显高于正常人群。肝脏作为胰岛素作用的靶器官之一,可合成、储存与释放糖原,并与脂肪代谢密切相关。高能量饮食可使肝脏减少糖原合成,增加糖异生及肝糖原分解,是形成高血糖的主要原因之一[3,4]。建立IR肝细胞模型有助于在细胞水平和分子水平深入研究IR发生机制。多年来基础实验及临床研究证实了氧化应激与T2DM及相关疾病密切相关[5],其可能通过诱导胰岛β细胞凋亡、脂质过氧化、引起线粒体功能障碍和ERS、触发炎性反应和影响胰岛素信号通路等加重IR。本实验在前期建立的棕榈酸诱导的胰岛素抵抗细胞模型基础上[6],研究棕榈酸诱导IR后细胞内活性氧(reactive oxygen species,ROS)、脂质过氧化水平及抗氧化体系活性变化,为探讨T2DM的发生机制和治疗提供实验依据。
1 材料与方法
1.1 材料与仪器
BRL-3A肝细胞系购自中国科学院上海细胞生物所,RMPI1640培养基购自美国Gibco公司,PA、结晶牛胰岛素、DCFH-DA购自美国Sigma公司,新生牛血清购自杭州四季青生物工程材料有限公司,胰蛋白酶、牛血清白蛋白购自西安国安生物科技有限公司。其余常规试剂均为国产分析纯。BCA蛋白定量分析试剂盒购自美国Thermo公司,丙二醛(MDA)测试盒、过氧化氢酶(CAT)测试盒、总抗氧化能力(T-AOC)测试盒、微量还原性谷胱甘肽(GSH)测试盒购自南京建成生物工程研究所。流式细胞仪为美国BD公司的Accuri C6,酶标仪为美国TECAN公司的Infinite 200 PRO。
1.2 方法
1.2.1 细胞处理用液配制 DCFH-DA储备液配制:DCFH-DA用DMSO配成10 mmol/L储备液,分装-20 ℃保存,实验时稀释1 000倍至浓度为10 μmol/L使用。PA储备液配制同以前[2]。
1.2.2 细胞培养 BRL-3A细胞用含10%新生牛血清的RPMI1640培养液,于37 ℃、饱和湿度、体积分数为5%CO2的条件下培养。隔日换液1次,待细胞生长至汇合度超过90%后,胰酶消化离心后按1 ∶3传代培养。按每孔1.0×104个接种至96孔培养板,细胞汇合度超过80%时进行分组处理。
1.2.3 实验分组 观察微孔板细胞处于对数生长期,用PBS溶液洗涤3次后,按以下分组施加处理因素,置于培养箱不同时间后实验:对照组(加入无血清RPMI1640培养液);PA组(PA浓度分别为25,50,100,200,400 μmol/L,用无血清RPMI1640培养液稀释)。以上每组均设复孔,重复3次。
1.2.4 氧化损伤相关指标 丙二醛(MDA)、过氧化氢酶(CAT)、总抗氧化能力(T-AOC)和谷胱甘肽(GSH)按南京建成生物工程研究所试剂盒说明进行测定,用酶标仪检测吸光度后按照试剂盒说明书进行含量计算。细胞ROS水平利用荧光探针DCFH-DA进行检测,用CFlowPlus软件分析细胞内ROS,用流式细胞仪测定细胞相对荧光强度。
1.2.5 细胞相对生存率检测 各组细胞处理完毕(6,12,24 h)后吸弃孔内培养液,每孔加入5 mg/ml的MTT 20 μl,于37 ℃继续孵育4 h,终止培养,弃上清,每孔加入DMSO 150 μl,置于酶标仪振荡3 min后,测定490 nm波长处吸光度OD490值,各处理组细胞相对生存率=各处理组OD490值/对照组OD490值×100%。
1.2.6 IR模型的评估 细胞按实验分组(25,50,100,200,400 μmol/L)处理完毕(6,12,24 h)后吸弃孔内培养液,PBS溶液洗2次,每孔加入100 μl无血清RPMI1640培养液继续培养24 h,检测各孔葡萄糖浓度,计算基础葡萄糖消耗量。各孔消耗葡萄糖量=空白孔葡萄糖浓度-各孔葡萄糖浓度。
同样,细胞分组处理后,每组其中5孔加含1×10-7mol/L胰岛素的无血清RPMI1640培养液100 μl,另5孔仅加无血清RPMI1640培养液100 μl,30 min后吸弃孔内培养液,PBS溶液洗2次,每孔加入100 μl无血清RPMI1640培养液继续培养2 h后,检测各孔葡萄糖浓度,计算胰岛素刺激葡萄糖消耗量。各孔消耗葡萄糖量的计算方法同上。
根据Trinder反应原理,葡萄糖在葡萄糖氧化酶(glucose oxidase,GOD)作用下生成葡萄糖酸和过氧化氢,然后用过氧化物酶(peroxidase,POD)催化过氧化氢,使色原物质生成醌亚胺,颜色深浅与葡萄糖浓度呈正比。因此采用GOD—POD法可使用酶标仪简便测定葡萄糖浓度。
1.2.7 IR模型稳定性评估 综合1.2.5及1.2.6结果选取合适PA浓度及作用时间点处理BRL-3A细胞建模成功后,吸弃孔内培养液,PBS溶液洗2次,每孔加入100 μl无血清培养液,分别培养24,48,72 h后检测基础葡萄糖消耗和胰岛素刺激葡萄糖消耗变化。
1.3 统计学分析
2 结果
2.1 PA增加BRL-3A细胞的ROS水平
CFlowPlus软件分析细胞内ROS结果见图1。与对照组相比,不同浓度的PA作用后细胞内ROS峰值发生右移。25,50 μmol/L的PA作用后,ROS升高的细胞比例分别为69.3%和77.5%,而在100,200,400 μmol/L的PA作用后,ROS升高的细胞比例逐渐下降,依次为71.9%,68.6%和53.2%,且呈现双峰。
分析荧光强度发现,随着PA浓度增加,BRL-3A细胞内ROS水平逐渐增高,相对荧光度与对照组相比明显增加(159.5%,193.7%,181.3%,254.1%,P<0.05,见图1),在高浓度(400 μmol/L)PA则呈下降趋势(227.0%)。
在降低作用浓度梯度后检测细胞内ROS结果,与对照组相比,不同浓度的PA作用后细胞内ROS峰值发生右移,不同浓度PA(12.5,25,50,100,200 μmol/L)作用后,ROS升高的细胞比例依次升高为52.2%,54.4%,66.2%,71.6%,63.2%。分析荧光强度发现,随着PA浓度的增加,BRL-3A细胞内ROS水平逐渐增高,相对荧光度与对照组相比依次增加至117.8%,134.5%,165.3%,197.5%,247.7%(P<0.05,见图2)。
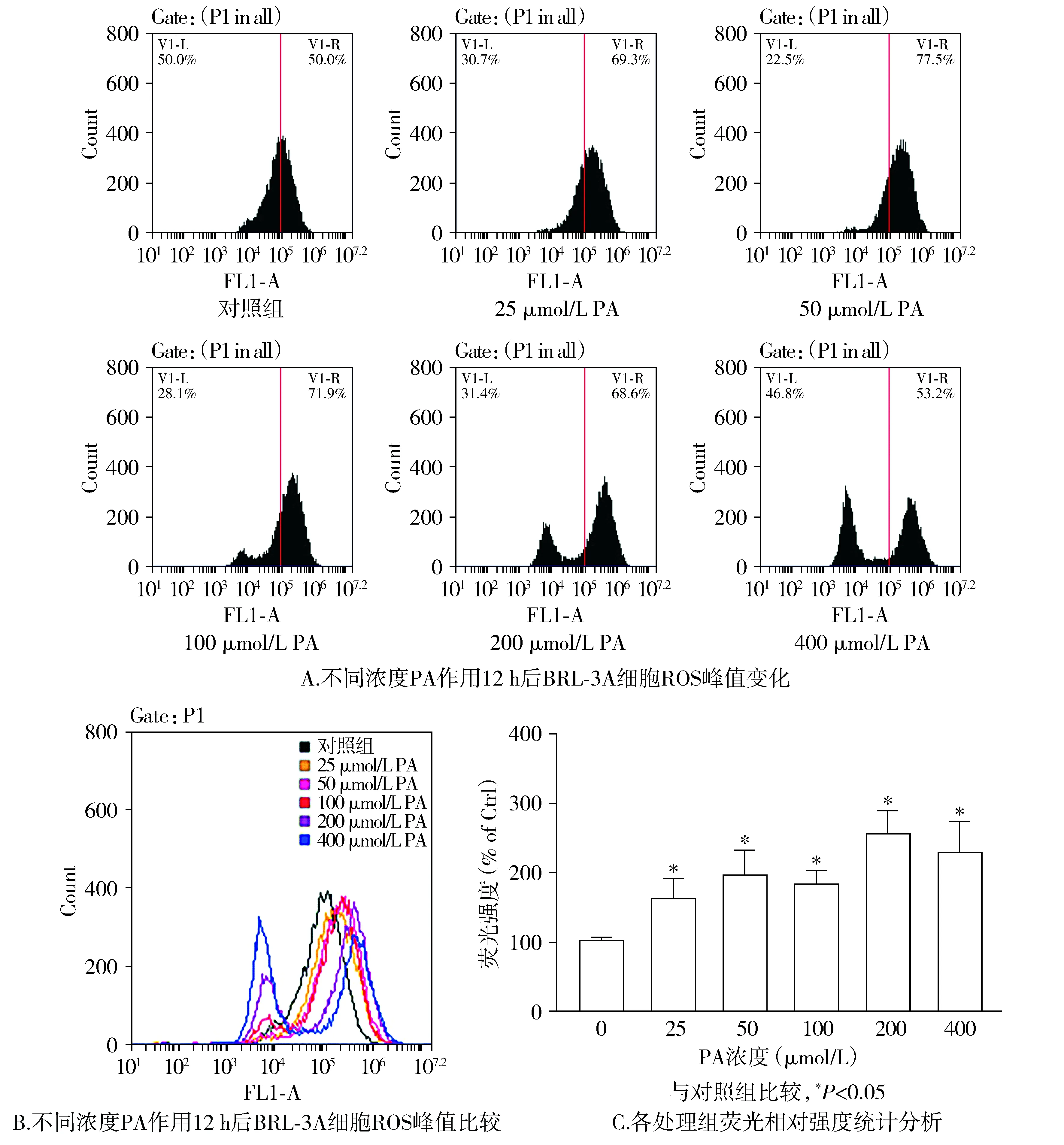
图1 PA(0-400 μmol/L)对BRL-3A细胞ROS水平的影响Figure 1 Effect of different doses of PA(0-400 μmol/L) on ROS in BRL-3A cells
2.2 PA增加BRL-3A细胞的MDA水平
细胞MDA检测结果显示,与对照组细胞(0.30 nmol/mg蛋白)相比,PA诱导的IR模型细胞MDA水平明显增高(P<0.05,见图3),达到3.39 nmol/mg蛋白。
2.3 PA降低BRL-3A细胞的T-AOC
T-AOC检测结果显示,与对照组相比,模型组细胞内及培养液T-AOC均明显下降(P<0.05,见图4)。
2.4 PA降低BRL-3A细胞的CAT活力而未改变GSH含量
CAT活力检测结果显示,与对照组细胞(2.08 U/ml)相比,模型组CAT活力(0.30 U/ml)明显降低(P<0.05,见图5)。GSH检测结果显示,与对照组相比,模型组BRL-3A细胞内GSH含量无明显变化(P>0.05,见图5)。
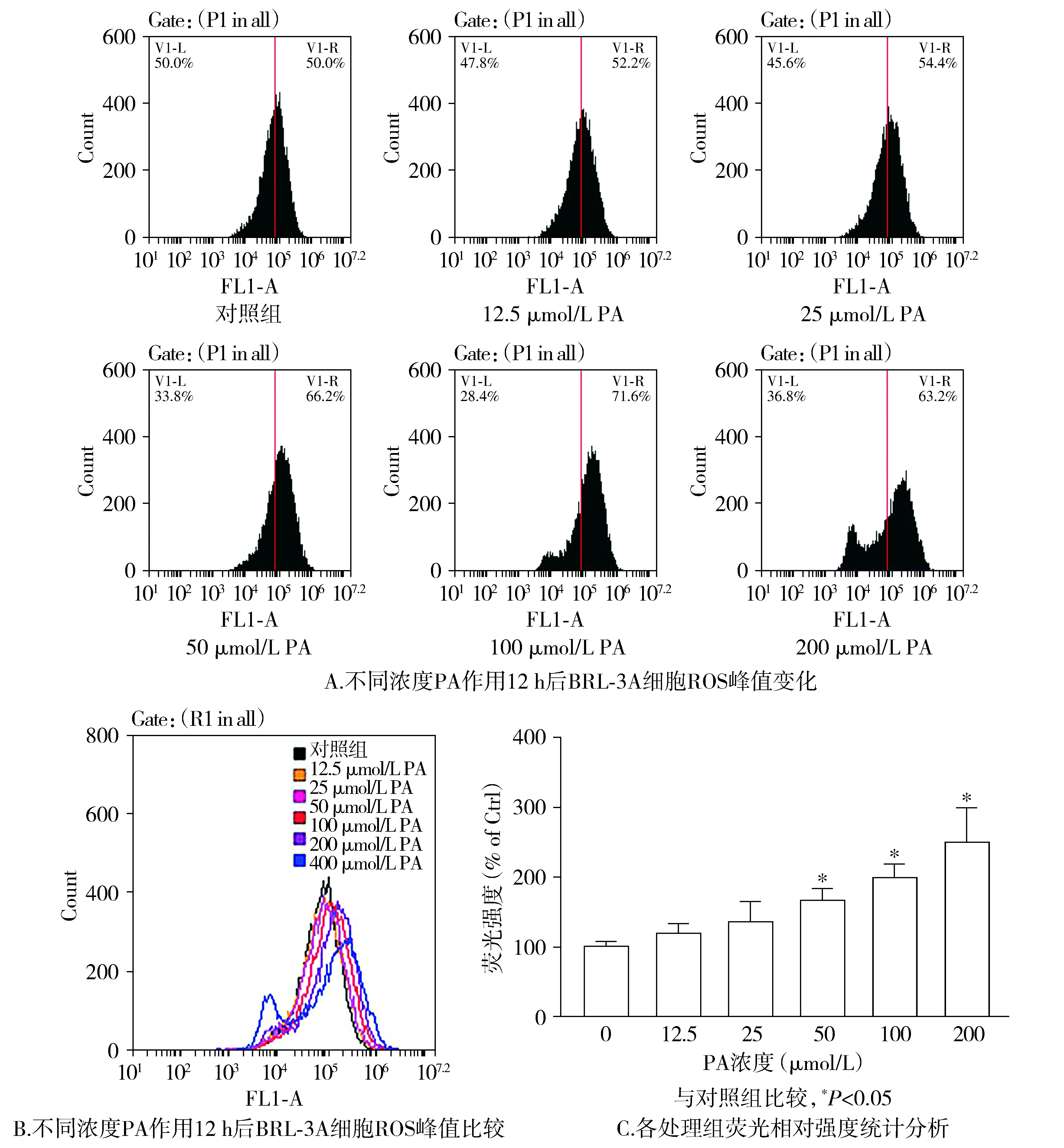
图2 PA(0-200 μmol/L)对BRL-3A细胞ROS水平的影响Figure 2 Effect of different doses of PA(0-200 μmol/L) on ROS in BRL-3A cells
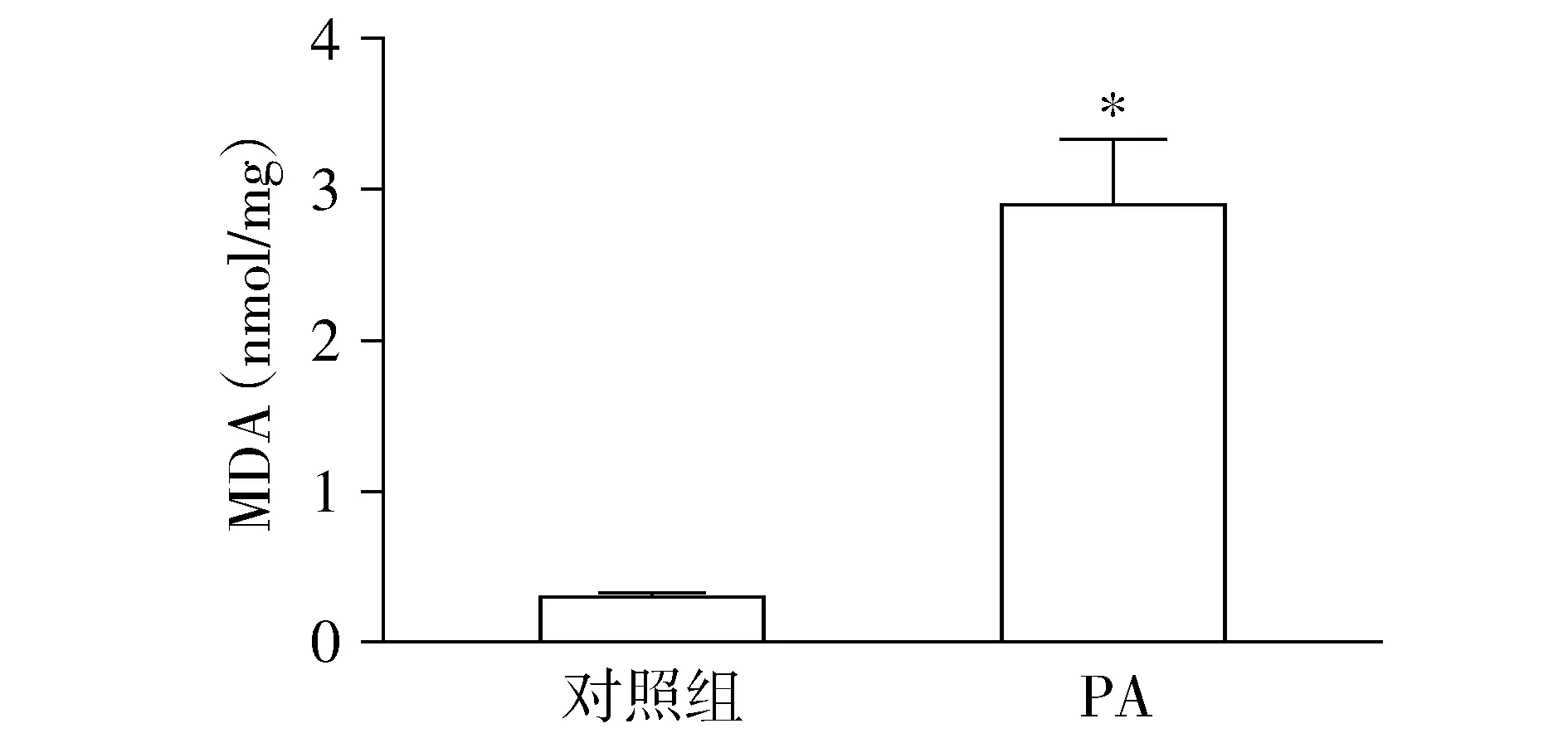
与对照组比较,*P<0.05图3 PA对BRL-3A细胞MDA水平的影响Figure 3 Effect of PA on MDA level in BRL-3A cells
3 讨论
T2DM是由多种病因引起,以慢性高血糖、IR为特征,伴或不伴胰岛素分泌不足的代谢紊乱症候群[7,8],临床常合并有肥胖、高血压、高血脂等[9]。英国前瞻性糖尿病研究(UKPDS)等多项研究发现T2DM患者易出现视网膜病变、神经病变、肾病等微血管并发症,动脉粥样硬化、脑血管栓塞等大血管并发症发生率也明显高于非糖尿病人群[10,11],并可引发尿毒症[12]、糖尿病足、糖尿病酮症酸中毒、高血糖高渗综合征、乳酸性酸中毒等危及生存质量及生命的严重并发症,是威胁全球人类健康最重要非传染性疾病之一。
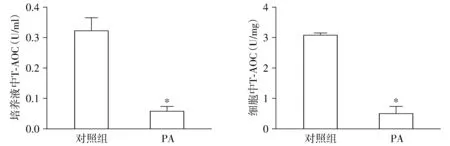
与对照组比较,*P<0.05图4 PA对BRL-3A细胞T-AOC的影响Figure 4 Effect of PA on T-AOC level in BRL-3A cells
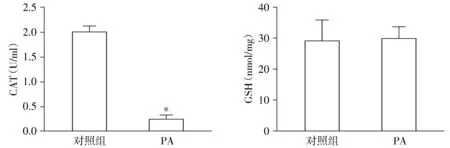
与对照组比较,*P<0.05图5 PA对BRL-3A细胞CAT和GSH水平的影响Figure 5 Effect of PA on CAT and GSH level in BRL-3A cells
T2DM以IR为重要发病基础之一。作为胰岛素作用的重要靶器官,肝脏可合成、储存与释放糖原,并与脂肪、蛋白质代谢密切相关,与T2DM的发生与发展密切相关。脂质代谢异常被认为是IR形成的核心,实验研究认为氧化应激可能是其中的重要一环,其可能通过诱导胰岛β细胞凋亡、脂质过氧化、引起线粒体功能障碍和内质网应激、触发炎性反应和影响胰岛素信号通路等加重IR。
ROS在生物体内是不可或缺的一类物质。当细胞内ROS以一定水平存在,并与抗氧化体系处于动态平衡时,可以作为第二信使作用于细胞内多个信号传导通路,从而调节细胞的分化、增殖、分泌等正常生理活动。如H2O2可以通过提高IRS-1的磷酸化水平调控胰岛素信号通路,从而刺激胰岛β细胞释放胰岛素,而胰岛素的刺激也可以促进细胞内H2O2的生成增加,从而正反馈刺激胰岛素释放。
研究认为T2DM与ROS增多引起自身氧化应激损伤密切相关[1]。高血糖、高血脂可导致线粒体产生大量ROS,引起氧化应激损伤,进而引起:①激活胰岛β细胞NF-κB信号通路,引起细胞炎症反应,诱导细胞凋亡,抑制胰岛素分泌;②作用于InsR、IRS、PI3K、Akt、GLUT等,影响胰岛素信号通路,诱导肝脏、肌肉、脂肪组织IR;③氧化应激损伤引起晚期糖基化终产物蓄积,对诱发T2DM晚期并发症的发生及发展起着重要作用。然而也有研究发现抗氧化可能产生有害作用[13,14],而增加机体氧化水平还可延长生命[15]。因此过度氧化与抗氧化可能均不利身体健康,维持机体一定水平的氧化应激方对健康有利[16]。
采用流式细胞术检测PA对BRL-3A细胞作用后ROS水平发现,PA作用可以显著增加细胞内ROS的水平,并存在明显的剂量-效应关系。低浓度PA(100 μmol/L)作用于细胞时,细胞ROS水平是对照组的1.5倍以上(P<0.05),但细胞的相对生存率却没有降低[6],说明细胞存在的抗氧化体系在一定范围内可以抗衡PA引起的ROS生成增加,也不会产生IR。在达到一定阈值后(100 μmol/L),随着PA浓度的增加,细胞内ROS水平增加的更多。而细胞生存率虽无变化[6],但却会出现摄糖能力下降、对胰岛素反应性减低、脂肪和类脂等多项脂代谢指标异常等与IR相关的代谢紊乱[6]。继续增加PA作用浓度(200,400 μmol/L)后,细胞内ROS继续增加,并出现了大量细胞死亡,产生了大量细胞碎片,从而使ROS的增加幅度降低。
MDA是氧自由基与生物膜多聚不饱和脂肪酸发生脂质过氧化反应的终产物之一,它的含量能完全反映机体脂质过氧化的速度[17]。检测细胞MDA水平发现,模型组MDA水平是对照组的10倍左右,说明细胞脂质过氧化水平增高显著,证明在PA诱导的BRL-3A细胞IR过程中,氧化水平显著增加。细胞内存在的氧化还原体系具有一定的缓冲能力,仅证明氧化水平增加不能说明细胞出现了氧化应激损伤,因此本实验接下来研究了细胞的的抗氧化体系(MDA、CAT、T-AOC和GSH)活力。T-AOC结果提示,无论是细胞内还是细胞外,模型组的总抗氧化能力均明显降低,细胞内CAT活力也下降,说明在PA诱导的IR过程中,细胞清除氢氧自由基(OH-)的能力降低,细胞氧化还原体系失衡,而细胞氧化应激程度增加。
谷胱甘肽是由谷氨酸、半胱氨酸和甘氨酸组成的小分子肽,在体内以还原型(GSH)和氧化型(GS-SG)两种形式存在,GSH因其结构中存在的巯基-SH易被氧化脱氢,使其成为体内重要的自由基清除剂、抗氧化剂、解毒剂。然而,实验研究发现,在用PA造成BRL-3A细胞IR时,细胞内GSH的含量与对照组相比并无明显下降,与脂肪、肌细胞等实验结果不同。分析原因可能因为肝脏代谢谱的特殊地位。体内GSH合成的主要场所在肝脏,肝内GSH的浓度是体内最高的。低氧血症、创伤时,肝脏GSH合成增加以拮抗自由基毒性。因此作为肝脏重要的抗氧化物,其在IR时含量并未降低,可能是因为IR时肝细胞的GSH应激性产生增加,用于抵抗氧化应激损伤消耗所致。
总之,PA作用于肝细胞时可以导致细胞ROS生成增加,脂质过氧化,抗氧化能力下降,导致氧化应激损伤,可能通过IKK/NF-κB、JNK/SAPK、PI3K等通路的活化,干扰细胞胰岛素信号通路,进而出现胰岛素合成和分泌下降,胰岛β细胞凋亡及胰岛素功能受阻,最终导致IR[13,14],因此氧化应激程度可以作为评估IR程度备选指标。
