腰脊神经脉冲射频治疗糖尿病周围神经病变疗效研究
2020-02-29张忠杰黄海兰
张忠杰 黄海兰 姚 旌 王 林△
(1贵州医科大学附属医院疼痛科,贵阳 550004;2贵州省贵阳市南明区人民医院麻醉科,贵阳 550002)
糖尿病周围神经病变(diabetic peripheral neuropathy, DPN) 是糖尿病最常见的并发症之一。其典型的表现为感觉神经病变,且50% 左右的糖尿病和13% 左右的糖耐量受损的病人伴随着神经病理性疼痛,导致病人生活质量和工作能力受损[1]。DPN疼痛发病率高[2]、症状重、严重影响生活,目前无确切有效的治疗方案。有研究表明,药物联合使用,仍能较好的缓解症状[3]。kim等[4]报导了脉冲射频在神经病理性疼痛的治疗中也取得了良好的治疗效果,目前,并无相关文献探讨脊神经的脉冲射频对糖尿病周围神经病变疼痛的影响。本文旨在探讨腰脊神经脉冲射频治疗糖尿病周围神经病变疼痛的可行性。
方 法
1.一般资料
由贵州医科大学附属医院伦理委员会审核批准,所有病人及家属均签署知情同意书。全组2型糖尿病病人30例,男性18例,女性12例,采用视觉模拟评分法(visual analogue scale, VAS)分层抽样的方法,随机分为对照组及治疗组,对照组男性10例,女性5例;平均年龄57.7±6.9岁,其中VAS 6~7分病人7例,8~9分病人8例,10分病人0例。治疗组男性8例,女性7例。平均年龄58.2±7.2岁,其中VAS 6~7分病人7例,8~9分病人7例,10分病人1例。两组病人一般资料差异无统计学意义(P> 0.05,见表1)。
纳入标准:①葡萄糖耐量异常,符合WHO对糖尿病提出的诊断标准;②有周围神经病变损害的症状体征[5],主要表现为对称性双下肢末梢烧灼样、针刺样疼痛,自发性发作,符合神经神经病理性疼痛诊断标准;③排除其他疾病导致:排除营养缺乏性周围神经病变、血管性周围神经病变、酒精中毒性周围神经病变[5];排除心、肺、肝肾功能异常病人、凝血功能严重障碍、糖化血红蛋白> 12%、精神及情感障碍[6];排除并发急性感染及碘过敏病人。
2.治疗方法
治疗期间严格按照原有控制血糖方案,并监测血糖,按专科意见控制血糖。治疗期间如疼痛明显,可临时使用氨酚双氢可待因1片/次,每日2次,停用其他止痛药物。
对照组:使用度洛西汀20 mg,每日2次,3天后加量至60 mg,每晚1次。普瑞巴林75 mg,每日2次,3天后加量至150 mg,每日2次,口服8周后缓慢减量直至停用。
治疗组:口服药物同对照组,同时在入组后即入院完善相关检查后,予腰脊神经脉冲射频治疗,病人均于介入手术室在X光机下进行微创介入操作,行L4、L5、S1神经根背根神经节脉冲射频治疗[7]。行L4神经根穿刺时,神经根穿刺靶区在椎弓根下方数毫米(“苏格兰狗”狗眼下方);行L5脊神经射频时,L5横突下缘、S1上关节突和髂嵴形成的三角窗为进针点。S1神经根穿刺时,影像增强器向尾侧旋转,以消除L5-S1椎间盘重影,向患侧倾斜10°左右,向S1孔内上方进针,针尖不要超过骶前孔,局麻后用21G,15 cm(工作端5 mm Baylis Medical Company Inc加拿大)射频穿刺针沿球管同轴方向进针,直至出现异感,正侧位片确认针尖位置后,回抽无异常,注射碘佛醇0.5 ml,神经根显影良好(见图1),连拔出穿刺针针芯,插入疼痛射频治疗仪电极(BAYLIS REF PMG-230, Baylis Medical Company Inc加拿大),50 Hz,0.1 V诱发下肢异感。开启脉冲射频模式,予2 Hz,45 V,42℃ 脉冲射频治疗600 s。术毕再次回抽无异常后,缓慢分3次注入1% 利多卡因1 ml,术毕拔针,局部按压,观察半小时,注意观察生命征,有无心慌、呼吸困难、头晕等症状,生命征平稳送返病房。行一侧脊神经脉冲射频后,3~4天后再次行另一侧脊神经脉冲射频治疗。
3.疗效观察及评价指标
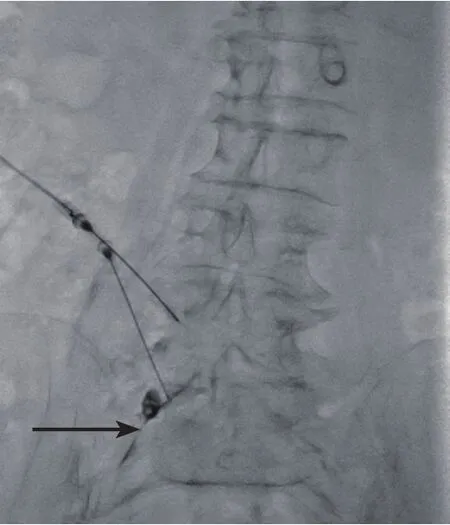
图1 造影剂沿神经根显影(箭头示照影剂沿L5神经根显影,未见血管影)
采用VAS评价疼痛缓解程度,VAS两端分别标记为0分、10分,分别表示无痛和剧烈疼痛;病人根据对自身疼痛感觉进行标记得出疼痛评分。疼痛缓解率计算方法为治疗前及治疗后3月VAS差值/治疗前VAS评分值×100%,VAS评分下降> 75为优效,50%~74%为良效,25%~49%为微效,< 25%为无效,治愈标准为完全不痛。治疗有效人数为优效+良效。缓解率为有效人数/治疗人数。以健康调查简表 (short form health survey-36, SF-36) 评分评价生活质量改善情况,SF-36含8个维度,对治疗组和对照组病人进行生活质量测评。计算分量表中各条目积分之和,得到分量表的粗积分,将粗积分转换为0到100 的标准分。分值越高,提示生活质量越好。观察治疗前,治疗后1周、治疗后1月,治疗后3月VAS评分、SF-36评分观察疼痛变化情况、生活质量变化及不良反应。
4.统计学分析
采用统计软件SPSS 13.0进行统计学分析,所有计量资料采用均数±标准差()表示。两组比较采用配对t检验,等级资料采用百分数表示,两组率的比较采用X2检验,P< 0.05表示差异有统计学意义。
结 果
1.一般资料
两组年龄、性别、病程、VAS评分差异无统计学意义(见表1)。
2.VAS评分比较
治疗1周后、治疗后1月后及3月后两组VAS评分均较治疗前显著降低(P< 0.05),且治疗组缓解率显著高于对照组(P< 0.05,见表2)。
3.生活质量比较
与治疗前相比较,对照组在治疗后1周表现出躯体疼痛和总体健康指标的显著增加 (P< 0.05),在治疗后1月和3月表现出除生理功能指标外,其他7项指标的显著增加 (P< 0.05);治疗1周、1月后及治疗3月后SF-36生活质量评分除生理功能状况外,治疗组的其他7个维度比对照组及治疗前都显著提高(P< 0.05);但治疗组在治疗后3月活力及精神健康较治疗后1月显著降低(见表3)。
4 .两组有效率比较
治疗组有效率在治疗后3月为89.7%,高于对照组71.0%,差异有统计学意义 (P< 0.05,见表4)。
5.并发症及不良反应
治疗过程中治疗组后出现双手震颤1例,恶心呕吐1例。对照组出现嗜睡1例,缓慢加量后缓解。不良反应组间比较无统计学差异。
讨 论
DPN疼痛的主要临床表现为瘙痒,牵扯样、烧灼样、针刺样疼痛,夜间疼痛加重,严重影响睡眠及生活。常合并感觉异常,导致非创伤性的四肢坏死和截肢。DPN患病人数多,疼痛剧烈,危害巨大。DPN疼痛的发生率和血糖控制无关,血糖控制良好并不能阻止其进一步发展[8]。DPN疼痛与炎性痛和其它神经病理性疼痛发病基础不同,是临床工作中极为棘手的问题,这种神经病理性疼痛甚至表现为对阿片类药物的抵抗[9]。
DPN疼痛可能涉及的机制为:糖基化终末产物的堆积;醛糖还原酶活性增加;多元醇通路的激活;增加活性氧及活性氮的产生,包括过氧化氢、羟基自由基、氧自由基,以及促炎因子的释放,例如肿瘤坏死因子-α、白细胞介素家族;破坏背根神经节的细胞线粒体;Na+/K+-ATP酶的活性减弱等[8,10]。但DNP机制尚不明确,也缺乏有效的治疗措施[11]。
目前DPN疼痛的治疗以药物治疗为主[12],普瑞巴林是一种通过拮抗NMDA受体及钙通道受体的抗癫痫药物。国际疼痛学会推荐普瑞巴林作为治疗神经病理性疼痛一线药物[13]。美国神经病学会已推荐普瑞巴林作为DPN疼痛的一线治疗药物[14]。度洛西汀是一种5-羟色胺和去甲肾上腺素再摄取双重抑制(SNRIs),英国的一项研究表明度洛西汀用于治疗DPN疼痛能改善病人的生活质量[15]。2004年9月成为美国FDA批准用于DPN疼痛的第一个药物[16]。
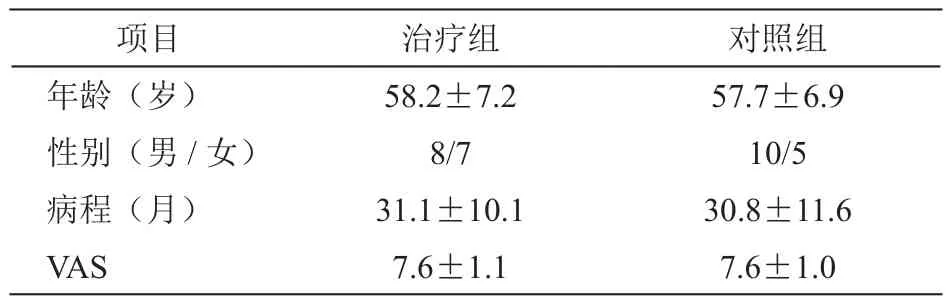
表1 两组一般资料
表2 两组的疼痛强度变化()

表2 两组的疼痛强度变化()
*P < 0.05,与治疗前相比;#P < 0.05,与对照组相比
治疗前 治疗后1周 治疗后1月 治疗后3月对照组 7.6±1.0 4.3±0.9* 3.40±1.5* 3.8±1.2*治疗组 7.6±1.1 1.6±0.8#* 2.47±1.3#* 2.9±1.6#*
表3 两组的SF-36评分比较()

表3 两组的SF-36评分比较()
*P < 0.05,与治疗前相比;#P < 0.05,与对照组相比;△P < 0.05,与治疗后1月相比
对照组治疗前 治疗后1周 治疗后1月 治疗后3月 治疗前 治疗后1周 治疗后1月 治疗后3月生理功能 87.0±6.8 91.0±6.3 89.7±6.1 90.7±9.8 86.7±7.2 84.1±7.4 86.0±8.1 87.3±8.8生理职能 43.3±20.0 95.0±10.4#* 86.7±16.0#* 73.3±22.1#* 38.3±16.0 38.3±16.0 61.7±16.0* 53.3±16.0*躯体疼痛 27.1±16.8 85.0±14.0#* 77.0±17.9#* 68.0±22.1#* 26.4±14.5 40.0±11.3* 51.4±16.7* 49.8±13.4*总体健康 7.0±3.2 64.0±12.4#* 55.7±13.0#* 49.0±17.0#* 6.33±2.3 22.0±12.4* 24.7±9.3* 30.0±12.0*活力 34.3±14.3 91.3±7.7#* 82.3±12.5#* 67.7±19.8#*△ 36.0±17.8 34.3±12.1 61.7±14.2* 58.0±16.2*社会功能 30.4±16.0 84.5±13.8#* 74.8±19.0#* 68.9±22.3#* 28.9±16.2 30.4±22.3 53.3±24.9* 52.6±22.9*情感职能 37.75±11.8 91.1±15.2#* 80.0±21.1#* 71.1±17.2#* 37.8±11.8 31.1±19.8 53.3±24.6* 48.9±21.4*精神健康 43.73±6.3 88.3±7.5#* 74.7±14.7#* 61.1±25.8#*△ 41.5±10.7 40.5±12.0 49.2±10.1* 40.5±15.0*治疗组项目

表4 两组有效率比较(n, %)
虽然多种药物合用,临床效果并不令人满意[2],采用综合治疗十分必要。脊神经脉冲射频治疗在慢性疼痛特别是神经病理性疼痛取得了良好的治疗效果[3],同时本研究结果显示,腰脊神经脉冲射频有效缓解DPN疼痛。虽然脉冲射频缓解神经病理性疼痛的镇痛效果确切,但目前对于其作用机制并不明确[17]。脉冲射频治疗的机制有:①Erdine等[18]通过电镜发现,脉冲射频主要选择性影响传递痛觉的C纤维,从而减少运动神经的损伤;②脉冲射频能有效减轻脊髓小胶质细胞活性,而小胶质细胞的激活、增殖以及炎性因子释放的增多在神经病理性疼痛的发生中发挥重要的作用[19];③ Liu等[20]研究显示,背根神经节脉冲射频能有效降低p38激活丝裂原活化蛋白激酶的表达,p38激活丝裂原活化蛋白激酶激活肿瘤坏死因子-α、白细胞介素-1、白细胞介素-6的级联反应,在DPN的发生中发挥重要作用;④Hagiwara等[21]研究显示脉冲射频主要抑制了去甲肾上腺素以及血清素通路的疼痛下行抑制系统;⑤脉冲射频明显降低下游的炎性因子水平,Vallejo等[22]研究显示,脉冲射频能有效降低肿瘤坏死因子-α,白介素-6的表达;⑥Van Zundert等[23]发现脉冲射频可引起脊髓背角神经细胞与神经可塑性密切相关的c-Fos基因表达上调,抑制C纤维对A-δ纤维反复爆发样刺激的反应,且证实了脉冲射频产生的治疗作用与射频温度并无明显相关。同时,脉冲射频具有降低突触活动,具有降低中枢敏化等作用。此外,脉冲射频与针刺镇痛有相同的镇痛机制,能刺激脑啡肽和内啡肽的增加[24],研究显示脉冲射频能增强体内镇痛物质如内啡肽释放从而缓解疼痛。
脉冲射频是在连续射频的基础上发展起来的一项治疗慢性疼痛的新技术,在影像定位下操作提高了安全性,脉冲射频与射频热凝相比并不毁损神经,不良反应小[25],具有较高的安全性。不良反应发生率明显低于口服药物,尚未出现发生严重并发症报导[26]。目前未查阅到脉冲射频治疗后出现明显的不良反应和并发症[27]。治疗组中出现1例双手震颤,度洛西汀导致的双手震颤未查阅到相关文献报导,但在度洛西汀说明书中有详细说明。需要在临床治疗中注意观察,必要时停用度洛西汀及使用苯海索等对症处理。而治疗组出现1例恶心呕吐,对照组出现1例嗜睡,考虑普瑞巴林导致,普瑞巴林导致的恶心呕吐、嗜睡,未查阅到相关文献报导,但在药品说明书中有详细说明,在临床使用过程中较为常见,对症处理及缓慢加量症状缓解或消失,如病人不能耐受,建议换用药物。
本研究结果显示治疗1周后,对照组除躯体疼痛及总体健康较治疗前有统计学差异外,其余功能改变并不明显,这可能与药物的缓慢加量有关,且度洛西汀用于神经病理性疼痛,起效时间约1周[14]。研究显示,腰脊神经脉冲射频治疗组在3月后疼痛缓解情况显著高于对照组,无明显不良反应及并发症发生。相较于脊髓电刺激、脑深部电刺激治疗方法,脉冲射频治疗具有损伤小、安全、可以重复治疗、医疗费用低、感染风险小、操作简便等优点。病人在术后3月活力及精神健康较术后1月有反复,是否与脉冲射频治疗的参数相关,值得进一步研究和探讨。
综上所述,腰脊神经脉冲射频联合联合药物治疗DPN疼痛效果确切,并发症少,值得临床推荐。
