脊髓电刺激治疗下肢缺血性疼痛的临床研究
2020-02-29董道松赵梦楠王成龙
刘 妍 董道松 赵 林 奚 奇 于 雪 赵梦楠 王成龙 宋 涛
(中国医科大学附属第一医院疼痛科,沈阳110001)
下肢缺血性疼痛是由下肢动脉粥样硬化闭塞或痉挛导致下肢缺血而产生的疼痛性疾病。严重肢体缺血(critical limb ischemia, CLI)产生的原因为肢体远端重度血流受阻[1]。下肢缺血常见原因为动脉硬化闭塞症 (arteriosclerosis obliterans, ASO)和糖尿病足 (diabetic foot)。由于现代生活节奏和饮食结构的改变,及人口老龄化的加剧,下肢缺血性疾病的发生率逐年增高,CLI的年平均发病率为0.35%,患病率为1.33%[2]。
脊髓电刺激 (spinal cord stimulation, SCS)最早在1976年被报道用于治疗缺血性疾病[3],近年来国外已经广泛开展,其主要作用在于缓解疼痛和改善微循环两个方面。国外研究已经证实了SCS在下肢缺血性疾病病人中的有效性,但是国内尚无相关临床研究,本试验通过观察SCS在下肢缺血性疼痛病人中的临床效果,证实SCS对下肢缺血性疾病减轻疼痛和改善微循环的作用。
方 法
1.一般资料
经中国医科大学附属第一医院伦理委员会审批,选取我院疼痛科2015年10月至2017年5月下肢缺血性疼痛病人19例。
纳入标准:①诊断为动脉硬化闭塞症(arteriosclerosis obliterans, ASO)或糖尿病足 (diabetic foot),存在下肢缺血改变,标准为经皮氧分压(transcutaneous oxygen pressure, TcPO2) < 30 mmHg,或 TcPO2≥30 mmHg但存在重度疼痛,视觉模拟评分法(visual analogue scale, VAS)评分 > 7分;②保守治疗无效;③无法进行外科手术和介入治疗,或手术治疗和介入治疗后TcPO2仍然小于30 mmHg且疼痛缓解不明显的病人。
排除标准:①无法耐受SCS的病人,或TcPO2<10 mmHg的病人[4];②无法配合随访的病人;③伴有基础疾病预计生存期不超过1年的病人;④存在除下肢缺血性疼痛之外的其他疼痛病人。⑤术前行PHQ-9抑郁筛查量表和广泛性焦虑自评量表,排除PHQ-9评分大于10分提示存在中度以上抑郁状态和广泛性焦虑自评量表评分大于10分提示存在中度以上焦虑的病人。
2.方法
符合上述标准病人19例,所有病人给予规范药物治疗(西洛他唑等)和镇痛药物(非甾体抗炎药物和阿片类药物)治疗,所有病人术前充分交代并签署知情同意书。
SCS分为两个阶段,测试阶段和植入阶段。
(1)测试阶段:硬膜外穿刺后,首先将两根8触点神经刺激电极置入T9、T10椎体节段的硬膜外间隙,根据病人术中测试情况调整电极位置,确保术中测试电流完全覆盖病人疼痛部位后妥善固定电极,连接延长导线,外接体外临时刺激器测试5~7天。测试过程观察病人疼痛缓解和下肢血运改善情况,决定是否可进一步行植入式脉冲发生器(implantable pulse generator, IPG)的植入。测试通过标准为:疼痛缓解50%以上且TcPO2较术前升高≥10 mmHg[5]。
(2)植入阶段:将IPG置入病人腹部或臀部皮肤脂肪层下。在治疗前应谨慎设计IPG植入的位置,以不影响病人日常生活为宜。臀部IPG置入的皮下囊袋定位时病人应取坐位,若放置位置太低,病人坐位时可产生极度不舒适感,若放置位置高及腰带处,可影响病人日常穿衣。
3.观察指标
记录病人一般情况及风险因素(年龄、性别、病程、疾病史、治疗史、吸烟史、合并症及情绪状态等);治疗前及治疗后(电极置入后)1 天、1 周、1个月、3个月、6个月的 VAS、匹兹堡睡眠质量指数 (pittsburgh sleep qualityindex, PSQI)、皮肤温差改变和不良反应。
4.统计学分析
采用SPSS 19.0 软件进行统计学分析,计量资料数据用均数±标准差()表示,采用独立样本t检验,P< 0.05 表示差异有统计学意义。
结 果
1.病人一般情况
本研究符合纳入标准的病人19例,其中2例测试后不符合IPG永久植入标准而放弃植入,共17例病人完成SCS植入治疗。病人一般资料见表1,17例病人中ASO病人7例,糖尿病足病人10例;3例病人存在双下肢疼痛,其余均为单侧肢体疼痛;其中男性12例,女性5例,平均年龄71.2±7.0岁,平均病程为9.3±4.5个月。
2.疼痛情况
观察记录病人治疗前和电极置入后1 天、1 周、1个月、3个月、6个月的VAS评分,术前VAS 为7.5±0.9,术后1 天、1 周、1个月、3个月、6个月的VAS分别为2.3±1.5、1.6±1.3、1.3±0.9、1.1±0.8和1.4±0.8,与术前比较,均显著下降(P< 0.05,见图1)。
3.睡眠情况
与治疗前比较,治疗后3个月和6个月时病人的PSQI,显著改善(P< 0.05,见图2)。
4.皮肤温差改变
利用红外热成像仪测试病人体表温度,选取双侧足背部温度进行测量(见图3中 E, F点),记录E点与F点温差,对比治疗前和治疗后1周的温差变化,体表温差由治疗前1.71±0.82℃下降到治疗后的0.97±0.43℃,存在统计学差异(P<0.05)。
5.不良反应
其中6例病人(35.3%)术后1周内出现电流移位,调整参数后刺激可重新覆盖疼痛区域;1例病人(5.9%)出现切口延迟愈合;2例(11.8%)病人术后出现一过性疼痛加重,未做特殊处理自行好转。

表1 病人一般资料Table 1 The general data of patients

图1 治疗前后各时间点VAS 变化 (n = 17,)Fig.1 VAS scores before and after treatment (n = 17,)

图2 治疗前后PSQI 的比较 (n = 17,)Fig.2 PSQI scores before and after treatment (n = 17,)
讨 论
下肢缺血性疾病的治疗原则是改善下肢血运、缓解疼痛、避免溃疡及延缓截肢。保守治疗方法包括抗凝药物、血管扩张药物及镇痛药物的应用。血运重建方法包括动脉搭桥、支架植入等外科和介入手术,但是有部分病人不适合进行血运重建手术,而且存在难以控制的疼痛,此类病人2年截肢率为9.3%,死亡率为23.2%[6]。腰交感神经毁损术(lumbar sympathetic nerve lesion, LSNL)是目前国内外应用较多的治疗下肢缺血性疾病的微创介入手术方法,将腰交感神经通过物理或化学的方法毁损后,使血管持续扩张从而改善下肢血液循环并减轻疼痛[7,8]。研究显示,交感神经毁损治疗对动脉病变不广泛、侧支循环基本建立的下肢动脉缺血的病人效果较好[9],但是对于病程较晚、病情较重者或缺血区域缺乏侧支血管的病人,理论上可能因闭塞血管近心端的动脉扩张、闭塞血管区域缺血加重,从而疗效欠满意或使病情加重。

图3 治疗前后温差(E点和F点)变化Fig.3 Temperature difference (E point and F point) before and after treatment
SCS作为一种神经调控技术,在慢性疼痛中的作用已经被广泛认可[10],同时也作为一种安全有效的缺血性疾病替代治疗方法得到越来越多的重视。SCS能够恢复局部血流,改善病人的生活质量,减轻病人疼痛,阻止溃疡的进展,从而延缓截肢。
SCS在慢性顽固性疼痛中的应用是Shealy等首次报道的[11],其公认的机制之一是“闸门理论”,但也有许多研究证实SCS不仅能调控与疼痛相关的信号通路及神经递质平衡,还可影响炎症以及疼痛相关神经肽的产生,从而抑制或减轻疼痛[12]。
目前对SCS治疗缺血性疼痛确切的作用机制仍不十分清楚,主要作用是镇痛和扩张血管双重机制,目前研究推测的可能机制如下:①SCS可通过兴奋传递触觉的粗纤维(Aβ纤维)来抑制传递痛觉的细纤维(Aδ纤维和C纤维),达到抑制疼痛传递的目的,同时释放内源性阿片肽来缓解疼痛[13]。②抑制中枢交感神经活性,从而抑制交感性血管收缩。SCS激活中间神经元降低交感神经节前神经元活性来减少儿茶酚胺的释放,从而减少交感神经节后神经元的α1肾上腺能受体作用而导致外周血管扩张[14,15]。③SCS刺激可使细胞信号分子通路激活,如ERK(extracellular signal regulated kinase)和AKT (protein kinase B),敏化TRPV1 (transient receptor potential vanilloid 1)及其他关键通道,导致神经末梢释放血管舒张因子,如降钙素基因相关肽(calcitonin gene related peptide, CGRP),有强烈的微血管扩张作用。CGRP的释放引起内皮一氧化氮(nitric oxide, NO)释放,并刺激血管平滑肌细胞松弛。这些作用最终减少血管阻力和增加局部血流,并促进内皮保护和新的血管生成(见图4 )[5]。
大量国外研究已经证实了SCS对下肢缺血性疾病在疼痛缓解和改善血运方面的有效性[16,17]。本试验共纳入19例病人,17例病人测试后疼痛缓解大于50%,行IPG永久植入。经过6个月的随访观察,疼痛缓解情况和睡眠改善情况依然良好,没有截肢的病人。考虑与我们纳入标准的设定、术中电极放置的位置、测试过程中除病人的体验外,选择经皮氧分压上升大于10 mmHg作为植入IPG的标准等有关。而术中电极的固定,手术切口位置的选择是降低术后并发症及提高病人生活质量的关键。
国外的临床研究建议,术中SCS电极放置位置一般选择T10-12[16,18],Amann等将SCS电极置于T8-L1椎体水平[19]。临床中我们发现,由于脊柱在前屈和后伸的过程中最可能发生电极向下移位,为保证电极即使向下移位,原有疼痛区域仍有电流覆盖,本试验病人术中电极放置起始位置为T9-T10,根据电流覆盖情况调整电极位置,直至下位触点可完全覆盖原有疼痛区域后固定电极。考虑到血管性疾病的特点,为防止疾病进展而疼痛面积扩大,本试验中,无论病人疼痛部位为双侧还是单侧,均植入两根电极,目的是刺激能完全够覆盖双下肢,防止单电极植入疼痛进展后刺激覆盖不全面。
为防止由于病人体位变动产生的电极移位,应将电极牢固固定于椎体筋膜上,同时设计皮下的电极减张力环也是十分必要的,减张力环可减少病人体位变动时对硬膜外腔中电极的牵拉(见图5)。
为评估预后,应观察测试过程中疼痛缓解情况和经皮氧分压的改善情况[9]。测试后,疼痛较前缓解50%以上,止痛药用量减少,是行IPG植入的参考标准之一。TcPO2是通过在皮肤表面记录氧分压的数值来提供关于血管微循环氧供给和传递的情况,可以直接反应组织细胞的氧含量及早期判断组织灌注不良的存在,此技术应用于下肢血管疾病的诊断[20]。由于存在血管硬化,踝肱指数(ankle brachial index, ABI)可能存在假阴性[21],因此在评估组织灌注和足溃疡愈合方面,TcPO2比ABI更有价值。我们的研究表明,治疗前病人TcPO2为10~30 mmHg,测试后TcPO2上升> 10 mmHg的病人预后较好,是行IPG永久植入的标准。
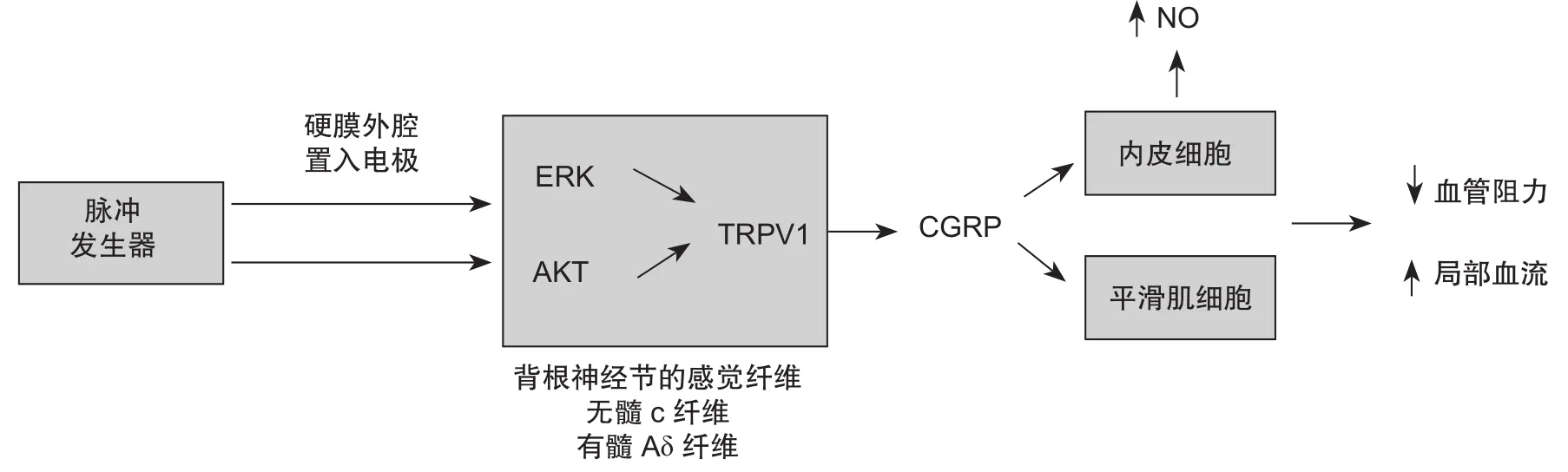
图4 SCS增加组织灌注机制(图片来源于Naoum JJ等)[5]Fig.4 Mechanism of SCS increasing tissue perfusion (pictures from Naoum JJ, etc.) [5]

图5 箭头示电极减张力环Fig.5 Arrow shows electrode tension-reducing ring
为了进一步提高病人的生活质量,IPG的放置位置应以不影响病人日常生活为宜,可放置于腹部脂肪较厚部位,但目前更多选择放置于臀部,具体定位方式上文已经阐述。
临床报道,SCS的主要并发症主要为电极移位、电极连接不良、电极损坏、局部疼痛、切口血肿和感染,其中以设备相关并发症为主,发生率达11%~36%,感染的发生率为3%~6.3%[9]。本试验中,主要并发症为电极移位,可能原因为硬膜外腔隙过大,植入初期电极在硬膜外腔存在轻微移位,为避免术后电极移位,所有病人植入两根电极,并卧床48 h。2例病人术后出现一过性疼痛加重,均为下肢存在破溃的病人,可能原因为下肢血运改善后一过性炎症反应加重。
本研究存在一定局限性:①样本量较小的非对照试验,由于SCS目前在国内费用较昂贵,且IPG等设备尚未纳入医保报销范围,尽管在临床中观察到理想的治疗效果,但由于经济原因尚未被病人广范接受;②由于采用电话的方式进行随访,未记录全部病人6个月内的经皮氧分压和皮肤破溃病人的溃疡愈合情况;③观察时间为6个月,由于下肢缺血性疾病病人生存期相对较长,期待进一步高质量大样本的对照研究尽快开展。
SCS可改善下肢缺血性疾病病人的疼痛,提高病人的睡眠和生活质量;改善下肢微循环,避免或延迟截肢;不良反应少,可安全有效的应用于临床。
