伊班膦酸钠对膝骨关节炎大鼠自噬相关蛋白LC3 II的影响*
2020-02-29周桂娟肖子建孙光华曾亚华钟培瑞王甜甜邓程远
周桂娟 周 君,2,3 肖子建 孙光华 伍 琦 曾亚华 刘 静 钟培瑞 成 果 王甜甜 邓程远 廖 瑛△
(1南华大学附属第一医院康复医学科,衡阳421001;2四川大学华西医院康复医学中心,成都610041;3康复医学四川省重点实验室,成都610041)
骨关节炎(osteoarthritis, OA) 是一种多因素导致的衰老相关性、慢性退行性关节病变,其特征是软骨细胞外基质的降解和软骨细胞的减少[1]。OA病人早期可反复出现关节疼痛、肿胀及活动障碍等,晚期严重者可出现关节畸形,直接影响病人的生活质量。随着全球人口老龄化加重,OA发病率呈上升趋势,但目前尚未发现有效治愈关节炎的靶向药物。Radin[2]等提出OA发病中软骨下骨的改变先于关节软骨退变,异常诱因或应力引起的骨转换和骨吸收异常可造成软骨下骨密度改变,继发性地引起软骨结构完整性的改变。因此,抑制软骨下骨的骨吸收可能成为拮抗OA发生发展的新的治疗思路。近年来的研究发现,一些骨吸收抑制剂对OA有一定的治疗作用,伊班膦酸钠就是其中之一,但其作用机制仍不明确,能否有效抑制OA进展尚存争议[3,4]。已有研究发现OA 的发生与软骨细胞自噬水平下降相关,在骨生长和骨重建中,自噬溶酶体对骨质的更新起着重要作用[5,6]。双磷酸盐类骨吸收抑制剂对OA软骨下骨的骨重建是否与自噬相关尚无报道。本实验结合OA的发病机制通过前交叉韧带切断术 (anterior cruciate ligament transaction, ACLT) 复制SD大鼠膝关节OA,观察关节软骨和软骨下骨组织结构的改变,初探伊班膦酸钠对OA 的治疗效果及机制,并从自噬的角度,为临床运用伊班膦酸钠治疗OA提供可靠的理论依据。
方 法
1.实验动物
健康3月龄SD雌性大鼠30只(南华大学实验动物中心提供),体重200~250 g,适应性饲养1周后大鼠初始平均体重为244.1±15.1 g,所有受试大鼠均置于室温20℃~24℃左右,自然光照的动物房中分笼饲养,饲料购自南华大学实验动物中心,实验期间不额外给予与实验无关的其他药物和食物。
2.主要试剂及仪器
主要试剂:伊班膦酸钠注射液(艾本)(规格1 mg:1 ml,中国河北医科大学生物医学工程中心);CTX-I、CTX-II ELISA试剂盒(中国广州皓跃生物科技有限公司);IL-1、IL-6 ELISA试剂盒(中国北京博奥森生物技术有限公司);兔抗大鼠β-actin单克隆抗体、HRP标记的山羊抗兔IgG抗体(美国Cell Signaling Technology);兔抗大鼠LC3 II多克隆抗体、兔抗大鼠MMP-13单克隆抗体(美国Santa Cruz公司)。
主要仪器:Micro-CT(ZKKS-CT型,中国广州中科恺盛医疗科技有限公司);奥林巴斯光学显微镜(BX53型,日本Olympus公司);酶标仪(Ascent型,美国Thermo Fisher Scientific)。其他均为实验室常备仪器。
3.实验分组、造模及干预
经适应性喂养1周后的30只SD雌性大鼠采用随机生成数字表分成3组:假手术组(Sham)、生理盐水治疗组(ACLT + NS)和伊班膦酸钠治疗组(ACLT + IB),每组10只,ACLT + NS组和 ACLT +IB组参照文献[7]采用切断大鼠的右侧前交叉韧带方法(ACLT术)建立膝关节炎大鼠模型。Sham组只切开右膝关节腔,不切断前交叉韧带,直接缝合膝关节,左侧膝关节未做手术。术后每只大鼠肌肉注射青霉素(40万单位),每日1次,连续3天预防感染。造模术后继续喂养1周后进行干预,ACLT +IB组大鼠腹腔注射伊班膦酸钠10 μg/kg,每周1次,连续12周;ACLT + NS组大鼠则给予等剂量生理盐水腹腔注射,每周1次,连续12周;Sham组不予以特殊处理。实验程序经南华大学附属第一医院伦理委员会审核批准符合《动物保护法》中华人民共和国(2001)。
4.标本的采集和处理
各组大鼠在干预12周时取材,处死前予10%水合氯醛(0.3 ml/100 g)麻醉,麻醉成功后使用有齿镊摘除大鼠眼球,留取内眦静脉血,血样离心后取上层血清于EP 管中,-80 ℃ 条件保存以待ELISA检测。随后予以颈椎脱臼法处死各组大鼠,马上在无菌条件下解剖暴露双后肢膝关节,分离胫腓骨,刮取右侧胫骨平台软骨及近端骨组织放入EP管(装有2.5 ml EDTA),-80 ℃ 条件保存以待Western blotting检测。取左侧胫骨近端骨组织约1 cm,尽可能清除关节表面其他组织,冲洗干净后常规脱钙、石蜡包埋切片,行番红染色进行关节软骨病理评估。继续取右侧胫骨近端骨组织约2 cm,置于4%多聚甲醛中固定,然后使用Micro-CT观察软骨下骨微结构,并对其进行定量分析。
5.观察指标及方法
(1)番红染色观察关节软骨形态学:常规石蜡切片脱蜡水化后用1%番红浸染2 min,镜下体积分数95%乙醇分化数秒,风干,二甲苯透明,中性树胶封片显微镜下观察。
(2)Mankin's评分系统评价关节软骨退变程度:Mankin's评分是目前学界公认的对OA软骨退变程度进行评价的通用标准。依据盲法原则,由高年资病理科医师2名采用修改后的Mankin's评分[8]对各组大鼠关节软骨组织的番红染色进行评价,分值从0~14分,主要从4个方面评分:软骨结构(0分:正常;1分:表面不规则;2分:血管翳形成和表面不规则;3分:裂隙进入过渡层;4分:裂隙进入辐射层;5分:裂隙进入钙化层;6分:结构完全破坏);软骨细胞(0分:正常;1分:弥漫性细胞增加;2分:局部细胞增加;3分:细胞数目明显减少);软骨基质染色(0分:正常;1分:轻度减少;2分:中度减少;3分:重度减少;4分:无着色);潮线完整性(0分:完整;1分:缺失)。得分越高者病变程度越重。若两者评分不一致,则共同讨论并达成共识。
(3)Micro-CT扫描观察关节软骨下骨形态学:取右侧胫骨近端骨组织置于4%多聚甲醛中固定后用Micro-CT进行扫描,参数设定:旋转角度220°,增量0.6°,分辨率45 μm,曝光时间3 000 ms,每层的间距为16 μm。扫描完成后分析所测标本的骨组织形态学参数,选择以下指标:相对骨体积 (bone volume fraction, BV/TV),即骨体积除以总体积;骨小梁数量(trabecular number, Tb.N),指感兴趣区域内骨组织与非骨组织的交点数量;骨小梁分离度(trabecular separation, Tb.Sp),指骨小梁间的平均宽度;骨小梁厚度 (trabecular thickness, Tb.Th),指骨小梁的平均厚度。最后,应用骨形态分析软件 Advanced Bone Analysis对定义框内的骨质行骨小梁相对骨体积、骨小梁数量、骨小梁分离度及骨小梁厚度检测,重复3次。
(4)ELSIA检测血清中CTX-I、CTX-II、IL-1及IL-6含量:从-80 ℃冰柜中取出处理好的各组大鼠血清,严格按各试剂盒说明书采用 ELISA 法测试血清中CTX-I、CTX-II、IL-1及IL-6含量:包被、封闭、洗涤、孵育,在反应终止后用酶标仪在450nm波长测量各孔的吸光度。
(5)Western blotting检测软骨及软骨下骨MMP-13及LC3 II蛋白表达:将收集的软骨及软骨下骨标本提取细胞总蛋白。各组取总蛋白进行电泳后,转移到PVDF膜上,用含50 g/L脱脂奶粉的TBST室温下封闭1 h,之后分别加入兔抗大鼠MMP-13单克隆抗体、兔抗大鼠LC3 II多克隆抗体、兔抗大鼠β-actin单克隆抗体(工作浓度分别为1:1 000、1:500、1:5 000),室温摇床摇1 h后4 ℃孵育过夜。次日再次常温摇1 h后洗膜,再加入HRP标记的山羊抗兔IgG抗体(工作浓度1:5 000),室温孵育1 h后用超敏ECL化学发光试剂盒显色,于暗室内压片,显影定影。所得条带运用Image J图像分析软件分析。
6.统计学分析
利用SPSS 13.0软件进行统计学分析,所有试验数据均重复3次,所得数据均为定量资料,以均数±标准差()表示。多组间比较采用单因素方差分析(one-way ANOVA) ,组间两两均数比较采用LSD-t检验,以P< 0.05为差异有统计学意义。
结 果
1.伊班膦酸钠对关节软骨组织的形态学及Mankin's评分的影响
Sham组软骨表面光滑,细胞分布均匀,无裂隙,染色正常;ACLT + NS组软骨变薄,表面粗糙,有裂隙形成,细胞密度不均,数目减少,潮线模糊;ACLT + IB组软骨组织分层无明显破坏,表面略不平整,细胞稍增多,潮线基本完整(见图1)。Mankin评分(各组n= 10):ACLT + NS组评分结果(8.1±1.7)明显高于Sham组(0.6±0.7),差异有统计学差异(P< 0.001),表明本实验OA动物模型建立成功。ACLT + IB组评分结果(3.1±1.2)明显低于ACLT + NS组,差异有统计学意义(P<0.001),提示伊班膦酸钠治疗有效。
2.伊班膦酸钠对软骨下骨组织形态学的影响
Micro-CT扫描大鼠右侧胫骨后可见ACLT + NS组软骨下骨骨小梁排列紊乱,出现硬化表现,局部呈现断裂现象,边缘处可见骨赘形成。ACLT + IB组软骨下骨小梁排列较ACLT + NS组整齐,断裂现象较少见 (见图2)。分析各组胫骨平台骨组织形态学参数见表1,三组相对骨体积(BV/TV)、骨小梁数量(Tb.N)、骨小梁分离度(Tb.Sp)、骨小梁厚度(Tb.Th)比较,组间差异均有显著性意义(P< 0.001);ACLT + NS组的BV/TV、Tb.N、Tb.Th显著低于Sham组(P< 0.001),而Tb.Sp则明显高于Sham组(P< 0.001);ACLT + IB组BV/TV、Tb.N、Tb.Th等均明显高于ACLT + NS组(P< 0.001),Tb.Sp则显著低于ACLT + NS (P< 0.001);ACLT + IB组与Sham组比较,各参数差异均无显著性差异。
3.伊班膦酸钠对大鼠血清CTX-I、CTX-II、IL-1及IL-6含量的影响
ELISA检测结果显示,ACLT + NS组血清CTX-I、CTX-II、IL-1、IL-6浓 度 高 于 Sham 组(P< 0.05),与ACLT + NS组相比,ACLT + IB组血清CTX-I、CTX-II、IL-1、IL-6水平降低,差异有统计学差异(P< 0.05),ACLT + IB组与Sham组比较,血清CTX-I、CTX-II、IL-1、IL-6水平无统计学差异(见图3)。
4.伊班膦酸钠对大鼠软骨及软骨下骨MMP-13和LC3 II蛋白表达水平的影响
Western blot结果显示,与Sham组相比,ACLT + NS组MMP-13蛋白表达增高,LC3 II蛋白表达下降,差异均有统计学意义(P< 0.01),ACLT + IB组MMP-13蛋白表达低于ACLT + NS组,而LC3 II蛋白表达则高于ACLT + NS组,差异均有统计学意义(P< 0.01,见图4)。
讨 论
Loeser[9]研究认为OA是膝关节整个器官的疾病,而非单纯的软骨退行性疾病,疾病过程中关节软骨下骨、半月板、滑膜和韧带等其他相关组织也会发生改变[10,11]。生物学和机械力学因素共同作用于关节内的关节软骨、软骨下骨等各组分,使其遭受不同程度损害并释放各种细胞因子、炎性介质[12]和细胞活素类物质等[13],如白介素、肿瘤坏死因子及基质金属蛋白酶等,这些物质相互作用并最终引起关节软骨破坏和软骨下骨结构异常[6]。本实验中采用ACLT导致关节受力发生变化,造成关节的退行性改变,从而导致骨关节炎的发生[7]。
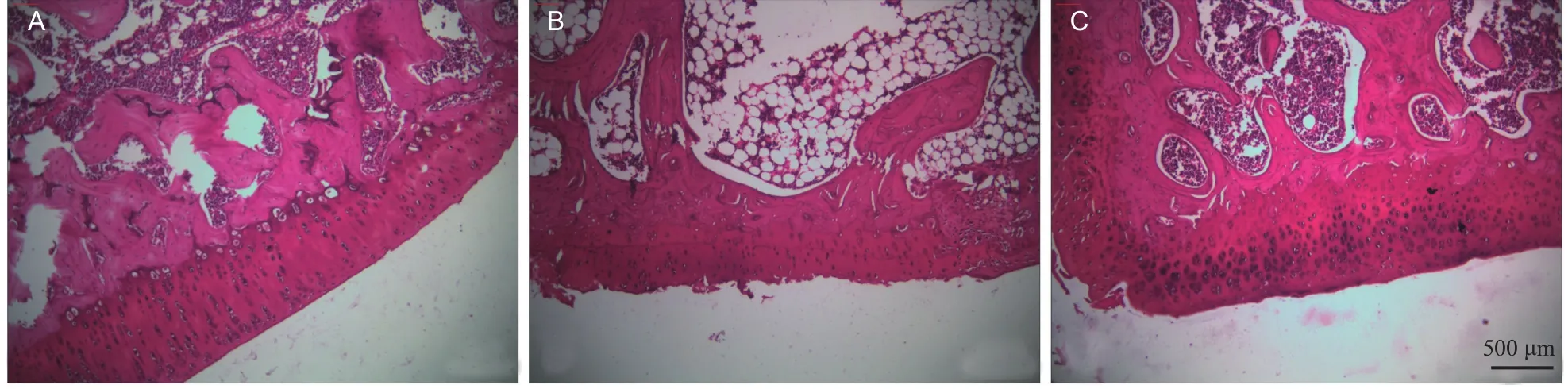
图1 不同组大鼠软骨组织番红染色:(A) Sham组;(B) ACLT + NS组;(C) ACLT + IB组 标尺= 500 μmFig.1 Safranin staining of articular cartilage in rats (A) Sham group; (B) ACLT + NS group; (C) ACLT + IB group Scale bar = 500 μm

图2 不同组大鼠胫骨近端Micro-CT扫描图像Fig.2 Micro-CT scan of proximal tibia in rats
表1 不同组大鼠胫骨平台软骨下骨组织形态计量学参数 (n = 10,)Table 1 The index of bone histomorphometry in Subchondral bone of tibial plateau of rats in different groups (n = 10,)

表1 不同组大鼠胫骨平台软骨下骨组织形态计量学参数 (n = 10,)Table 1 The index of bone histomorphometry in Subchondral bone of tibial plateau of rats in different groups (n = 10,)
***P < 0.001,与Sham组相比;###P < 0.001,与ACLT + NS组相比;***P < 0.001, compared with group sham; ###P < 0.001, compared with group ACLT + NS.
组别Group Sham ACLT + NS ACLT + IB BV/TV (%) 42.48±4.04 30.22±3.05*** 41.37±2.43###Tb.N (L/mm) 5.22±0.33 3.18±0.36*** 5.34±0.34###Tb.Sp (μm) 105.56±11.33 259.79±18.79*** 107.53±8.23###Tb.Th (μm) 90.14±1.45 73.64±2.09*** 90.34±1.61###

图3 各组大鼠血清CTX-I (A)、CTX-II (B)、IL-1(C)及IL-6 (D)浓度 (n = 10,)Fig.3 Concentration of serum CTX-I (A), CTX-II (B), IL-1 (C), and IL-6 (D) in different groups (n = 10,)

图4 各组大鼠软骨及软骨下骨MMP-13和LC3 II蛋白表达水平 (n = 10,)Fig.4 The expression of MMP-13 and LC3 II in cartilage and subchondral bone of rats (n = 10,)
常用的OA判定方法有病理学诊断、影像学检查及生物标志物检测等。本研究采用番红染色观察软骨组织,发现ACLT + NS组(模型组)软骨组织呈OA病理改变,如表面粗糙,有裂隙形成,细胞减少,潮线不完整等,Mankin's评分明显高于Sham组(假手术组)。采用Micro-CT扫描观察软骨下骨组织形态学,可观察到模型组软骨下骨骨质疏松。生物标志物的方法常用于OA实验研究,如检测大鼠血清中炎性因子、CTX-II、CTX-I等[14,15],其中血清及尿液中CTX-II含量与软骨退化程度成正相关[16]。相比于影像学检查和病理学诊断,检测血液或尿液中CTX-II含量可能是更方便的检测OA或动态监测OA变化的方法。本研究检测了大鼠血清中CTX-I、CTX-II的水平,结果发现ACLT + NS组血清CTX-II、CTX-I浓度显著高于Sham组。因此,结合病理学、影像学及血清学结果,本研究显示通过ACLT手术的大鼠可以发生OA,提示造模成功。
在OA的动物模型研究中发现,软骨下骨骨重建失常是骨关节炎的重要病理变化[17],软骨下骨的改变先于关节软骨退变[2]。在OA发病早期,软骨下骨骨重建以骨吸收为主[17],局部骨质疏松形成,病程后期软骨下骨骨重建以骨形成为主,最终出现软骨下骨硬化、骨赘形成[18],最终继发性地引起关节软骨进行性变性和消失、滑膜慢性炎症及反应性增生等[19]。双膦酸盐类药物具有抑制骨吸收的作用,目前临床上主要用于治疗骨质疏松,可直接抑制破骨细胞的作用,并使成骨细胞释放抑制破骨细胞活化和形成的因子,从而阻断破骨细胞的骨吸收作用。本实验中采用骨吸收抑制剂伊班膦酸钠干预OA大鼠,采用病理学评分、显微CT评价及生物标志物等方法观察其是否可治疗或改善OA。伊班膦酸钠干预后番红染色可观察到软骨组织形态改善,Mankin's评分降低;Micro-CT扫描观察软骨下骨,BV/TV、Tb.N、Tb.Th显著增高,Tb.Sp显著降低,骨小梁微观结构改善;血清学检查CTX-II、CTX-I浓度显著降低,提示伊班膦酸钠改善了OA大鼠关节软骨退变及软骨下骨结构。
骨的代谢速度和一些细胞因子的含量高低有一定关联性,基质金属蛋白酶MMP-13 能不可逆地降解 II型胶原,促使软骨细胞外基质降解,从而造成关节软骨的破坏[20]。在体外实验中发现包括伊班膦酸钠在内的多种双磷酸盐类药物都能抑制MMPs的作用[21]。MMP-13与其他细胞因子如IL-1、IL-6等相互作用,最终引起软骨下骨结构异常和关节软骨破坏。评估软骨的退行性病变的程度,可以通过分析这类细胞活素类物质和细胞因子的表达来进行,同时这些物质还可以为OA疾病的预后提供依据。本实验中OA组(ACLT + NS组)的IL-1和IL-6浓度均明显高于假手术组,软骨组织MMP-13蛋白的表达也明显增高。伊班膦酸钠干预大鼠的IL-1和IL-6浓度低于OA组,MMP-13蛋白表达较OA组明显下调,提示伊班膦酸钠可能通过抑制OA大鼠细胞炎性因子分泌及MMP-13蛋白表达。
关节软骨退变是OA发病机制的中心环节,继发于软骨下骨的骨重建[22],随后细胞外基质的降解和增生不良引起软骨退化[23]。已有研究发现OA 的发生与软骨细胞自噬水平下降相关,在骨生长和骨重建中,自噬溶酶体对骨质的更新起着重要作用[5,6]。破骨细胞的溶酶体酶能释放到细胞外,分解和消除陈旧的骨基质,这是骨质更新的一个重要步骤。自噬形成时,自噬体膜上LC3 I转化为活化形式LC3 II,成为密闭自噬体。因此,LC3 II/LC3 I比值增高可作为自噬体形成的标志,自噬相关蛋白LC3 II的表达水平与自噬体的形成密切相关。本实验中OA大鼠自噬相关蛋白LC3 II表达下降,而伊班膦酸钠干预后,大鼠LC3 II表达增高,提示伊班膦酸钠改善OA大鼠软骨及软骨下骨可能与增强自噬相关蛋白LC3 II有关。但本实验仅为观察性研究,未涉及到自噬体、自噬溶酶体等直观显示细胞自噬的检测及研究,对自噬与软骨相关性的研究尚处于初级阶段,对伊班膦酸钠与自噬途径在软骨中作用机制、信号转导等方面的认识还不够全面,有待进一步研究。
综上所述,ACLT大鼠膝关节发生典型OA致软骨退变的同时,也伴有软骨下骨骨量的减少和微观结构的改变。伊班膦酸钠不仅可以抑制关节软骨基质降解、减少炎症反应、减缓关节软骨退变,还可以减轻软骨下骨骨质疏松、改善软骨下骨小梁微观结构,自噬相关蛋白LC3 II的表达增高。伊班膦酸钠对软骨及软骨下骨的保护作用可能与其增强自噬相关蛋白LC3 II有关,可有效抑制OA的进展,是否通过增强软骨细胞自噬发挥保护作用尚需进一步实验验证。
