肿瘤免疫治疗PD-1/PD-L1靶向核素分子探针的研究进展
2020-02-28王淑静徐晓霞周欣刘特立李囡朱华杨志
王淑静,徐晓霞,周欣,刘特立,李囡,朱华,杨志
0 引言
近年来,在肿瘤治疗方面,免疫治疗表现出令人瞩目的疗效。程序性细胞死亡蛋白-1(programmed death protein 1,PD-1)及其配体PD-L1是目前临床应用最广泛的免疫抑制剂。多项临床试验发现,抗PD-1或抗PD-L1单克隆抗体可以通过与PD-1或PD-L1结合,阻断PD-1与PD-L1之间的结合增强机体抗肿瘤的免疫能力,在多种难治性、复发性肿瘤患者中取得了超预期的疗效[1]。因此,美国食品与药品监督管理局(Food and Drug Administration,FDA)通过快速审批通道迅速批准了抗PD-1单抗Pembrolizumab(2014年)、Nivolumab(2014年)及抗PD-L1单抗Atezolizumab(2016年)、Durvalumab(2017年)、Avelumab(2017年)等,均已成为多种肿瘤的标准治疗。但临床试验结果表明只有部分肿瘤患者可以受益于这种治疗,如一项Nivolumab单药治疗非小细胞肺癌的临床试验中,仅20%的患者获得客观缓解[2],而且治疗费昂贵,对患者造成沉重的经济负担[3]。所以,探索一种可以准确预测患者免疫治疗疗效的方法十分重要。
目前最常用的预测患者免疫治疗疗效的方法是通过免疫组织化学(immunohistochemistry,IHC)检测肿瘤的PD-L1表达水平及肿瘤浸润T细胞的PD-1表达水平,已有临床试验结果表明IHC检测结果与患者的治疗反应相关[4-5]。但有研究发现该方法并不能十分精准地预测患者疗效,PD-L1阴性患者中仍有15%可以获益[6],而且它属于有创性检查,难以实现在治疗过程中对PD-1/PD-L1表达水平进行动态监测。
核医学分子影像使用放射性核素标记探针进行SPECT/PET显像,可以在治疗过程中重复、定量检测肿瘤原发灶及转移灶的PD-1/PD-L1表达水平的变化,有望成为一种更精准的筛选免疫治疗受益患者的检查方法。本文将对目前关于PD-1/PD-L1靶向核素探针显像的临床前及临床研究进行总结,主要包括核素标记完整抗体显像、核素标记单域抗体显像及核素标记低分子量探针显像。
1 PD-1/L1免疫治疗筛选获益患者的困境
一项首个国产抗PD-1单克隆抗体特瑞普利单抗(JS001)治疗黑色素瘤、尿路上皮癌、肾细胞癌的Ⅰ期临床试验中,PD-L1阳性患者中的客观缓解率明显高于PD-L1阴性患者(43.8%vs.0)[7]。但仍有大多数的PD-L1阳性患者对治疗并没有响应,这可能与肿瘤病灶内PD-L1表达的异质性有关,依靠穿刺活检进行的IHC无法避免这一因素的影响。此外,肿瘤细胞PD-L1表达在病程中因各种治疗发生变化,也是导致预测结果不准确的原因之一,为减少此因素的影响而进行的重复穿刺活检将给患者带来更多的有创性检查的风险。有研究用PD-L1抗体22C3、28-8、SP263、SP142对38例非小细胞肺癌(Non-small cell lung cancer,NSCLC)患者进行IHC检测,50%的患者在四种抗体的检测结果中被判定为阳性,13%的患者判定为阴性,37%的患者则在四种抗体的cut-off值上下变化[8]。因此,目前IHC检测的抗体以及评判阳性的标准不统一,也会导致PD-L1表达的IHC检测结果不准确[9],进而造成其预测患者治疗反应的不准确。
肿瘤突变负荷(Tumor mutational burden,TMD)是目前多个研究使用的另一个预测疗效的标志物。徐瑞华教授团队进行的一项特瑞普利单抗单药用于标准治疗失败的晚期胃癌的研究发现,TMD高患者的客观缓解率(33.3%vs.7.1%,P=0.017)及总生存期(14.6月vs.4.0月,P=0.038)均明显高于TMD低患者[10]。但TMD面临着与IHC一样不能精准预测的问题,尚需更多的研究探索。同时TMB检测方法复杂,价格昂贵。
MMR(mismatch repair)基因是指基因组中负责修复DNA错配的基因。如果MMR基因有缺陷则称为dMMR(deficient mismatch repair),反之,则称为pMMR(proficient mismatch repair)。如果存在dMMR,微卫星复制过程中会产生高度微卫星不稳定性(MSI-H)。具有dMMR或MSI-H的患者将更能从免疫治疗中获益。Pembrolizumab单药治疗的Ⅱ期临床试验中,dMMR结直肠癌组的客观缓解率(40%vs.0)及免疫相关无进展生存率(78%vs.11%)均明显高于pMMR结直肠癌组[11]。
目前虽然有一些研究报道其他标志物用来预测疗效,如HLA基因多样性、DNA甲基化等[12-13],但仍需进一步研究。
2 PD-1/L1靶向核素探针免疫显像
PD-1/L1靶向核素探针免疫显像可以减少穿刺等有创性的检查,避免肿瘤异质性的影响,提供原发灶、转移灶以及全身PD-1/PD-L1表达情况,为PD-1/L1免疫治疗的患者提供一种更加准确的筛选方法。同时,核医学分子影像可以在治疗过程中多次监测,有望在治疗过程中实时监测PD-1/PD-L1的表达变化,为及时调整免疫治疗方案提供更多影像学依据。
2.1 PD-1/PD-L1靶向核素探针显像原理
核医学分子影像以体内特定的分子作为核素探针成像的靶点,能无创地通过影像反应靶点分子在人体内的表达情况[14]。PD-1/PD-L1靶向核素探针显像使用放射性单光子或正电子核素标记抗PD-1/PD-L1单抗或小分子,经静脉注射,与体内PD-1/L1受体靶向结合,然后进行核医学SPECT或PET显像,对患者体内组织的放射性摄取进行测量,从而实现PD-1/L1受体表达情况的定量检测。
根据靶向分子的特征,放射性核素可直接或者通过螯合剂对其进行标记,常用的放射性核素主要包括放射性卤素及放射性金属元素。最常用的放射性卤素是124I,主要通过直接亲电取代酪氨酸残基的方式对靶向分子进行标记。但若靶向分子发生细胞内分解出现脱卤,124I将从靶向组织中清除导致信号降低,并会导致甲状腺组织中124I聚集。放射性金属元素如68Ga、64Cu、89Zr等需要通过双功能螯合剂如DOTA、NOTA、DFO等对抗体分子进行标记。双功能螯合剂先与抗体分子的非活性部位共价连接,然后与放射性金属元素形成稳定复合物,是目前PD-1/PD-L1靶向核素探针最常用的标记方法。
2.2 核素标记单克隆抗体显像
目前已有大量临床前研究采用核素标记单抗进行显像,以评估鼠荷人类肿瘤的PD-L1表达水平,见表1。由于单抗较长的生物半衰期,主要使用111In(67.3 h)、64Cu(12.7 h)、89Zr(78.4 h)等(中)长半衰期核素进行标记。
2.2.1 核素标记抗PD-L1单克隆抗体显像 2015年Heskamp等第一次使用111In标记特异性抗人PD-L1的鼠源性单克隆IgG1抗体PD-L1.3.1进行活体SPECT/CT成像,为PD-L1靶向的核素探针显像研究奠定了基础[15]。随后,Chatterjee团队发现,111In-Atezolizumab SPECT/CT显像和64Cu-Atezolizumab PET/CT显像可以检测出荷人肿瘤小鼠模型中PD-L1的表达[16-17]。另一项研究发现PD-L1靶向探针同样可以检测PDX模型中PD-L1的表达[18]。
上述几项研究均使用免疫缺陷小鼠,未观察到淋巴系统对探针的摄取。2016年Josefsson等[19]使用111In标记PD-L1抗体进行免疫功能正常小鼠SPECT成像,观察到脾、胸腺高摄取。Hettich等[20]使用64Cu-NOTA标记PD-1/L1抗体进行免疫功能正常小鼠PET/CT显像,在淋巴结中发现PD-1及PD-L1,同时该研究发现经γ干扰素治疗,肺是PD-L1表达上调最明显的器官,所以抗肺的T细胞反应被PD免疫抑制点强烈抑制,提示肺癌患者的PD-L1治疗是激活无效的细胞毒性淋巴细胞(Cytotoxic T lymphocyte,CTL)的一个重要手段,同时,这也可能是PD-L1免疫治疗经常出现肺炎、流感样疾病、结节病等不良反应的原因。不良反应重症肌无力则可能与胸腺摄取PD-L1抗体有关[21]。

表1 核素标记抗PD-L1完整单克隆抗体显像Table 1 Imaging of radionuclide-labeled complete anti-PD-L1 monoclonal antibody
多项研究显示PD-L1靶向探针可检测到治疗引起的PD-L1表达的变化[18,20-22],如放疗、紫杉醇治疗上调PD-L1表达,阿霉素治疗下调PD-L1表达。2019年Ehlerding等进行荷瘤小鼠89Zr-Atezolizumab PET显像发现,PD-L1+的H460肿瘤经放疗24 h后PD-L1表达上调,放射性摄取增高,PD-L1+的脾、淋巴结的PD-L1表达同样上调,与IHC结果一致[23]。
2.2.2 核素标记抗PD-1单克隆抗体显像 2015年Natarajan等进行PD-1抗体探针活体PET显像,发现肿瘤及淋巴器官高摄取[24],说明PD-1靶向探针有潜力用于PD-1表达水平的检测[25]。随后,多项核素标记完整抗PD-1单抗的显像研究被报道,见表2。
核素标记完整单抗的优势是与PD-1/PD-L1结合的亲和性强,制备简单。劣势是生物半衰期较长,需要使用长半衰期核素标记,显像所需时间长且肿瘤穿透性差。
2.3 核素标记单域抗体显像
KN035是目前全球首个进入临床开发的PD-L1单域抗体,已经被批准进行治疗晚期或转移性实体肿瘤的临床试验。KN035与完整单抗相比具有较低的分子量,因此具有相对较高的肿瘤穿透性,并可在注射后更短时间内进行显像,同时保持良好的PD-L1亲和性。2018年Li等用89Zr-Df-KN035对荷人胶质瘤小鼠进行PET显像发现肿瘤高摄取,与IHC检测结果一致[31]。89Zr-Df-KN035在食蟹猴中显像显示,在肝、脾、肾的摄取较高,在唾液腺、淋巴组织出现较早且相对稳定,肌肉、脑摄取低。该研究发现89Zr-Df-KN035具有标记快速、稳定的高亲和性及肿瘤快速高摄取并可长时间滞留等多种优势,但同时也具有很大的局限性即没有良好的肿瘤血池比,注射后120 h仍仅为(1.10±0.12)。
2.4 核素标记低分子量探针显像
低分子量探针优点是肿瘤穿透性更强,可被肿瘤快速摄取,从血液、背景组织中快速清除,实现注射当天显像;缺点是制备较复杂,稳定性较差。主要包括抗体片段、纳米抗体(Nanobodies,Nbs)、Adectin、多肽等,见表3。
2.4.1 抗体片段 2015年Maute等合成了PD-1的一个可溶性膜外区片段HAC-PD-1,可以与PD-L1高亲和性结合[32]。在种植有PD-L1阴性及阳性肿瘤的小鼠体内注射荧光标记的PD-L1抗体与HACPD-1后发现,在PD-L1阴性的肿瘤中PD-L1抗体及HAC-PD-1均未出现。而在PD-L1阳性的肿瘤中,PD-L1抗体主要分布在肿瘤边缘及血管周围,HAC-PD-1则在肿瘤内广泛分布。64Cu-HAC-PD-1 PET显像发现PD-L1阳性肿瘤高摄取,PD-L1阴性肿瘤无摄取。
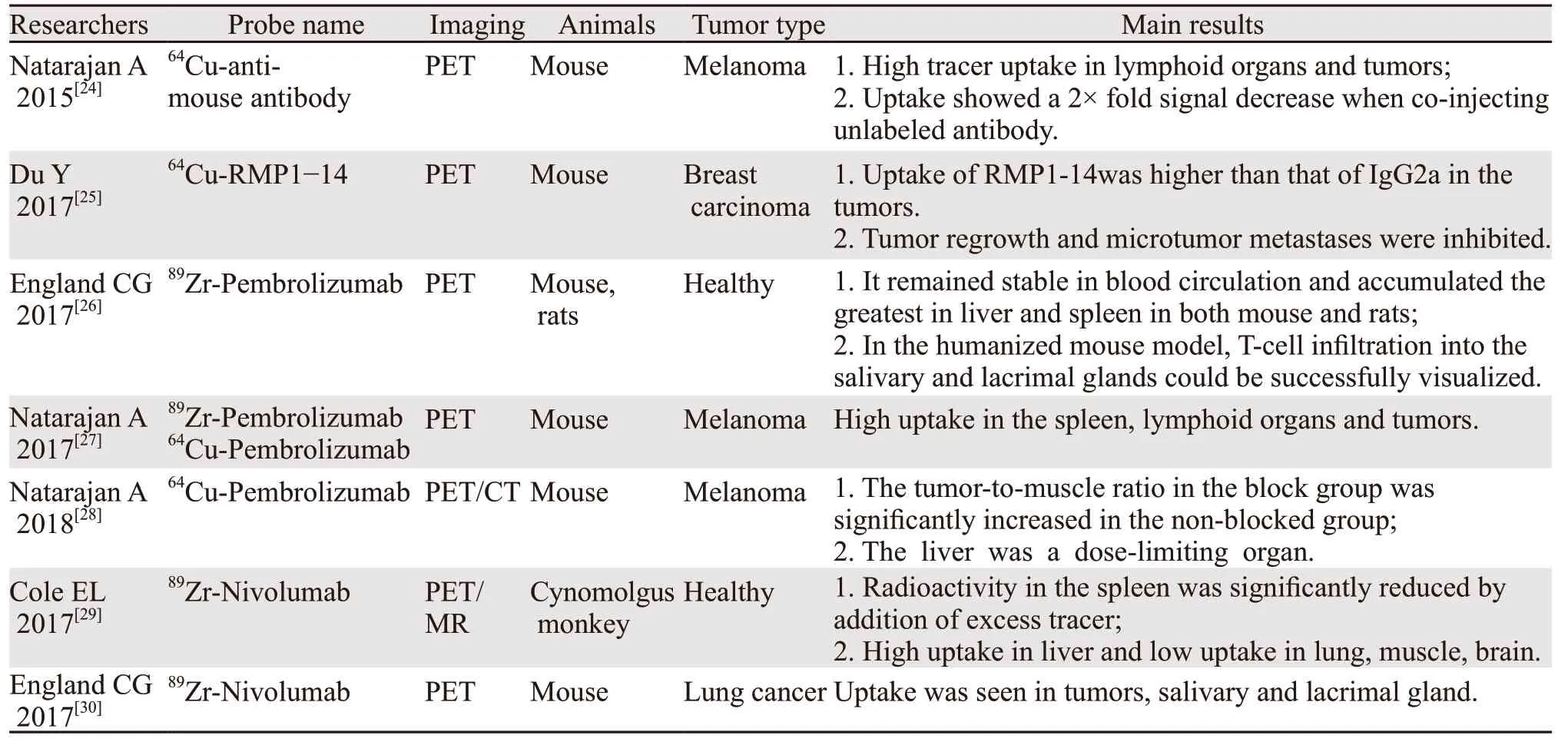
表2 核素标记抗PD-1完整单克隆抗体显像Table 2 Imaging of radionuclide-labeled complete anti-PD-1 monoclonal antibody
2.4.2 纳米抗体 2017年Broos等使用99mTc标记Nbs C3、E2进行TC-1肿瘤小鼠SPECT/CT显像发现,可以检测PD-L1不同表达水平,图像的信号强度与PD-L1的表达水平相关,且C3可以发现很小的差异[33]。Nbs在肾脏及膀胱中聚集,在其他器官与已报道的PD-L1抗体相似。但该Nbs不与人PD-L1结合,需要寻找可以与人PD-L1结合的Nbs进行临床转化。
2.4.3 Adnectin Adnectin是一个基于人纤连蛋白Ⅲ型第10个结构域合成的靶向蛋白家族。BMS-986192是一种可与人PD-L1受体高亲和性结合的Adnectin。2017年Donnelly等[34]使用18FBMS-986192对荷瘤小鼠进行PET显像,显示PD-L1阳性的HT-29肿瘤摄取显著高于阴性的L2987肿瘤,且具有很高的肿瘤肌肉比。
2.4.4 多肽成像 WL12是由12个氨基酸构成的环形肽,可以与PD-L1高亲和性结合。2017年Chatterjee等用64Cu-WL12对荷瘤小鼠进行PET成像,显示hPD-L1肿瘤摄取显著高于CHO肿瘤[17]。2018年De Silva等对多种肿瘤模型小鼠进行68Ga-WL12 PET/CT显像,结果均提示PD-L1高表达的肿瘤摄取高于低表达的肿瘤[35]。
2.5 临床转化研究
目前,已有三种PD-1/PD-L1靶向探针成功应用于临床转化研究。2018年Bensch等[36]用89Zr-Atezolizumab对即将接受Atezolizumab治疗的22例晚期膀胱癌、NSCLC、三阴性乳腺癌患者进行PET/CT显像。肿瘤原发灶及转移灶均对探针高摄取,但不均质,在不同患者、同一患者的不同病灶及不同类型的肿瘤之间均有差异。89Zr-Atezolizumab的几何平均SUVmax可用来有效分区客观缓解患者与病情稳定或病情进展患者(AUC 0.83),完全缓解患者SUVmax比发生进展的患者高235%(P=0.00021)。患者的几何平均SUVmax与PFS、OS高度相关,在中位数以下的患者更易发生进展或死亡。89Zr-Atezolizumab的SUVmax同样与病灶在治疗前后的变化相关,SUVmax越大,病灶缩小越多。而该研究使用SP142、SP163两种IHC抗体检测肿瘤病灶的PD-L1表达水平,结果与肿瘤病灶的治疗反应、肿瘤大小的变化、PFS及OS均无相关性。该研究结果表明89Zr-Atezolizumab PET/CT有潜力成为预测Atezolizumab治疗反应的一种更有效的检查方法。
2018年Niemeijer等[37]用18F-BMS-986192、89Zr-Nivolumab对13例即将接受Nivolumab治疗的晚期NCSLC患者进行PET/CT双探针对比显像,并使用IHC方法检测肿瘤的PD-L1、PD-1表达水平,结果发现,PD-L1≥50%的肿瘤对18F-BMS-986192摄取明显高于PD-L1<50%的肿瘤(Median SUVpeak:8.2vs.2.9,P=0.018),PD-1阳性的肿瘤对89Zr-Nivolumab摄取同样明显高于PD-1阴性的肿瘤(Median SUVpeak:7.0vs.2.7,P=0.03)。5例获得客观缓解的患者肿瘤摄取18F-BMS-986192(Median SUVpeak:6.5vs.3.2,P=0.03)及摄取89Zr-nivolumab(Median SUVpeak:6.4vs.3.9,P=0.019)明显高于8例未获得客观缓解的患者。表明PET分子显像将有潜力成为评估患者PD-1/L1状态及预测免疫治疗反应的重要手段。但此结论尚需要更大的样本量进行验证。
3 结语
肿瘤免疫治疗通过靶向单抗与体内受体特异性结合激活自身免疫系统的肿瘤杀伤能力,已成为肿瘤传统治疗外的一个重要的治疗方法。其中PD-1/PD-L1免疫治疗表现尤为出色,已改变多种晚期肿瘤的治疗格局,但其有效率较低且治疗费用昂贵,无法普遍应用,而目前筛选获益患者的方法如IHC、TMD、dMMR等均不能对PD-1/PD-L1疗效进行精确预测,这仍是一个亟需解决的重要问题。PD-1/PD-L1靶向核素分子探针核医学显像,能无创地反应PD-1/PD-L1在人体内的表达情况,是解决这一问题的重要探索方向。其中,核素标记完整单抗分子探针具有良好的亲和性,制备简单,可以观察单抗在机体内的完整代谢过程,但由于分子量较大(约145 kDa)导致肿瘤穿透性差、生物半衰期较长、显像所需时间长(通常需要2~7天),这导致在临床应用中比较困难。单域抗体探针分子量相对完整单抗较小,具有较高的肿瘤穿透性,可以实现肿瘤快速高摄取并长时间滞留,同时仍具有稳定的高亲和性,但缺乏良好的肿瘤血池比,在注射后120 h仅为(1.10±0.12)。低分子量核素探针则由于较小的分子量具有更强的肿瘤穿透性,而且可实现注射当天进行显像,但低分子量核素探针的亲和力相比特异性单抗较弱。因此,在目前报道的PD-1/PD-L1靶向核素探针基础上,研发可与PD-1/PD-L1高亲和性特异性结合的低分子量核素探针,将是未来研究的重要方向。这将实现探针注射后短时间内对患者进行SPECT或PET显像的同时,对患者体内PD-1/PD-L1表达的高度特异性检测,将为肿瘤免疫治疗的临床应用提供更方便的影像学检查方法。
综上,PD-1/PD-L1靶向核素分子探针可以无创、重复检测全身包括肿瘤及其他组织中PD-1/PD-L1的表达水平,监测治疗过程中患者PD-L1表达的变化,有望成为筛选PD-1/PD-L1治疗获益患者的重要手段。但目前报道的临床研究尚少,仍需大量的临床研究验证该检查方法应用于临床的有效性。
