CXCL13激活Akt促进肺癌放疗抵抗
2020-02-28耿闪闪何翠陈春丽邓鑫州邱力柯青吴林段奇文施明亮骆志国
耿闪闪 ,何翠*,陈春丽,邓鑫州,邱力,柯青,吴林,段奇文,施明亮,骆志国
0 引言
肺癌是常见的恶性肿瘤之一,发病率和死亡率高居恶性肿瘤的首位,5年生存率仍不足20%[1-2]。放疗是肺癌治疗的主要手段之一[3],然而放疗抵抗是导致治疗失败的主要原因[4]。因此探寻肺癌放疗抵抗的新靶标及其潜在分子机制有着重要意义。
趋化因子是一类由炎性细胞和组织细胞产生并分泌、使细胞定向移动的小分子分泌蛋白。CXCL13又称B细胞趋化因子1(B cell lymphocyte chemoattractant,BLC1),是趋化因子CXC家族的一员,主要分布在胃、肝脏和淋巴结中[5]。CXCR5又称伯基特淋巴瘤受体1(Burkitt’s lymphoma receptor 1,BLR-1),是CXCL13的受体,参与循环中幼稚B淋巴细胞归巢及淋巴结发育构建等过程[6]。近年研究显示,CXCL13/CXCR5在肿瘤的发生发展中也发挥着重要作用。研究发现CXCL13/CXCR5通过激活Akt通路促进肾细胞癌进展[7],还可以通过激活JNK信号通路介导前列腺癌细胞增殖[8]。研究发现,趋化因子可影响癌细胞对放疗的敏感度[9-10]。目前,国内外尚未见CXCL13/CXCR5与肺癌放疗敏感度关系研究的报道。
本研究通过生物信息学手段和细胞学实验探讨CXCL13与肺癌放疗敏感度的关系及Akt在CXCL13介导的肺癌放疗抵抗中的作用,以期为临床解决肺癌放射抵抗问题提供新的作用靶标和实验依据。
1 材料与方法
1.1 主要试剂
DMEM培养基、胎牛血清购自美国Gibco公司;重组人CXCL13(货号250-24)购自美国PeproTech公司;Akt抑制剂LY294002(货号154447-36-6)购自美国Selleck公司。蛋白裂解液、蛋白提取试剂盒、BCA蛋白定量试剂盒、细胞凋亡检测试剂盒购自南通碧云天生物技术研究所;鼠抗人GAPDH抗体(货号ab8245)、鼠抗人Akt(货号ab8805)、鼠抗人p-Akt(ser473)(货号ab32370)抗体及山羊抗鼠HRP-标记二抗(货号ab6721)购自Abcam公司;ECL化学发光试剂盒购自美国Thermo公司;CCK-8试剂盒购自日本同仁公司。
1.2 实验方法
1.2.1 细胞培养 人肺腺癌H1975细胞株购自中国科学院上海细胞库,均用含10%胎牛血清的DMEM培养基、置于37℃含5%CO2的细胞培养箱中培养。
1.2.2 GEO公共数据库分析CXCL13和CXCR5在肺癌中的表达水平 在PubMed主界面(https://www.ncbi.nlm.nih.gov/pubmed/)搜索栏中找到GEO datasets选项,进入GEO数据库,在搜索框中输入检索关键词“ lung cancer”,筛选条件设置为“Homo sapiens”,找到有临床信息、正常组、肿瘤组及最大样本量的数据集GSE30219,下载series_matrix文件及平台文件GPL570,解析出每条探针对应的基因名。将样本归纳为正常组、肺腺癌组、肺鳞癌组、基底样细胞肺癌组、肺大细胞神经内分泌癌组和小细胞肺癌组,用GraphPad Prism 6.0软件进行统计分析。
1.2.3 Kaplan Meier-plotter公共数据库分析CXCL13和CXCR5表达水平与肺癌患者预后的关系 进入Kaplan Meier-plotter [Lung Cancer]栏目(网址http://kmplot.com/analysis/index.php?p=service&cancer=lung),输入基因名称后,在Survival窗口分别选择总生存期(OS)、无进展生存期(FP)和进展后生存期(PPS),在Radiotherapy窗口选择yes,点击Draw Kaplan Meier-plotter,获取生存曲线。
1.2.4 Western blot检测蛋白表达 用不同浓度的CXCL13或LY294002处理细胞为实验组,以DMSO处理细胞为阴性对照组。收集细胞(约1×106个),按照试剂盒说明书操作提取蛋白,BCA法进行蛋白定量。取20 μg总蛋白用10% SDS-PAGE胶电泳,转膜后用5%脱脂奶粉室温封闭2 h。一抗4℃孵育过夜,TBST漂洗5次×3 min,二抗室温孵育2 h,TBST漂洗5次×3 min,采用ECL化学发光试剂盒显影。以ImagePro Plus 6.0图像分析软件计算灰度值,将内参蛋白与目的蛋白两者灰度值的比值作为目的蛋白的表达量。
1.2.5 CCK-8实验检测细胞增殖 将细胞用CXCL13或LY294002处理为实验组,以DMSO处理细胞为阴性对照组,用8 Gy X线照射,收集细胞(约1×106个),以每孔3 000个细胞铺到96孔板中,培养24、48、72、96 h后分别向对应的细胞中加入CCK-8,将96孔培养板置于恒温箱孵育1 h,酶标仪检测450 nm处吸光值。
1.2.6 流式细胞术检测细胞凋亡 将细胞用CXCL13或LY294002处理,DMSO处理组作为阴性对照组,用8 Gy X线照射,收集细胞(约1×106个),预冷PBS洗3次。按照细胞凋亡检测试剂盒说明书操作,采用Annexin V/PI双染,流式细胞仪检测细胞凋亡。
1.2.7 细胞克隆形成实验 细胞经消化计数后,收集细胞铺到6孔板中,每孔500个细胞。每组3孔平行样本。用相应浓度的CXCL13和(或)LY294002预处理,并用0或8 Gy X线照射后,静置于37℃温箱中培养14天。14天后培养板中出现肉眼可见克隆时,终止培养,用PBS轻轻冲洗2~3遍,1%结晶紫染色20 min,除去染色液,纯水轻轻洗涤2~3遍,晾干,相机拍照留底,显微镜下计数克隆个数,≥50个细胞的细胞团作为一个克隆。
以上所有实验至少重复三次。
1.3 统计学方法
使用GraphPad Prism 6.0软件分析数据。数据结果以()表示,通过双侧Student’st检验及配对样本t检验进行计算分析,应用χ2检验和单因素方差分析进行组间比较。P<0.05为差异有统计学意义。
2 结果
2.1 CXCL13和CXCR5在肺癌组织中的表达
以GEO公共数据库临床资料较为全面的数据集GSE30219为分析对象,分析正常组织、肺腺癌组织、肺鳞癌组织、基底样细胞肺癌组织、肺大细胞神经内分泌癌组织和小细胞肺癌组织的CXCL13和CXCR5的表达(Log值)差异。结果发现CXCL13表达水平与肺癌临床分期密切相关(P=0.037),CXCL13和CXCR5表达水平与肺癌病理类型密切相关(PCXCL13=0.012,PCXCR5=0.001),二者表达水平与年龄和性别无显著相关性,见表1。肺腺癌组织、肺鳞癌组织、基底样细胞肺癌组织、肺大细胞神经内分泌癌和小细胞肺癌的CXCL13表达水平显著高于正常组织(P<0.001),见图1A。肺腺癌组织、肺鳞癌组织和基底样细胞肺癌组织的CXCR5表达水平显著高于正常组织(P<0.001),而肺大细胞神经内分泌癌和小细胞肺癌的CXCR5表达水平与正常组织相比差异无统计学意义(P>0.05),见图1B。上述结果提示CXCL13和CXCR5可能与肺癌的发生密切相关。
2.2 CXCL13高表达与肺癌放疗患者不良进展后生存期(post progression survival,PPS)密切相关
CXCL13的表达水平与肺癌的OS(HR=1.07,P=0.80)、PFS 无显著相关性(H R=0.67,P=0.15);CXCL13的高表达与肺癌的不良PPS密切相关(HR=1.87,P=0.04),分别见图2A、2C、2E。CXCR5的表达水平与肺癌的OS(HR=0.04,P=0.89)、PFS(HR=1.43,P=0.19)、PPS均无显著相关性(HR=1.16,P=0.61),分别见图2B、2D、2F。上述结果提示CXCL13的表达水平可能与肺癌进展后的放疗敏感度存在相关性。
2.3 CXCL13促进H1975细胞辐射抵抗
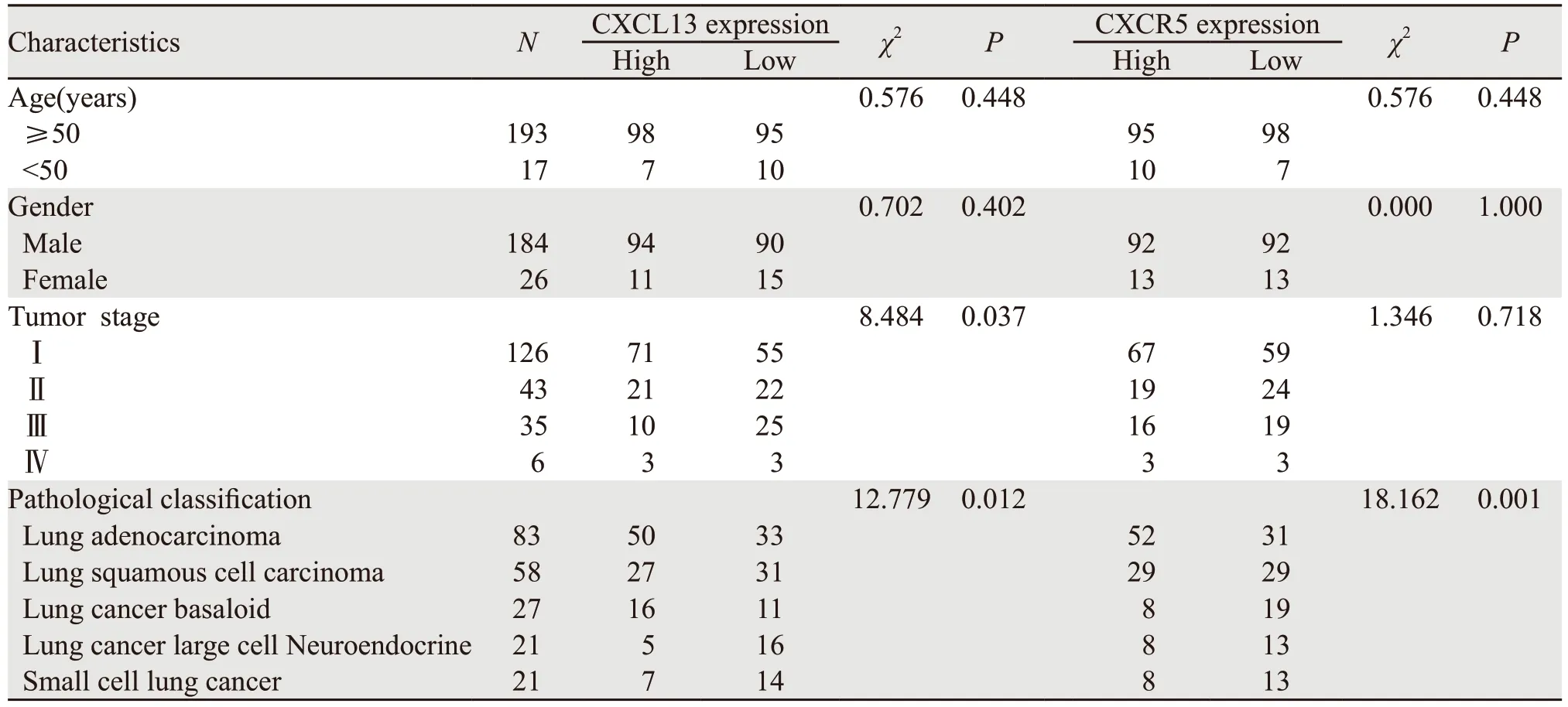
表1 CXC13和CXCR5表达和临床病理学参数的关系 (例)Table 1 Relation between CXC13/CXCR5 expression and clinicopathological characteristics of lung cancer patients (n)
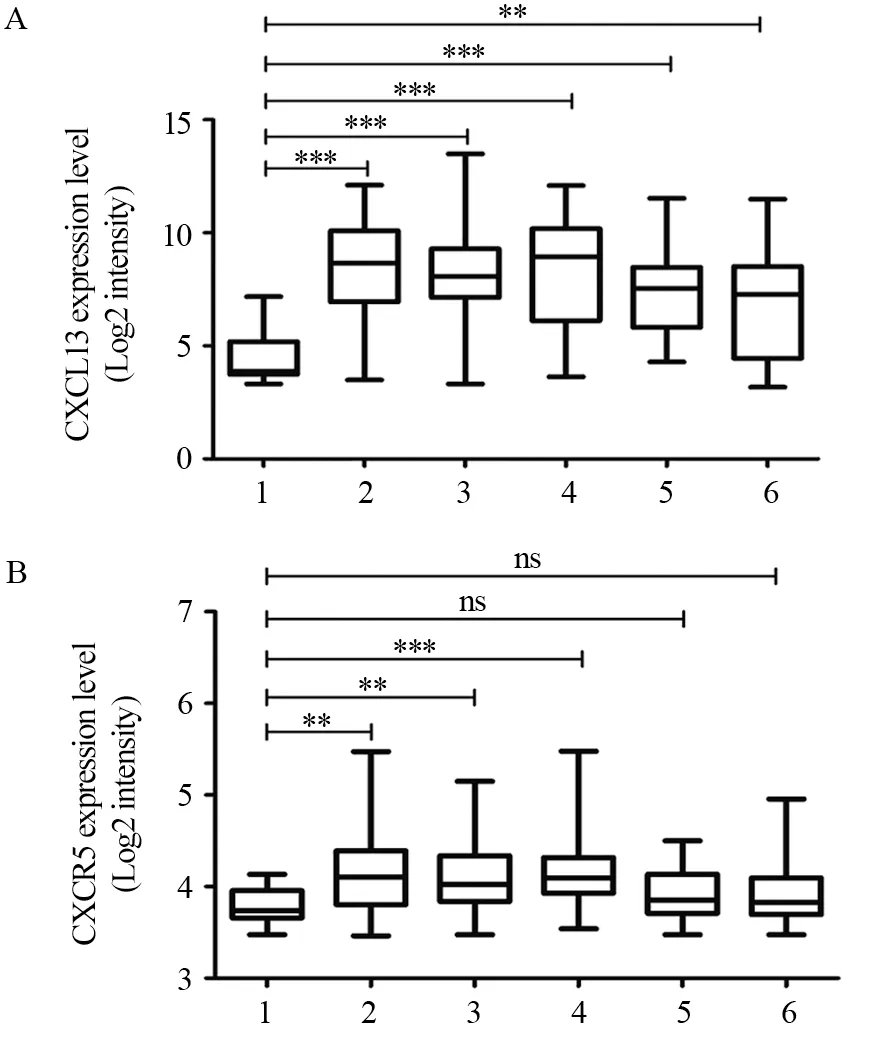
图1 利用GEO数据集GSE30219分析CXCL13(A)和CXCR5(B)在肺癌组织中的表达水平Figure 1 Expression levels of CXCL13(A) and CXCR5(B)in lung cancer tissues analyzed by GEO data set GSE30219
用0、10、50、100 ng∕ml的CXCL13处理人非小细胞肺癌H1975细胞,以DMSO处理细胞为阴性对照组,经8 Gy X线照射后,100 ng∕ml CXCL13处理组细胞增殖水平显著高于对照组(P=0.015,F=0.381),见图3A。流式细胞术结果显示:随着CXCL13浓度的提高,H1975细胞的凋亡率呈逐渐下降,其中100 ng∕ml CXCL13处理组细胞凋亡率显著低于对照组(P=0.001,F=0.666),见图3B。50和100 ng∕ml CXCL13处理组细胞克隆形成能力显著高于对照组(P50=0.049、F50=1.000,P100=0.014、F100=0.464),见图3C。上述结果提示CXCL13可增强H1975细胞辐射抵抗。
2.4 CXCL13促进Akt磷酸化
Western blot检测0、10、50、100 ng∕ml的CXCL13处理H1975细胞后的Akt表达及磷酸化水平,结果显示:100 ng∕ml的CXCL13显著促进H1975细胞Akt的磷酸化(F=0.194,P=0.005),但不促进其表达,见图4。
2.5 CXCL13通过激活Akt介导H1975细胞辐射抵抗
用Akt抑制剂LY294002来阻断Akt的活化,结果显示:与对照组相比,10、20 μg∕ml LY294002(以下简称LY)可显著抑制Akt活化(P10=0.042、F10=0.400,P20=0.009、F20=0.362),见图5A。细胞增殖结果显示:经8 Gy X射线处理,CXCL13处理组细胞的增殖能力显著高于对照组(P=0.022,F=0.415);而CXCL13+LY处理组与CXCL13单独处理组相比,细胞增殖能力显著下降(P=0.019,F=0.178),见图5B。流式细胞术结果显示:经8 Gy X射线处理,CXCL13处理组细胞的凋亡水平显著低于对照组(P=0.004,F=1.000);而CXCL13+LY处理组与CXCL13单独处理组相比,细胞凋亡水平显著升高(P=0.003,F=0.918),见图5C。经8 Gy X射线处理,CXCL13处理组细胞克隆形成能力显著高于对照组(P=0.005,F=0.490);而CXCL13+LY处理组与CXCL13单独处理组相比,克隆形成能力显著降低(P=0.001,F=0.400),见图5D。上述结果提示Akt参与了CXCL13介导的H1975细胞辐射抵抗。
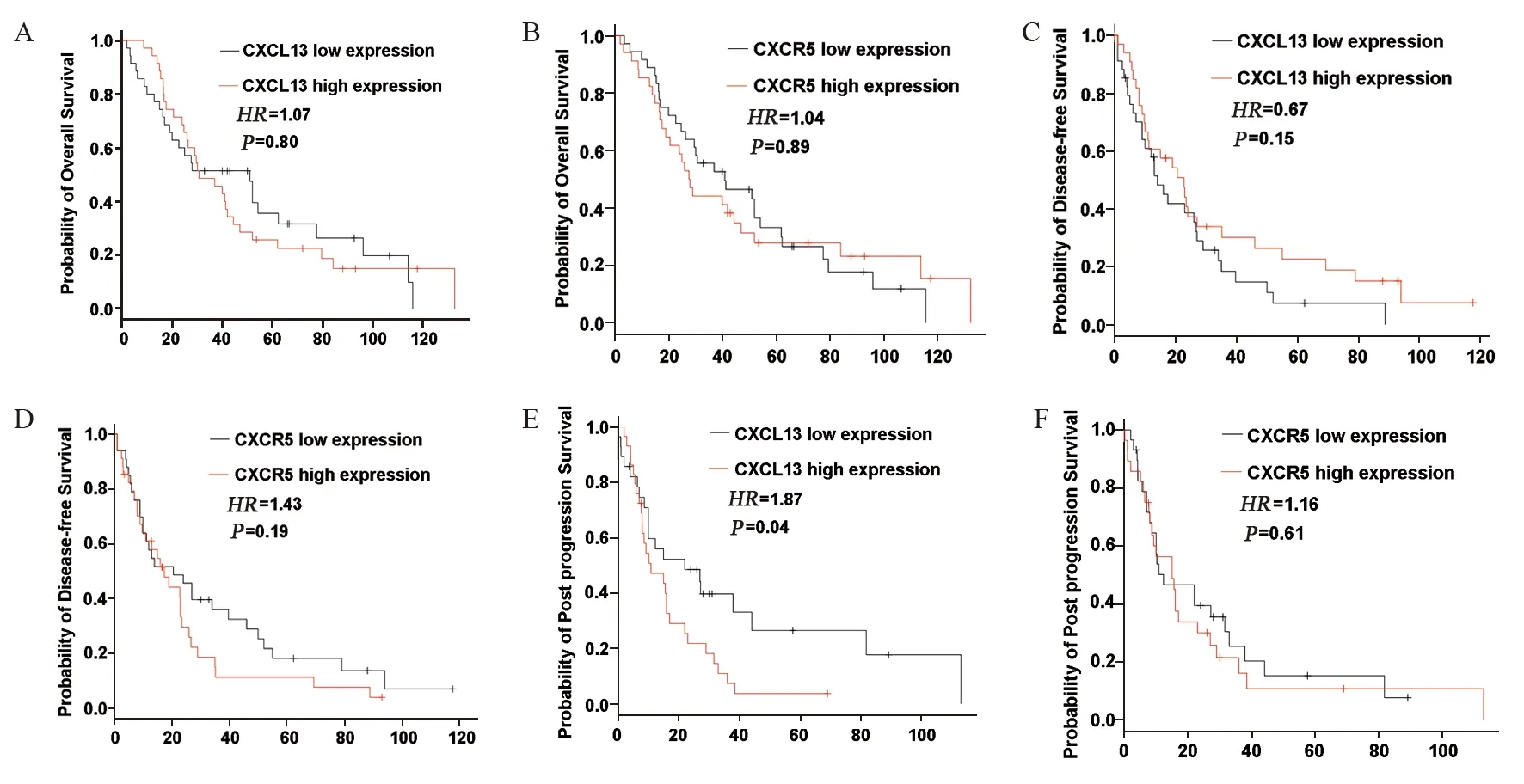
图2 CXCL13和CXCR5表达水平与肺癌放疗患者预后关系Figure 2 Relation between CXCL13/CXCR5 expression levels and prognosis of lung cancer patients who received radiotherapy
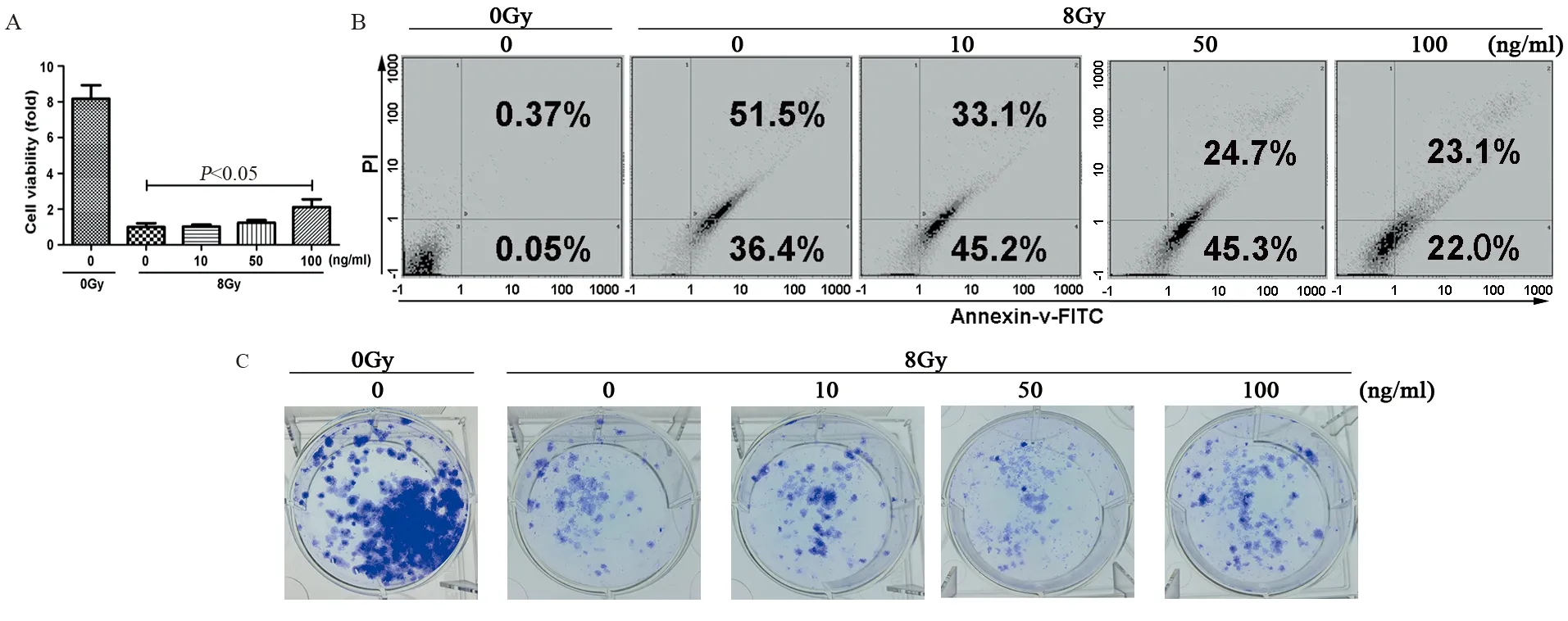
图3 CCK-8、流式细胞术和克隆形成实验检测8Gy X射线和不同浓度的CXCL13对肺癌细胞H1975增殖(A)、凋亡(B)和克隆形成能力(C)的影响Figure 3 Effects of 8Gy X-ray and different concentrations of CXCL13 on proliferation,apoptosis and clone formation abilities of lung cancer H1975 cells detected by CCK8 method,flow cytometry and clone formation assay
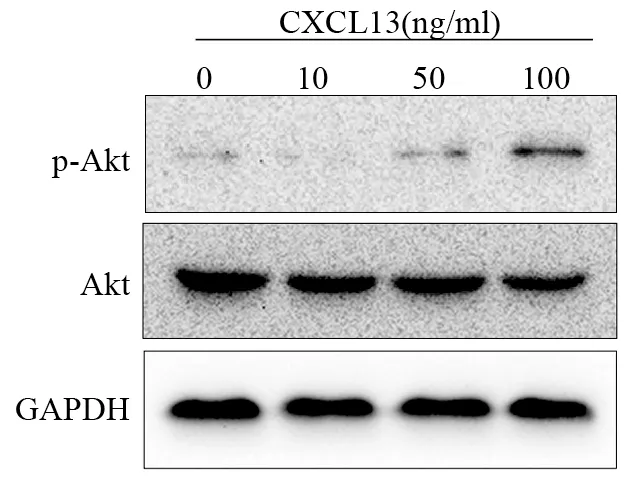
图4 Western blot检测不同浓度CXCL13处理H1975细胞30 min后Akt的表达及活化水平Figure 4 Expression and activation levels of Akt in H1975 cells after CXCL13 treatment at different concentrations for 30 min detected by Western blot
3 讨论
放疗抵抗的机制十分复杂,大量报道证实放疗抵抗的发生与细胞周期阻滞、相关基因改变、肿瘤微环境变化、自噬性调节及肿瘤干细胞的存在等多种因素相关[11]。研究放疗抵抗机制,寻找放疗抵抗新靶标是提高放疗疗效的关键,同时也将为肿瘤放疗敏感度的预测提供可能。
趋化因子及其受体在调节血管生成、细胞迁移及机体发育过程发挥重要作用。近些年研究发现趋化因子及其受体在肿瘤治疗抵抗中也发挥重要作用[12]。研究显示CXCL12/CXCR4高表达与头颈肿瘤放化疗抵抗密切相关[13]。肿瘤相关成纤维细胞分泌的CXCL1显著增强食管鳞状细胞癌放射抵抗能力[14]。靶向CXCL12/CXCR4通路可显著增强进展后宫颈癌的放疗效果[15]。研究显示,CCR6的表达水平与肾癌放疗敏感度呈负相关[16]。Zhou等研究证实用CXCR4拮抗剂AMD3100可显著增强三阴性乳腺癌细胞株MDA-MB-231的放射敏感度[17]。目前,CXCL13和CXCR5与肿瘤治疗抵抗的研究比较少见。仅有Jiao等[18]研究发现CXCR5高表达与乳腺癌的放化疗抵抗密切相关。本研究通过公共数据库分析发现CXCL13和CXCR5在肺癌组织中高表达,且CXCL13高表达与肺癌进展后生存期密切相关,进一步研究发现CXCL13可显著增强肺癌细胞株H1975放射处理后细胞增殖能力和克隆形成能力,降低凋亡水平,提示CXCL13可增强肺癌放疗抵抗。Singh等[19]研究结果也表明CXCL13和CXCR5在非小细胞肺癌中高表达,但其只检测了肺腺癌和肺鳞癌标本,而本研究分析了肺腺癌、肺鳞癌、基底样细胞肺癌、肺大细胞神经内分泌癌和小细胞肺癌的CXCL13/CXCR5表达水平,发现其在肺腺癌、肺鳞癌和基底样细胞肺癌组织的表达水平显著高于正常组织,提示CXCL13和CXCR5可能与肺癌的发生密切相关。
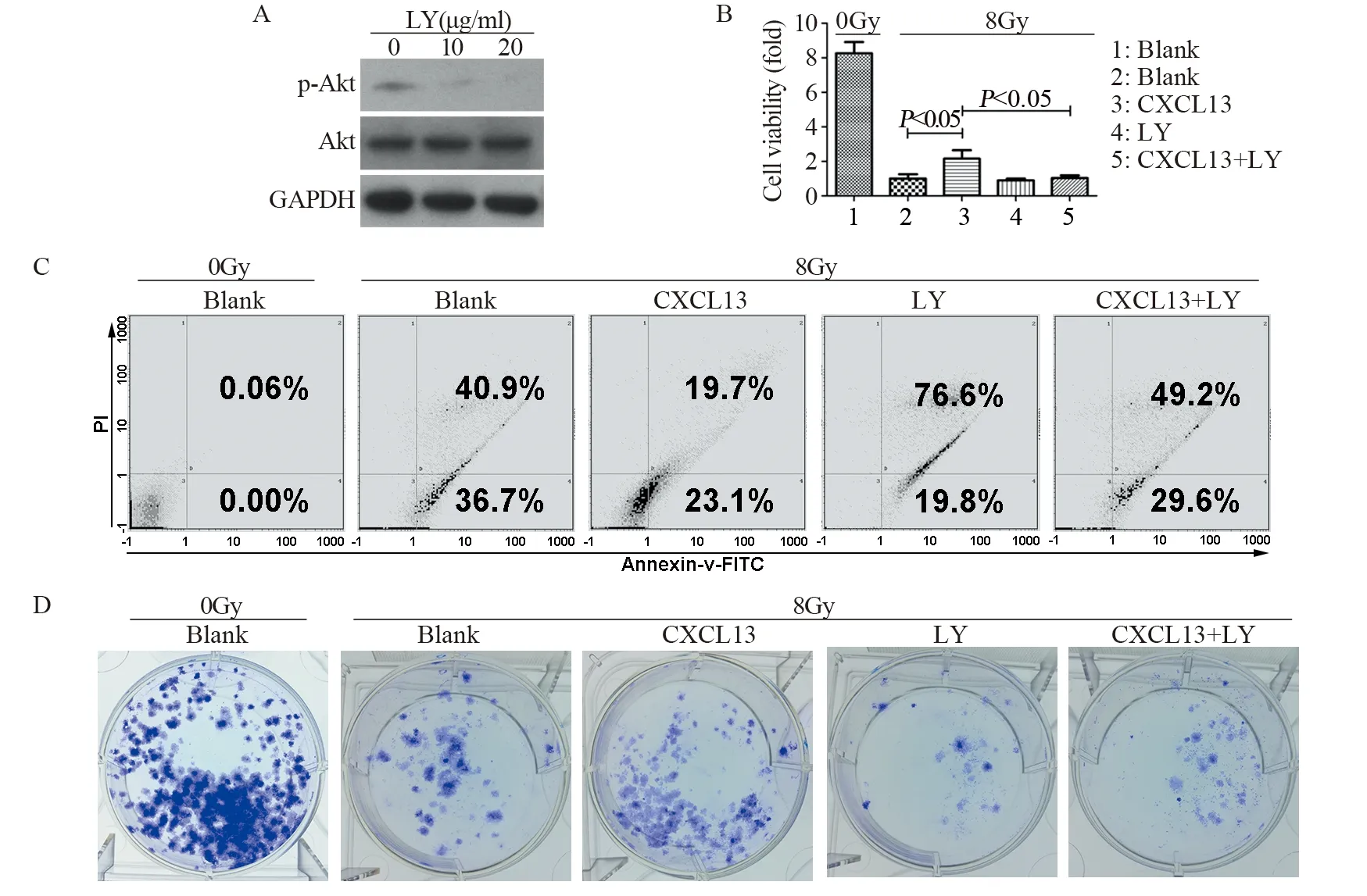
图5 Akt对CXCL13介导的肺癌细胞辐射抵抗的影响Figure 5 Effect of Akt on CXCL13-mediated radioresistance of lung cancer cells
研究显示,Akt促进肿瘤的增殖、迁移及抗凋亡,其可被多种趋化因子激活,随着研究的深入,Akt在肿瘤放疗抵抗中的重要作用也被不断证实[20-21]。Che等[22]研究证实,PI3K/Akt参与TRIP4介导的宫颈癌放疗抵抗。另有研究显示,抑制PI3K/Akt和MAPK信号通路可显著增强肾癌的放射敏感度[7]。关于CXCL13/CXCR5与Akt的关系也有相关研究报道,研究发现CXCL13/CXCR5可激活Akt促进结肠癌细胞增殖和侵袭[23]。此外有研究发现,CXCR5在乳腺癌细胞中调控PI3K/Akt通路[18]。目前,CXCL13/CXCR5-Akt通路与肿瘤放射敏感度的研究尚未见报道。鉴于Akt在放射抵抗中的作用,我们推测Akt可能参与了CXCL13介导的肺癌细胞放射抵抗,本研究结果显示,CXCL13可促进肺癌细胞H1975 Akt活化,抑制Akt显著降低CXCL13介导的H1975细胞放射抵抗。然而本研究也存在一些不足之处,未阐明CXCL13到底是通过激活Akt下游哪些分子参与肺癌放疗抵抗,而CXCL13促进肺癌细胞放射抵抗的信号通路也很可能不止Akt一条,这些机制都值得后续进一步探讨。
综上所述,本研究探讨了CXCL13在肺癌的表达水平,初步证实CXCL13促进肺癌细胞放射抵抗,其可能的机制是CXCL13通过活化Akt来实现的。本研究有望为解决临床肺癌放疗抵抗问题提供一个新的治疗靶标。
