冻融治疗后肝癌库普弗细胞分泌功能的变化
2020-02-28朱亚玲易峰涛丁梦南曾程徐振华邵志雄谢俊杰
朱亚玲 ,易峰涛,,丁梦南,曾程,徐振华,邵志雄,谢俊杰
0 引言
在过去20年里,局部肿瘤的冻融治疗已经有了长足的发展,主要集中在肝癌[1]、转移性癌[2]、肾癌[3]、前列腺癌[4]等实体瘤治疗中。同时,越来越多的报道表明,冻融治疗可以破坏肿瘤,增强或诱导细胞免疫或抗肿瘤免疫应答[5-7]。此外,肿瘤细胞的破坏和溶解可能成为炎性反应的重要介质[8]。
库普弗细胞(Kupffer cells,KCs)是数量最大的免疫细胞,占肝脏巨噬细胞的80%~90%,也是单核吞噬细胞系统的重要组成部分,在肝脏巨噬细胞的发生发展中起着重要的作用[9]。KCs的激活与多种细胞因子的分泌密切相关,这些细胞因子参与免疫和促炎或抗炎反应[10]。KCs自身还具有分泌炎性因子的功能,参与肝脏中各种重要的生理和病理过程,如炎性反应、脂质代谢、移植免疫等[11]。
因此,有必要研究冻融后KCs分泌功能的特征,帮助我们治疗肝癌,促进患者的早期康复,为肝癌冻融治疗能提高自身免疫功能的学说提供理论依据。为此,本研究通过体外细胞实验,从兔肝中提取KCs并进行了体外培养,应用NF-κB抑制剂吡咯烷二硫代氨基甲酸酯(PDTC)阻断NFκB信号通路后,观察KCs的分泌功能变化,探索冻融治疗引起KCs功能变化的机制。
1 材料与方法
1.1 材料
NF-κB抑制剂PDTC购自美国BioVision公司;胎牛血清购自杭州四季青生物工程材料有限公司;低糖DMEM完全培养基购自美国ATCC公司;0.4%锥虫蓝溶液购自美国Sigma公司;GAPDH购自英国Abcam公司;蛋白Marker(10~170 kDa)购自立陶宛Fermentas公司;0.45 μm PVDF膜购自美国Millipore公司;SDS-PAGE凝胶制备试剂盒、蛋白抽提试剂盒、BCA蛋白浓度测定试剂盒、ECL化学发光试剂盒、PMSF(100 mmol/L)、磷酸化蛋白酶抑制剂、5×蛋白上样缓冲液、10×丽春红染液和抗体洗脱液均购自武汉拓捷生物公司;Tris和甘氨酸购自国药集团化学试剂有限公司(上海);动物麻醉剂(速眠新Ⅱ)购自中国动物保健品有限公司(北京),其他试剂由中国人民解放军中部战区总医院医学实验科提供。
1.2 方法
1.2.1 KCs细胞悬液的制备 经肌肉注射速眠新Ⅱ(0.2 ml/kg)麻醉后,对其进行消毒、开腹、门静脉暴露和固定插管并打开胸腔。根据Zeng等[12]制备KCs细胞悬液的方法,对下腔静脉结扎后,快速切割、断裂部分肝脏,用PBS冲洗两次。取肝悬液离心,取上清液。充分悬浮后,将上述肝细胞悬液移入含30%和60%细胞分离液的离心管中,以800g(20℃)缓升缓降离心20 min,离心后可见乳白色细胞层。收集细胞层,继续培养。
1.2.2 构建低温和冻融坏死的肿瘤细胞攻击KCs的细胞模型 模拟冻融治疗时体内KCs受到的主要攻击因素是低温和冻融坏死物质,构建体外细胞模型。将浓度为1×106/ml的KCs悬浮液用5 ml一次性塑料吸管分为不同的培养瓶,每瓶加入5 ml。实验分为8组,每组9瓶:(1)对照组:KCs正常培养37℃;(2)0℃组:模拟冻融治疗时冰球边缘温度,将培养瓶置于0℃环境中20 min,取出放回37℃孵化器。5 min后,将培养瓶置于0℃环境中20 min,再放入37℃培养箱中,培养6 h后,进行实验;(3)5℃低温组和10℃低温组:模拟冻融治疗时冰球边缘距离0.5 cm和2 cm的温度。实验方法与0℃组相同,但放置培养瓶的温度环境不同。5℃组在5℃环境中放置2次20 min,10℃组在10℃环境中放置2次20 min;(4)冻融坏死物质组:冻融治疗后第3天将治疗中心肿瘤组织(人肝癌HepG2细胞购于中国科学院上海科学院资源中心,于中国人民解放军中部战区总医院医学实验科内进行传代培养)制成1%细胞悬液,在KCs培养瓶中加入2 ml,其余培养条件与对照组相同;(5)联合刺激组:按不同温度(0℃、5℃、10℃)放置的KCs培养瓶分为3组。各组再加入冻融肿瘤坏死细胞悬液,其浓度与冻融坏死物质组相同,实验方法分为0℃、5℃和10℃组。
1.2.3 干预措施 以上8组各设1个平行组。将PDTC加入培养基中,NF-κB抑制剂最终浓度为100 μmol/L。
1.2.4 KCs分泌功能的检测 参考文献中的方法[13],采用ELISA法检测KCs上清液中肿瘤坏死因子-α(TNF-α)、白细胞介素-1(IL-1β)和干扰素-γ(INF-γ)的浓度。各组采用ELISA法检测细胞培养液中的IFN-γ、IL-1β、TNF-α的浓度。
1.2.5 NF-κB蛋白测定 各组培养6 h后,用Western blot法检测各组NF-κB蛋白的表达,用定量软件处理系统分析靶带的吸光度值。Western blot检测方法如文献所述[14]。用鼠抗NF-κB抗体(sc-109,Santa Cruz生物技术,美国圣克鲁斯州)进行印迹检测,计算靶带的吸光度值。
1.3 统计学方法
采用SPSS19.0统计学软件进行统计学分析。计数资料以均数±标准差()表示,采用t检验及方差分析;计量资料以率(%)表示,采用χ2检验;组间比较采用单因素方差分析;组内比较采用Friedman检验,P<0.05为差异有统计学意义。
2 结果
2.1 KCs分泌功能测试
(1)无抑制剂组与对照组比较:低温组(0℃、5℃、10℃)和10℃冻融坏死物质组培养1 h时KCs细胞分泌炎性因子水平差异无统计学意义(P>0.05),冻融坏死物质组与联合刺激组比较KCs细胞分泌炎性因子水平差异有统计学意义(P<0.05),10℃冻融坏死物质组与对照组比较KCs细胞分泌炎性因子水平差异有统计学意义(P<0.05)。各组培养1 h,与对照组比较(P<0.01),差异有统计学意义。(2)无抑制剂组KCs细胞分泌炎性因子水平与培养时间的相关性:随着培养时间的延长(1、2、3 h),炎性因子的分泌水平显著升高,差异有统计学意义(χ2=10.750,P=0.005)。(3)抑制剂组与对照组比较:各组KCs细胞分泌炎性因子水平比较(P>0.05),差异无统计学意义;组内KCs细胞分泌炎性因子水平比较,差异无统计学意义(χ2=2.25,P=0.325)。(4)有抑制剂组和无抑制剂组KCs细胞分泌炎性因子水平比较,两组在相同条件下(对照组除外)均有统计学意义(P<0.01)。
KCs分泌功能结果显示,用低温或冻融坏死物或联合刺激KCs后培养1 h,炎性因子的分泌增加(P<0.01),低温和冻融坏死产物组的联合刺激具有叠加作用。此外,随着培养时间的延长(1、3、6 h),炎性因子的分泌水平显著升高(χ2=10.750,P=0.005),有级联放大的趋势。在PDTC存在下,8组间炎性因子的分泌水平差异无统计学意义(P=0.325)。延迟培养时间,各组KCs细胞分泌炎性因子水平无变化,见表1~2。
2.2 NF-κB蛋白表达
低温刺激对NF-κB蛋白的表达无显著影响,而对照组与低温组之间比较差异无统计学意义(P>0.05)。联合刺激组和冻融坏死物质组NF-κB蛋白表达明显上调(P<0.05),差异有统计学意义。而抑制剂组NF-κB蛋白的表达无明显变化,其线型几乎呈直线状,见图1~3。
3 讨论
KCs凭其吞噬和分泌功能,参与了肝脏多种重要的生理和病理过程,如清除坏死细胞和组织碎片,诱导炎性反应、参与脂质代谢、移植免疫等[15-17]。KCs功能受内毒素、脂多糖、坏死组织或细胞、应激等多种因素的影响[10]。活化的KCs能产生多种细胞因子,包括TNF-α、IL-1β和INF-γ等,对靶细胞产生杀伤作用,从而发挥其生物学作用[18]。冻融治疗主要利用温度急剧变化,破坏肿瘤细胞,同时对治疗区周围组织产生低温刺激,诱发机体应激反应。而应激和坏死肿瘤细胞释放的如水解蛋白酶等细胞有害物均可引起KCs的变化[19]。
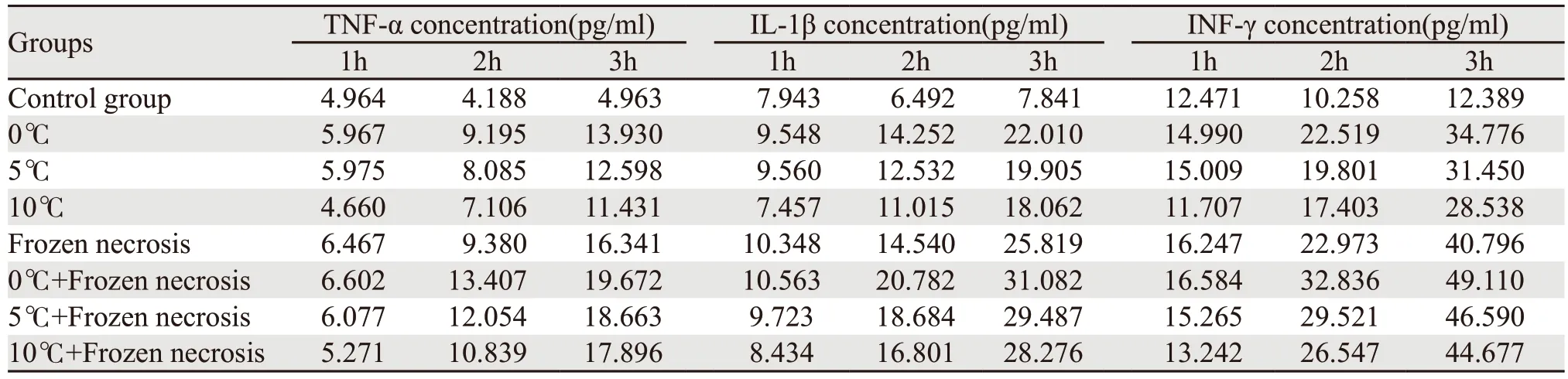
表1 无抑制剂组的KCs分泌功能测试结果Table 1 Test results of secretion function of Kupffer cells (KCs) without inhibitor
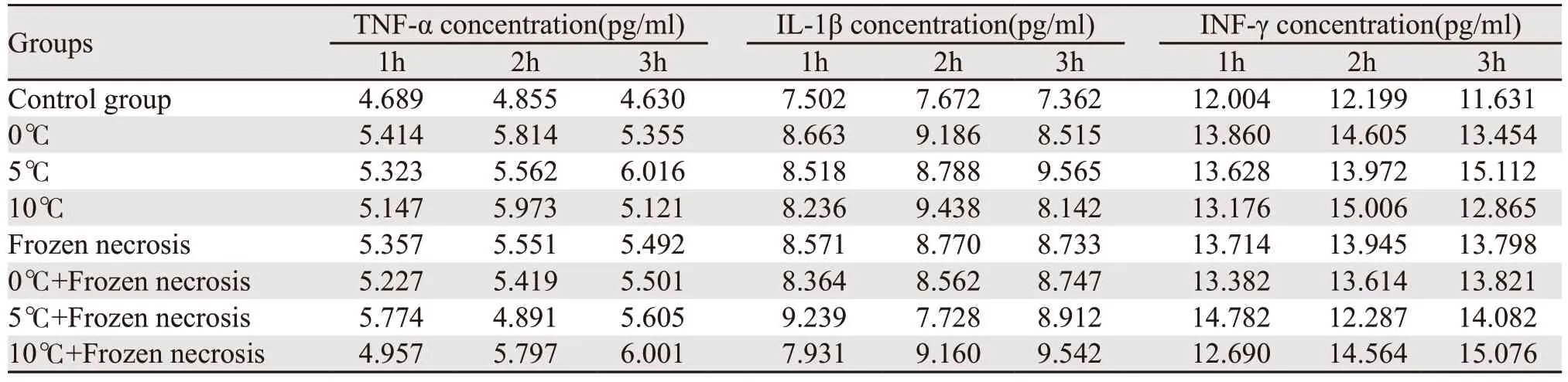
表2 有抑制剂组的KCs分泌功能测试结果Table 2 Test results of secretion function of KCs with inhibitor
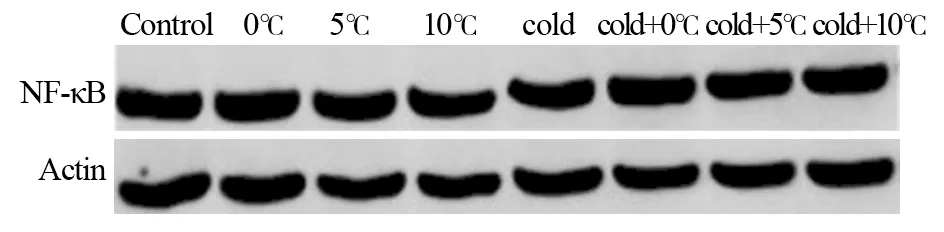
图1 无抑制剂时NF-κB蛋白的表达Figure 1 Expression of NF-κB protein in group without inhibitor
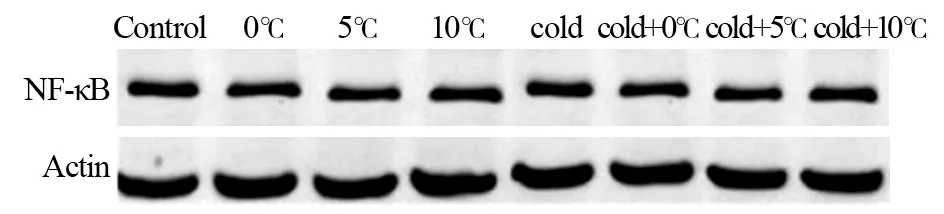
图2 有抑制剂时对NF-κB蛋白表达的影响Figure 2 Effect of inhibitor on expression of NF-κB protein
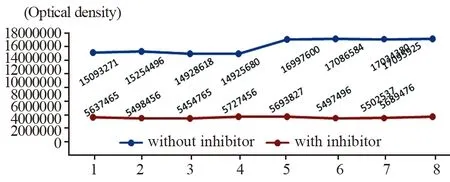
图3 NF-κB蛋白的表达Figure 3 Expression of NF-κB protein
KCs受到低温或冻融坏死物质刺激后,可促进炎性因子的分泌,如TNF-α、IL-1β和INF-γ,这些炎性因子可诱导炎性细胞聚集、介导炎性反应和清除坏死细胞或组织碎片[20],这一反应过程可能是冻融治疗后残存肿瘤的一个杀伤机制。此外,本研究还发现,在培养瓶中加入NF-κB抑制剂后,低温组、冻融坏死物质组和联合刺激组的炎性细胞因子水平均无变化,说明用NF-κB抑制剂可以抑制炎性因子的分泌过程。同时,还发现TNF-α、IL-1β和INF-γ的浓度与KCs上清液中NF-κB蛋白表达呈正相关,所以冻融治疗后KCs的分泌功能可能通过NF-κB信号通路调控。
NF-κB是一个转录因子家族,调控大量参与细胞存活、炎性反应和免疫反应等重要生理过程的基因。最近有研究表明,NF-κB的组成型表达与多种类型的癌症有关[21]。NF-κB信号通路也是炎性反应相关的癌症发生的重要因素[22]。本研究通过对NF-κB信号通路相关蛋白的检测,探讨了KCs诱导炎性反应的机制。NF-κB是细胞内重要的核转录因子,是细胞免疫和炎性反应的重要组成部分[23],它参与多种基因的表达和调控[24]。关于KCs活化的信号转导途径,认为NF-κB是调节KCs活化的关键因素[25],NF-κB在某些细胞信息转录调控中起着关键作用[26],它是细胞活化的标志,也是激活炎性反应的重要因素[27]。有研究证实,NF-κB信号通路是肿瘤治疗的潜在靶点[28]。如果这一信号通路在冻融治疗引起的免疫功能变化中发挥类似作用,将有助于探讨冻融治疗后免疫功能变化的机制。其最直接的判断方法即阻断NF-κB信号通路。吡咯烷二硫代氨基甲酸酯在NF-κB活化通道的不同水平发挥抑制NF-κB蛋白表达的作用,从而阻断NF-κB信号通路,阻断是否成功可以通过检测NF-κB信号通路中的通路终末蛋白NF-κB蛋白的表达情况判断。
在KCs培养瓶中加入冻融坏死物质,其中含有细胞毒素等刺激信号,这些信号可与KCs膜表面受体结合,如与清道夫受体(scavenger receptor,SR)结合,被吞噬到KCs内;再经过多级级联反应,使NF-κB的抑制蛋白(IKB)的上游激酶IKB激酶(IKB kinse,IKK)磷酸化而激活,IKK使IKB降解。P50有核定位信号,当失去了IKB的束缚后,P50会携载RelA(P65)向核内迁移,P65与细胞核内基因启动子或增强子区域上的顺势反应元件结合,从而调控靶基因的转录,诱导NF-κB mRNA的产生,最后转录、产生和释放各种细胞因子(如TNF-α、IL-1β等)[29]。本研究检测结果提示加入冻融坏死物质后,NF-κB蛋白表达上调,炎性因子分泌增加,说明NF-κB信号通路的存在;而加入PDTC后,PDTC作为一种抗氧化剂,可以在NF-κB活化通道的不同水平发挥抑制NF-κB蛋白表达的作用,如阻止上游IKK磷酸化,从而阻止NF-κB信号通路,抑制NF-κB蛋白表达,导致炎性因子分泌减少。反向证明冻融治疗后KCs的变化可能通过NF-κB信号通路发挥作用。
综上所述,冻融治疗可以改变KCs周围的微环境,刺激KCs分泌细胞因子的功能,从而诱导炎性反应,清除肿瘤细胞。另外还证实KCs分泌功能变化可能是通过NF-κB信号通路转导的。
