miR-374b-5p靶向调控ING1表达及对乳腺癌细胞增殖、侵袭和转移的影响
2020-02-27任玉嫄
李 霞,任玉嫄,林 洁,周 琦
乳腺癌是常见的恶性肿瘤之一,是全球女性肿瘤相关死亡的主要原因。流行病学数据显示,2018年全世界有210万左右新诊断乳腺癌病例,约占女性肿瘤病例的25%;在我国乳腺癌是女性最常见的恶性肿瘤[1-2]。近年来,乳腺癌诊断和治疗取得了重大进展,但患者的预后仍很差[3]。乳腺癌患者死亡的主要原因是肿瘤的恶性增殖和转移[4-5],因此,研究乳腺癌的潜在机制、开发用于治疗乳腺癌的新型治疗靶标对改善患者预后具有重要意义。
微小RNAs(microRNAs, miRNAs)几乎在所有类型的肿瘤中均具有关键作用,miRNAs是一组长度为21~23个核苷酸的内源性非编码RNA,广泛存在于真核生物中,参与了细胞增殖、分化和凋亡等重要过程;其可作为致癌基因和抑癌基因在肿瘤发生发展中起着重要作用,被认为是潜在的肿瘤诊断标志物和肿瘤治疗靶点[6-7]。在乳腺癌中已经鉴定了许多异常表达的miRNAs,是乳腺癌恶性生物学行为的关键调控者。miR-374b-5p在多种肿瘤中表达异常[8-10],Chang等[11]报道,miR-374b-5p在乳腺癌患者全血中表达增加。miR-374b-5p参与乳腺癌的发病机制尚不清楚,因此本研究采用实时荧光定量PCR(qRT-PCR)法检测了miR-374b-5p在乳腺癌组织和细胞中的表达,并通过体外抑制乳腺癌细胞中miR-374b-5p的表达后,观察细胞增殖、侵袭和凋亡的变化,探讨miR-374b-5p参与乳腺癌发病的可能机制。现报告如下。
1 材料与方法
1.1一般资料 选择2015年12月—2017年12月我院行手术治疗的乳腺癌患者,患者术前均未接受化疗、放疗、靶向和内分泌等任何形式的治疗;组织经病理专家证实为乳腺癌。共收集50例乳腺癌标本。所有操作均符合我院伦理委员会制定的相关规定,本研究已获得委员会的批准。
1.2试剂与仪器 TRIzol、PrimeScriptTM RT reagent Kit反转录和SYBR Premix Ex TaqTM qRT-PCR试剂盒等均购自日本TaKaRa公司;miR-374b-5p、U6、生长抑制因子1(inhibitor of growth 1, ING1)和GAPDH引物均由上海捷瑞生物有限公司设计合成;乳腺癌细胞系MCF-7、MDA-MB-231、HCC1937和正常乳腺细胞系MCF 10A均购自美国ATCC细胞库;RPMI-1640、L-15、DMEM-F12培养基及胎牛血清FBS均购自美国Gibco公司;miR-374b-5p inhibitor和miR-374b-5p mimic均购自广州市锐博生物科技有限公司;MTS购自美国Biovision公司;6孔板和Transwell小室等均购自美国Corning公司;Boyden基质胶购自美国BD公司。
1.3qRT-PCR 采用TRIzol裂解氯仿提取法获得组织和细胞中的总RNA。按照反转录试剂盒说明书将总RNA逆转录为cDNA,以cDNA为模板,按qRT-PCR试剂盒说明进行PCR扩增。PCR反应条件:95℃预变性5 s,95℃变性5 s、60℃退火30 s,共40个循环。以U6为内参,采用2-ΔΔCt法计算miR-374b-5p的相对表达量;以GAPDH为内参,采用2-ΔΔCt法计算ING1 mRNA的相对表达量。引物序列分别为miR-374b-5p:F:5′- TCAGCGGATATAATACAACCTGC-3′, R:5′-TATCGTTGTTCTCCACTCCTTCAC-3′。U6: F:5′-CTCGCTTCGGCAGCACAING1-3′, R:5′-AACGCTTCACGAATTTGCGT-3′。 ING1:F: 5′- AACAACGAGAACCGTGAGAAC-3′, R:5′-TGGTTGCACAGACAGTACGTG-3′。内参GAPDH: F: 5′- ACAACTTTGGTAT CGTGGAAGG-3′, R:5′-GCCATCACGCCACAGTTTC-3′。
1.4细胞培养及转染 将MCF-7和MCF 10A细胞接种于含10%FBS的RPMI 1640培养基中,MDA-MB-231细胞接种于含10% FBS的L-15培养基中,HCC1937 细胞接种于含10% FBS的DMEM-F12培养基中,培养均在37℃、5%CO2培养箱中进行。根据qRT-PCR结果,选取miR-374b-5p表达水平最高的乳腺癌细胞用于转染,细胞融合度为90%时,胰酶消化以2×105个/孔接种于6孔板中,分为对照组和miR-374b-5p inhibitor组,按照说明书将试剂转染至细胞中,细胞转染48 h后采用qRT-PCR验证miR-374b-5p inhibitor沉默效果。对照组的序列为 5′-CAGUACUUUUGUGUA UACAA-3′; miR-374b-5p inhibitor组的序列为 5′-CACUUAGCAGGUUGUAUUAUAU-3′。
1.5MTS增殖实验 细胞生长至对数期时,胰酶消化以3000个/孔接种于96孔板中,每组设6个复孔,按照转染说明书将对照组和miR-374b-5p inhibitor转染至细胞中,继续培养72 h,弃掉培养基,每孔加入100 μl培养基和20 μl MTS工作液(MTS∶PMS=20∶1),置于细胞培养箱孵育2 h,全波长酶标仪检测490 nm波长处样品OD值。细胞增殖抑制率= (miR-374b-5p inhibitor组OD值-对照组OD值) /对照组OD值×100%。
1.6Boyden实验 45 μl BD基质胶铺至Transwell小室聚碳酸酯微孔膜上,放置细胞培养箱中使胶由液体变为固态备用,收集转染48 h后的各组细胞胰酶消化计数,无血清培养基洗3次,细胞浓度调整为1×106个/ml,100 μl细胞悬液接种于Transwell小室基质胶上,500 μl完全培养基加入下室作为趋化因子,放置培养箱中培养,细胞通过基质胶穿过聚碳酸酯膜小孔,下室穿过10个细胞时终止培养,PBS将微孔膜上室面细胞洗掉,甲醇固定15 min,苏木素染色20 min。随机计数显微镜下5个视野的穿膜细胞数,并拍照。
1.7Transwell小室实验 收集转染48 h后的各组细胞胰酶消化计数,无血清培养基洗3次,细胞浓度调整为1×106个/ml,100 μl细胞悬液接种于Transwell小室聚碳酸酯微孔膜上室面上,500 μl完全培养基加入下室作为趋化因子,放置培养箱中培养,细胞直接穿过聚碳酸酯膜小孔,下室穿过10个细胞时终止培养,PBS将微孔膜上室面细胞洗掉,甲醇固定15 min,苏木素染色20 min。随机计数显微镜下5个视野穿膜细胞数,并拍照。
1.8miR-374b-5p靶向调节ING1 本研究采用TargetScan7.1软件(http://www.targetscan.org/)预测miR-374b-5p的靶基因。双荧光素酶报道基因实验分别将以下4组共转染到细胞中:ING1-wt(野生型)与miR-374b-5p mimic共转染组(ING1-wt+miR-374b-5p);ING1-wt与对照共转染组(ING1-wt+NC);ING1-mut(突变型)与miR-374b-5p mimic共转染组(ING1-mut+miR-374b-5p);ING1-mut与NC共转染组(ING1-mut+对照),收集转染48 h的细胞,根据双荧光素酶报道基因检测试剂盒说明书检测各组荧光素酶活性。

2 结果
2.1qmiR-374b-5p在乳腺癌组织和细胞系中的表达水平 miR-374b-5p在乳腺癌组织中的表达为1.82±1.01,癌旁组织中的表达为1.04±0.53;乳腺癌组织中miR-374b-5p的表达水平显著高于癌旁组织,差异有统计学意义(P<0.05)。见图1A。miR-374b-5p在乳腺癌细胞系MCF-7、MDA-MB-231、HCC1937中的表达水平分别为21.62±2.45、5.72±0.68、10.58±0.93,miR-374b-5p在正常乳腺细胞系MCF 10A中的表达水平为1.00±0.00。miR-374b-5p在乳腺癌细胞系MCF-7、MDA-MB-231、HCC1937中的表达水平显著高于正常乳腺细胞系MCF 10A,差异有统计学意义(P<0.05)。见图1B。因此选取表达水平最高的MCF-7细胞用于后续实验。
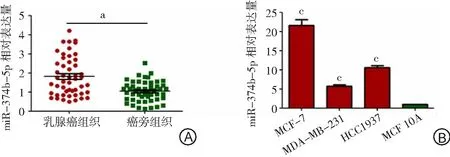
图1 miR-374b-5p在乳腺组织和乳腺细胞系中的表达水平比较
A.乳腺癌组织和癌旁组织中miR-374b-5p表达;B.miR-374b-5p在乳腺癌细胞系和正常乳腺细胞系中的表达;与癌旁组织比较,aP<0.05;与MCF 10A细胞系比较,cP<0.05
2.2转染miR-374b-5p inhibitor的干扰效果比较 miR-374b-5p inhibitor转染MCF-7细胞48 h后,miR-374b-5p在miR-374b-5p inhibitor组细胞中的表达水平为0.21±0.04,在对照组细胞中的表达水平为1.00±0.05,2组miR-374b-5p表达水平比较差异有统计学意义(P<0.05)。表明miR-374b-5p inhibitor明显干扰了MCF-7细胞中miR-374b-5p的表达,可进行后续实验。
2.3干扰miR-374b-5p表达对乳腺癌细胞增殖的影响 对照组细胞增殖率为(100.00±5.00)%,miR-374b-5p inhibitor组细胞增殖率为(29.30±4.27)%;与对照组比较miR-374b-5p inhibitor组细胞增殖率降低(P<0.05) 。见图2。
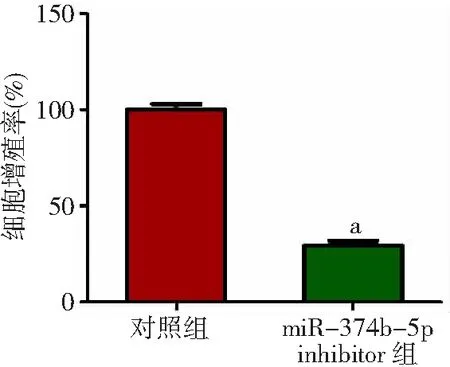
图2 干扰miR-374b-5p表达对乳腺癌细胞增殖的影响
与对照组比较,aP<0.05
2.4干扰miR-374b-5p表达对乳腺癌细胞侵袭的影响 对照组细胞穿膜数为(52.34±11.14)个,miR-374b-5p inhibitor组穿膜数为(18.24±7.62)个;与对照组比较,miR-374b-5p inhibitor组细胞侵袭能力降低,差异有统计学意义(P<0.05) 。见图3。
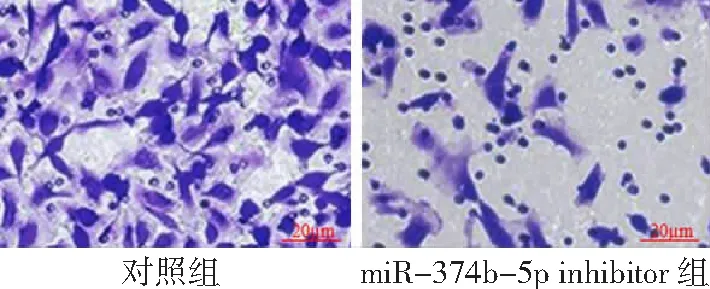
图3 干扰miR-374b-5p表达对乳腺癌细胞侵袭的影响(HE×400)
2.5干扰miR-374b-5p表达对乳腺癌细胞转移的影响 对照组细胞穿膜数为(38.94±10.35)个,miR-374b-5p inhibitor组穿膜数为(16.31±8.24)个;与对照组比较,miR-374b-5p inhibitor组细胞转移能力降低(P<0.05) 。见图4。
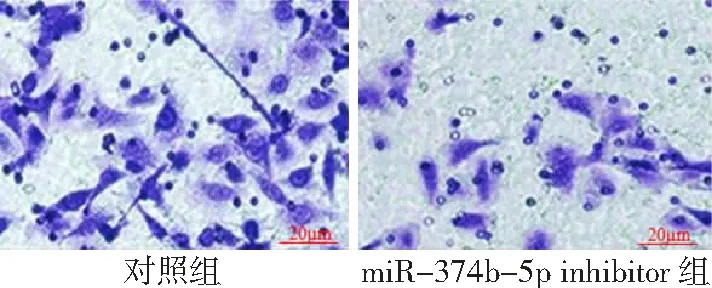
图4 干扰miR-374b-5p表达对乳腺癌细胞转移的影响(HE×400)
2.6miR-374b-5p对ING1的调控作用 TargetScan7.1软件在线预测显示ING1启动子区有miR-374b-5p的结合位点,可能是miR-374b-5p的靶基因。见图5A。与ING1-wt+对照共转染组相比,ING1-wt+miR-374b-5p共转染组的荧光素酶活性显著降低(P<0.05);ING1-mut+对照组和ING1-mut+miR-374b-5p组荧光素酶活性比较差异无统计学意义(P>0.05)。见图5B。与对照转染组比较,miR-374b-5p mimic组细胞中ING1 mRNA表达水平下降(P<0.05)。见图5C。
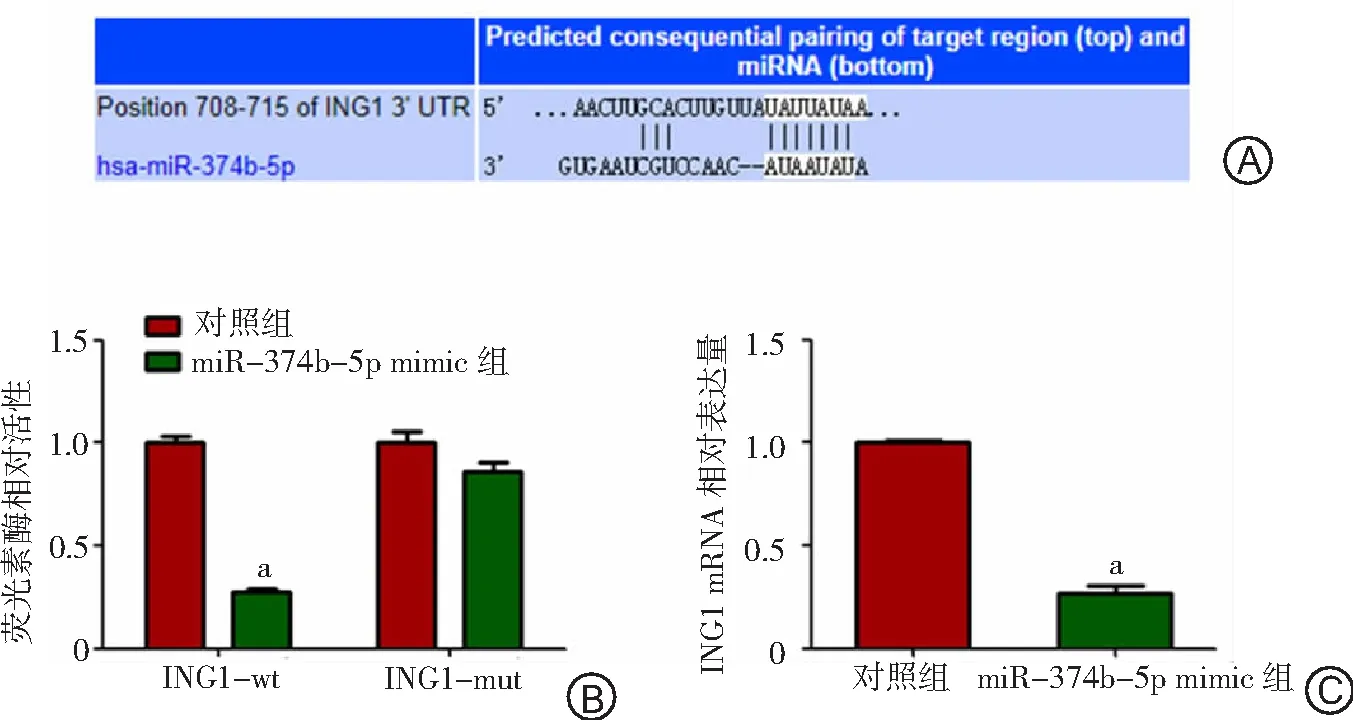
图5 miR-374b-5p对ING1的靶向调控作用
A.TargetScan7.1软件预测ING1与miR-374b-5p结合位点;B.双荧光素酶报道基因试验检测miR-374b-5p靶向ING1在对照组和miR-374b-5 mimic组的表达水平;C.qRT-PCR检测ING1 mRNA在对照组和miR-374b-5 mimic组的表达水平;ING1为生长抑制因子1,ING1-wt为野生型ING1,ING1-mut为突变型ING1;与对照组比较,aP<0.05
3 讨论
乳腺癌具有高发病率、高复发率和高病死率的特点,严重威胁了女性健康[1-2]。近年来乳腺癌发病率持续增加,且该病诊断年龄具有年轻化趋势[12]。乳腺癌治疗包括手术、化疗、放疗、内分泌治疗和靶向治疗等,有效地改善了患者预后,但是高复发率和高转移导致该类患者的存活率仍然很低,因此寻找乳腺癌新的治疗靶点仍是研究的热点[3-4]。研究报道,miRNAs在乳腺癌发病过程中具有重要调控作用;miRNAs虽然在多个物种中仅占基因组的1%左右,但其可调控人类基因组中超过60%的编码蛋白质基因[13],既往研究表明,miRNAs模拟物或抑制剂可作为治疗肿瘤的药物[6-7],miRNAs在乳腺癌中作为治疗靶点同样具有应用前景。
miR-374b-5p是新近发现的miRNAs,其异常表达与包括恶性肿瘤在内的多种人类疾病有关。Li等[8]报道,miR-374b-5p抑制卵巢癌细胞增殖、迁移和上皮-间质转化(EMT),并使肿瘤细胞对顺铂治疗的敏感性增强。miR-374b-5p在胃癌细胞系中表达增加,并可促进胃癌细胞的转移、侵袭和增殖[9]。miRNAs分为促进肿瘤miRNAs和抑制肿瘤miRNAs,但是miRNAs在不同肿瘤中发挥的作用可能不同。文献报道,在三阴乳腺癌(TNBC)中高表达水平的miR-374b-5p与患者预后好相关,在TNBC细胞系中恢复miR-374b-5p的表达抑制细胞的增殖和侵袭[9-10]。Zhang等[14]采用miRCURY TM LNAq芯片技术检测出乳腺癌患者与健康对照人全血中171个差异表达的miRNAs,并用qRT-PCR验证了miR-374b-5p是乳腺癌患者全血中上调的5个miRNAs之一。本研究同样采用qRT-PCR检测,发现miR-374b-5p在乳腺癌组织中的表达高于癌旁组织,提示miR-374b-5p在乳腺癌中可能为促癌miRNAs,与有关TNBC的报道[10]不一致。TNBC属于乳腺癌的一种特殊类型,其发病机制、治疗方法及预后均与普通乳腺癌不同,因此miR-374b-5p在TNBC和普通乳腺癌中发挥的作用可能不一样。文献报道,miR-374b-5p在多种肿瘤中表达异常,并具有生物学功能。本研究结果显示,miR-374b-5p在乳腺癌组织中高表达,其在乳腺癌中的功能引起本课题组的关注;为此本研究首先检测了miR-374b-5p在乳腺癌细胞系MCF-7、MDA-MB-231、HCC1937和正常乳腺细胞系MCF 10A中的表达,与正常乳腺细胞相比,其在乳腺癌细胞中的表达均显著增加,这一结果与在组织水平中的表达具有一致性。miRNAs inhibitor为有效的肿瘤治疗抑制剂,在MCF-7细胞中转染inhibitor抑制miR-374b-5p的表达后,MTS、Boyden实验和Transwell小室实验检测结果显示细胞增殖、侵袭和转移能力均降低,以上结果说明miR-374b-5p可能促进乳腺癌的发生发展。miR-374b-5p具体的调控机制需进一步研究。
研究报道,在所有miRNAs中,一半以上通过直接靶向癌基因或肿瘤抑制基因参与肿瘤的发生发展,miRNAs通过与靶基因mRNA的3′非翻译区结合,通过在转录后水平调控靶基因的表达发挥作用,其靶基因可有数十个到数百个[15],TargetScan7.1生物信息学软件预测ING1基因3′非翻译区有miR-374b-5p的结合位点,ING1属于Ⅱ型肿瘤抑制因子的ING家族,其中ING1是最具特征的成员,编码四种蛋白异构体[15]。ING1表达缺失涉及多种人类肿瘤类型,包括胃癌、前列腺癌和肝癌等[16-19]。据报道ING家族的其他成员,特别是ING4,与乳腺癌的发生发展密切相关[20-21]。Thakur等[22]报道了ING1水平降低与乳腺癌患者转移增加相关。ING1在非小细胞肺癌细胞中作为miR-500和miR-628的直接靶基因抑制肿瘤细胞的增殖、迁移、侵袭和黏附,并可诱导肿瘤细胞凋亡[23]。本研究中采用双荧光素酶报告基因试验证实ING1为miR-374b-5p直接调控的靶基因,并发现miR-374b-5p mimic抑制MCF-7细胞中ING1 mRNA的表达,表明miR-374b-5p在乳腺癌中可能通过直接作用于靶基因ING1促进乳腺癌细胞的增殖、侵袭和转移,但还需深入研究确认。
综上所述,miR-374b-5p在乳腺癌组织和细胞中表达相对较高,抑制miR-374b-5p的表达,降低了乳腺癌细胞增殖、侵袭和转移能力,ING1是miR-374b-5p调控的直接靶基因。本课题组推测miR-374b-5p通过靶向抑制ING1的表达促进乳腺癌的增殖、侵袭和转移能力。miR-374b-5p可能是潜在的乳腺癌治疗靶标。
