乌司他丁对农药中毒大鼠脑组织保护作用的研究
2020-02-27王维展何佳起
王 啸,明 丹,王维展,王 璞,李 娜,何佳起
随着农药的普及,近年来农药中毒的事件逐年递增[1]。现阶段常见的农药包括矿物源农药、生物源农药和化学合成农药(敌敌畏、百草枯等)[2]。敌敌畏是一种较为常见的有机磷农药,这类农药可抑制乙酰胆碱酯酶,造成延迟周围神经病变[3]。百草枯中毒后会直接作用于中毒者的器官,造成肺、心、肝、肾功能衰竭导致患者死亡[4]。乌司他丁(utinastatin, UTI)是抗炎药物之一,其作用机制是通过下调促炎因子和上调抗炎因子,同时调控或阻断机体炎症反应过程实现对炎症的抑制[5]。UTI是一种高效的酶抑制剂,可抑制多种蛋白酶,具有防御组织破坏的作用。目前已有研究证实UTI可减轻急性百草枯和敌敌畏中毒,但对于UTI对农药中毒大鼠脑组织保护作用机制的报道较少。本文旨在研究UTI对农药中毒大鼠脑组织保护作用,以期了解其作用机制,从而为农药中毒提供一定的理论依据。
1 材料与方法
1.1实验材料
1.1.1实验动物:SPF级3周龄SD大鼠60只,体重200~220 g(广东医学院实验动物中心,实验动物许可证号:粤监证字 2004A029号)。饲养于本院动物中心实验室,分12笼饲养,每笼5只。饲养温度20~25℃,相对湿度50%~65%。该实验经动物伦理委员会批准同意。
1.1.2药物与试剂:农药(草铵膦)购自四季丰园有限公司;谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)、丙二醛(malondialdehyde ,MDA)试剂盒购自上海恒远生物科技有限公司;肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-6 (interleukin-6, IL-6)试剂盒购自南京森贝伽生物科技有限公司;乙酰胆碱酯酶(acetylcholinesterase, AChE)试剂盒购自上海索桥生物有限公司;NMDA受体试剂盒购自江莱生物;超氧化物歧化酶1(superoxide dismutase 1, SOD1)抗体购自艾博抗(上海)贸易有限公司;PTEN诱导激酶1(PTEN-inducible kinase 1, Pink1)抗体购自艾美捷科技有限公司;过氧化物还原酶6(peroxide reductase 6, Prdx6)抗体购自上海龙田生物技术有限公司;中性福尔马林、乙醇、二甲苯均购自天津科密欧有限公司。
1.1.3实验仪器:BS-124s 型电子天平(北京赛多斯仪器系统有限公司);TDL-5 型台式离心机(上海安亭科学仪器厂);光学显微镜(东莞市同创仪器有限公司);低温离心机(湖南恒诺离心机有限公司);蛋白电泳及转膜仪(美国Bio-Rad公司);凝胶成像系统(以色列DNR公司);BS-124s 型电子天平(北京赛多斯仪器系统有限公司)。
1.2方法
1.2.1实验分组及建立模型:60只SD大鼠适应性喂养 1 周后,随机分为对照组、模型组、低剂量组、高剂量组,每组15只。对照组大鼠腹腔注射生理盐水2 ml,其余3组大鼠均给予腹腔注射农药2 ml造模,造模后立即观察大鼠一般状态及症状并记录。
1.2.2药物干预:建立模型后2 h,低剂量组腹腔内注射UTI 75 kU/kg,高剂量组腹腔内注射UTI 150 kU/kg,对照组和模型组分别腹腔内注射和高剂量组等量的生理盐水。
1.3观察指标及方法
1.3.1大鼠一般情况观察:建立模型并使用药物干预完成后立即观察大鼠一般状态及症状并记录。当大鼠出现全身颤动、口腔分泌物增多、步态不稳中的任意一项即判定为中毒。大鼠肌颤强度分为4级,具体分级方式参考戴旭锋等[6]研究。
1.3.2血清中氧化应激物质及炎性因子检测:建立模型并使用药物干预完成后24 h,使用10%水合氯醛350 mg/kg麻醉大鼠,腹主动脉取血分离血清,保存在-20℃条件下待测,按照试剂盒说明书检测MDA、GSH-Px、TNF-α、IL-6含量。
1.3.3脑组织及全血AChE活力及NMDA受体活性检测:建立模型并使用药物干预完成后24 h,处死大鼠,取大鼠脑组织使用冰生理盐水冲洗,按照1∶9制成10%的组织匀浆,使用恒温离心机,在4℃、3500 r/min离心的条件下离心10 min,去上清液,在-20℃冻存待测,测定大鼠全血和脑组织的AChE活力及NMDA受体的活性,使用Scatchard作图并求出NMDA受体的最大结合容量(Bmax)和平衡解离常数(Kd)。
1.3.4Western blot 检测蛋白表达水平:取各组大鼠海马区脑组织并用剪刀剪取小块,使用胰蛋白酶处理,提取组织总蛋白,使用半干法将蛋白转移到PVDF膜,置于5%脱脂奶粉室温封闭2 h后加入各需要检测蛋白的一抗,二抗,孵育2 h,TBS洗净,以β-actin为内参蛋白,采用显色液显色后行吸光度分析,计算各蛋白相对表达量。

2 结果
2.1大鼠血清中炎性因子水平 与对照组比较,模型组大鼠血清中TNF-α及IL-6水平显著升高,差异有统计学意义(P<0.01)。与模型组比较,高剂量组和低剂量组大鼠血清中TNF-α及IL-6含量水平显著降低,且高剂量组低于低剂量组,差异有统计学意义(P<0.01)。见图1。
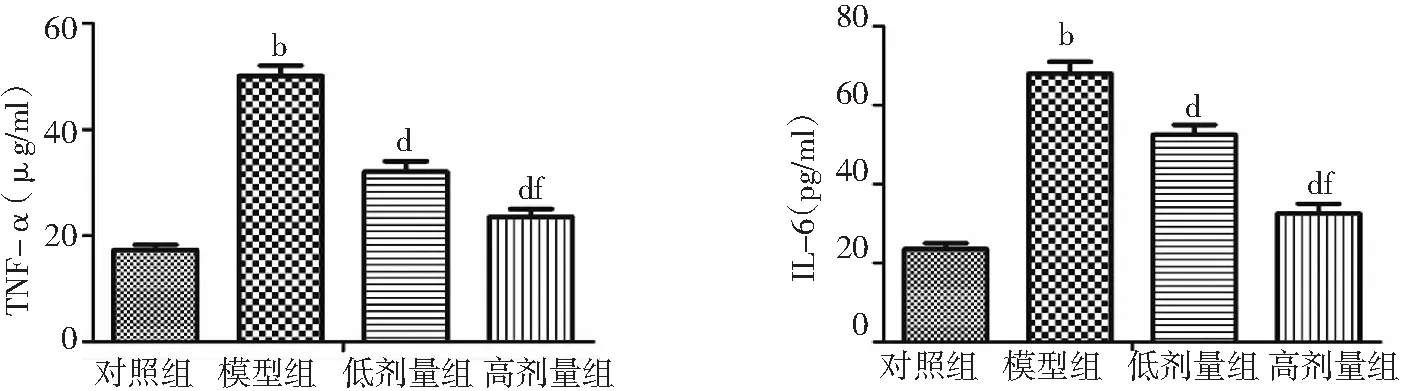
图1 4组大鼠血清中炎性因子水平比较
低剂量组为UTI 75 kU/kg,高剂量组为UTI 150 kU/kg;UTI为乌司他丁,TNF-α为肿瘤坏死因子-α,IL-6为白介素-6;与对照组比较,bP<0.01;与模型组比较,dP<0.01;与低剂量组比较,fP<0.01
2.2大鼠血清中MDA、GSH-Px水平比较 与对照组比较,模型组大鼠血清中MDA含量水平显著升高,GSH-Px含量水平显著降低,差异有统计学意义(P<0.01)。与模型组相比,高剂量组和低剂量组大鼠MDA含量水平显著降低,GSH-Px水平显著升高,且高剂量组上述指标变化更显著,差异有统计学意义(P<0.01)。见图2。

图2 4组大鼠血清中MDA、GSH-Px水平比较
低剂量组为UTI 75 kU/kg,高剂量组为UTI 150 kU/kg;UTI为乌司他丁,MDA为丙二醛,GSH-Px为谷胱甘肽过氧化物酶;与对照组比较,bP<0.01;与模型组比较,dP<0.01;与低剂量组比较,fP<0.01
2.3大鼠脑组织、全血AChE活力及脑组织NMDA受体活性比较 与对照组比较,模型组大鼠全血AChE活力、脑组织AChE活力、NMDA受体Bmax值显著降低,NMDA受体Kd值显著升高,差异有统计学意义(P<0.01)。与模型组比较,低剂量组和高剂量组大鼠全血AChE活力、脑组织AChE活力、NMDA受体Bmax值显著升高,且高剂量组上述指标变化更显著,差异有统计学意义(P<0.01)。见图3。

图3 4组大鼠脑组织及全血AChE活力及脑组织NMDA受体活性比较
低剂量组为UTI 75 kU/kg,高剂量组为UTI 150 kU/kg;AChE为乙酰胆碱酯酶,Bmax为最大结合容量,Kd为平衡解离常数,UTI为乌司他丁;与对照组比较,bP<0.01;与模型组比较,dP<0.01;与低剂量组比较,fP<0.01
2.4大鼠脑海马区SOD1、Pink1及Prdx6表达水平比较 与对照组比较,模型组大鼠海马区SOD1、Pink1及Prdx6蛋白表达显著降低(P<0.01)。与模型组相比,UTI低剂量组和高剂量组大鼠海马区SOD1、Pink1及Prdx6蛋白表达显著升高,且高剂量组高于低剂量组(P<0.01)。见图4。
3 讨论
有机磷农药中毒患者的死亡原因包括胆碱酯酶活性降低和炎症反应。炎性因子包括促炎性因子和抗炎症因子,促炎性因子水平升高,体内炎性因子水平降低,表明体内炎症反应加剧;抗炎性因子升高,体内炎性因子受到抑制,则炎症反应减弱[7-8]。目前研究较多的促炎性细胞因子包括TNF-α、IL-1、IL-6 和IL-8 等[9];抗炎性细胞因子则包括IL-4、IL-10、IL-1等[10]。本研究主要探究了IL-6和TNF-α两种炎性因子,发现UTI低剂量组和高剂量组大鼠血清中TNF-α及IL-6含量水平显著降低,且高剂量组降低更显著,说明UTI可显著降低大鼠农药中毒后体内炎症反应,且随着剂量增加效果更显著。这可能是因为UTI可抑制水解蛋白酶,下调组织细胞的损伤实现降低TNF-α水平;同时UTI可以抑制中性粒细胞弹性蛋白酶的释放,实现抑制 TNF-α及IL-6的释放,达到降低炎症反应的效果。与周慧[11]的报道一致。

图4 4组大鼠脑海马区SOD1、Pink1、Prdx6蛋白表达水平比较
A.SOD1、Pink1、Prdx6蛋白免疫印迹检测结果;B.SOD1、Pink1、Prdx6蛋白表达水平比较;低剂量组为UTI 75 kU/kg,高剂量组为UTI 150 kU/kg;SOD1为超氧化物歧化酶1,Pink1为PTEN诱导激酶1,Prdx6为过氧化物还原酶6,UTI为乌司他丁;与对照组比较,bP<0.01;与模型组比较,dP<0.01;与低剂量组比较,fP<0.01
研究证实氧自由基的含量在有机磷农药中毒患者的死亡中作用关键。雷间红[12]研究表明,农药中毒者体内过氧化反应显著增强。MDA 会引发脂质过氧化反应,产生的系列降解产物可引起细胞代谢及功能障碍,同时MDA的含量可以反映机体受自由基攻击后脂质过氧化及细胞损伤的程度[13]。细胞内氧化程度越高,MDA含量越高。GSH-Px是一种抗氧化保护酶,抗氧化保护酶可清除 H2O2,缓解氧自由基对组织细胞的损伤。当GSH-Px含量水平过低时,清除H2O2能力减弱,体内氧化反应加重。贾书花等[14]报道,SOD、GSH-Px 两者共同作用能有效地阻止组织细胞过氧化的损伤。SOD1是经典的抗氧化酶之一,可有效清除活性氧[12]。机体内SOD1水平越高说明机体清除活性氧的能力越强,当脑组织损伤时期含量会显著降低。Pink1也是抗氧化蛋白,Pink1丢失与神经元的易损性增加有关[13]。中毒后Pink1水平降低,表明大鼠脑组织中神经元受到损伤,且受损程度与Pink1水平呈负相关。Prdx6是一种独特的抗氧化酶,具有过氧化物酶和磷脂酶活性,当大鼠有机磷农药中毒后,其活性会受到显著的抑制[14]。
本研究结果显示,与对照组相比,模型组大鼠体内MDA水平显著升高、GSH-Px水平显著降低,表明大鼠体内氧化反应显著加重。UTI低剂量组和高剂量组大鼠MDA水平显著降低、GSH-Px水平显著升高,且高剂量组上述指标优于低剂量组。说明UTI显著抑制了大鼠体内的氧化应激反应,且随着使用剂量的增加,效果更为显著。谢勇[15]报道,使用UTI可以降低患者体内氧化反应及炎症反应,缓解中毒症状,与本研究得出的结论相一致。本研究中发现使用UTI的各组大鼠海马区SOD1、Pink1及Prdx6蛋白表达显著升高,说明大鼠神经元受到了保护,脑组织神经元得到了显著的保护,与李艳华[16]研究结论一致。
目前AChE活力及脑组织NMDA受体活性也是评价农药中毒程度的重要指标。刘佩强等[17]研究表明NMDA受体与调节呼吸功能的有关,当AChE活力下降会抑制呼吸功能导致患者死亡。本研究发现,使用UTI治疗后大鼠体内的AChE活力显著升高,说明大鼠的呼吸抑制程度得到了显著的缓解。大鼠脑组织NMDA受体的活性有两个重要指标,Bmax和Kd,其中Bmax下降,Kd值上升意味着脑组织NMDA受体密度的减少和亲和力的下降。使用UTI低剂量和高剂量组大鼠Bmax下降和Kd值上升受到了抑制,说明UTI可增加NMDA受体密度,同时升高NMDA受体的亲和力,从而实现保护中毒后大鼠的脑组织。与张虎等[18]报道的UTI可保护中毒后大脑组织结论相一致。
综上所述,大鼠农药中毒后UTI 可保护其脑组织,且在一定浓度范围内呈浓度依赖性,作用机制可能与抑制脑组织和全身炎症反应及氧化反应相关。目前农药种类较多,本实验使用的农药相对单一,在后续实验中将使用不同种类的农药,进一步探讨UTI对不同农药中毒中保护大鼠脑组织效果。
