干细胞源的外泌体调控细胞自噬在心肌损伤中作用的研究进展
2020-02-27
心脏干细胞(cardiac stem cells,CSCs)被认为是修复损伤心肌的最佳途径之一。CSCs 是未分化细胞,表达早期心肌细胞系的转录因子(Nkx2.5,GATA-4,Mef-2)。CSCs的特征是以克隆的方式进行自我更新,并且具有在体外和体内分化为多种心血管谱系细胞的能力,包括心肌细胞、平滑肌细胞和内皮细胞等。在心脏发生病变时,CSCs增殖分化能对心脏的损伤进行修复。以CSCs为基础的治疗方法为心脏损伤后的修复提供了新的途径。但由于干细胞直接移植的生存率非常低,越来越多的研究发现干细胞对于心肌损伤的保护作用可能更多来自旁分泌机制[1]。本课题组在前期研究中发现诱导多能干细胞源的外泌体(exosomes)可以传递对心肌细胞具有保护作用的miRNA-21/210,从而在心肌缺血再灌注后通过抗心肌细胞凋亡来保护受损伤的心肌[2]。 现就干细胞源的Exosomes和自噬在心肌损伤修复中的作用做一综述。
1 Exosomes与心肌损伤
1.1 Exosomes的特征与功能 Exosomes是一种可由多种细胞分泌的纳米级膜性囊泡,在电镜下其外观是一种特征性的“蝶形”小体,直径为30~100 nm。研究表明,Exosomes内含有细胞特异性的信号分子、蛋白质、mRNA和miRNA。体外实验表明,这些遗传物质可以在靶细胞中翻译与表达,在细胞间进行信息传递。Exosomes介导的信息传递方式[1]:①Exosomes膜配体可以激活受体或下游的信号通路;②Exosomes内含有活化的受体,可以在细胞之间转运;③Exosomes内含有蛋白质,可以进行蛋白质的传递;④Exosomes内含有miRNA和RNA,可以进行遗传物质的传递。
Exosomes具有小的双层脂质膜,其可被大多数细胞释放并可在大多数体液中检测到。Exosomes通过将其包含的生物活性物质(如蛋白质和核酸)转移到受体细胞或激活靶细胞中的信号传导途径来发挥细胞间通讯的关键功能[3-4]。前期实验证实,通过PKH26 标记 Exosomes 后加入正在培养的细胞培养基里,2 h后荧光显微镜下可以观察到PKH26标记的Exosomes 进入细胞浆内,因此,证明Exosomes可以在细胞之间穿梭从而发挥信息传递作用[2]。另外,Exosomes还可以用作在体及离体实验中的药物载体而用于治疗[5]。
1.2 Exosomes与旁分泌 相关研究表明,注射入体内的干细胞本身并不是通过分化增殖产生新的心肌细胞而导致心脏功能改善,其中的机制显然是一种旁分泌作用,即这些细胞释放某种让心脏变得更好的“物质”[6]。Sahoo等[7-8]发现CD34+的干细胞中提取的Exosomes富含促血管生成的miR-126,可以促进心肌梗死后新生血管的形成。Exosomes具有潜在的心肌保护作用,这种保护作用可能与其携带的信息分子、蛋白质、miRNA、RNA相关[9-10]。Gallo 等[11]研究发现,血清和唾液中可被检测到的miRNA多数集中在Exosomes。Ji等[12]在实验中证实血浆miR-208可以作为心肌损伤标志物,异丙肾上腺素诱导的心肌损伤后,miR-208的血浆浓度显著增加。Exosomes携带的miRNA可能会成为心血管疾病新的生物标志物及治疗靶标[13-16]。
1.3 miRNA与心肌损伤 miRNA是一类在基因转录后水平调控目的基因的功能性小RNA。Eulalio等[17]发现外源性miRNAs能显著刺激心肌细胞增殖,促进心脏修复,通过高通量技术筛选出了40多种能显著促进新生小鼠和大鼠心肌细胞DNA合成和胞质分裂的miRNA,进一步研究证实miR-590和miR-199a可以促进成体心肌细胞周期重启,促进新生动物和成年动物的心肌细胞增殖。Wang等[18]研究发现,miRNA-103/107可以通过靶向Fas相关死亡结构域蛋白(Fas-associating death domain protein,FADD)调节程序性坏死和心肌缺血/再灌注损伤。Xie等[19]通过减少高迁移率族蛋白B1(HMGB1)表达来研究miR-451是否保护心肌细胞缺氧/复氧(A / R)损伤,发现在A/R期间心肌细胞中miR-451的表达显著降低,进一步研究发现miR-451的上调可以显著减弱A/R期间心肌细胞活力的损失和增加细胞内超氧化物歧化酶(SOD)水平,表明miR-451的上调可以通过抑制HMGB1的表达来防止A/R诱导的心肌细胞损伤。但促进心肌修复的miRNA的筛选及干预时机尚待进一步研究。
2 自噬与心肌损伤
2.1 自噬的特征与分类 自噬是一种在真核生物中高度保守的细胞降解和再循环过程。在哺乳动物细胞中,自噬有3种主要类型:大自噬(macroautophagy)、小自噬(microautophagy)和分子伴侣介导的自噬(chaperome-mediated autophagy,CMA)。虽然每个在形态上并不相同,但这3种自噬方式最终都在向溶酶体输送货物以进行降解和再循环。大自噬依靠新形成的双层膜囊泡——自噬体,可以隔离待降解物质并将其运送到溶酶体内,小自噬通过溶酶体膜的内陷直接捕获待降解物质,伴侣介导与小自噬不同,它不使用膜结构来隔离待降解物质,而是利用分子伴侣识别待降解物质上含有特定肽链的蛋白,直接将未折叠蛋白转运到溶酶体膜上。自噬是细胞的一种自我保护机制,但过度自噬往往是有害的。通过对细胞自噬的调控来治疗疾病已经成为一个极具潜力的研究方向。
2.2 自噬与干细胞 研究发现,血液的产生是由稀有的、自我更新的造血干细胞(HSC)来保证的,而自噬是保护造血干细胞免受代谢应激的重要机制[20]。研究发现,在新鲜分离的年轻小鼠造血干细胞和分化的HSC子细胞(其中包括免疫细胞粒细胞和巨噬细胞的祖细胞)中,自噬很少发生或不发生,而当细胞处于饥饿状态时,自噬会被加速诱导,而在这样的压力状态下,主动抑制自噬,造血干细胞会快速凋亡[21]。研究证实自噬可以有效抑制造血干细胞的新陈代谢,最终保存了造血干细胞的自我更新能力[22]。缺血性心脏病的治疗中,科学家越来越多寄希望于心脏干细胞移植,这其中细胞自噬对维持细胞稳态发挥着非常重要的作用,研究发现在干细胞治疗中Exosomes、miRNAs和细胞自噬可能协同发挥作用[23]。有研究证实,心脏干细胞来源的Exosomes高表达miRNA-451[24],可以作为一种非细胞的载体保护缺血再灌注损伤。有报道miR-451直接靶标结节性硬化症蛋白1(TSC1)是细胞自噬的正向调控因子,可以对缺血心肌细胞起到保护作用[25]。
在心脏发育的各个阶段细胞自噬都发挥着重要作用,在斑马鱼心脏胚胎发育中,敲除自噬基因Beclin1、 Atg5和 Atg7会引起细胞死亡和复杂的心脏结构异常[22,26]。Decker等[27]研究发现,缺血再灌注损伤可诱导心肌细胞发生自噬,在对兔的心肌细胞进行20~40 min的缺氧处理后,自噬泡开始出现,而当氧供恢复后,自噬泡数量明显增加,且在急性或慢性缺血条件下自噬均可被启动,在再灌注阶段自噬又会进一步增强。在急性心肌梗死的修复损伤心肌的治疗中干细胞一直以来都是临床寻求的一个非常有效的方法和途径,干细胞移植中有很多机制在发挥作用,这其中调控细胞自噬是干细胞发挥修复损伤心肌的重要作用之一[28-30],详见图1。也有研究证实,一些天然产物比如白藜芦醇、黄连素、姜黄素可以调控细胞自噬来参与心血管疾病的损伤修复[31]。
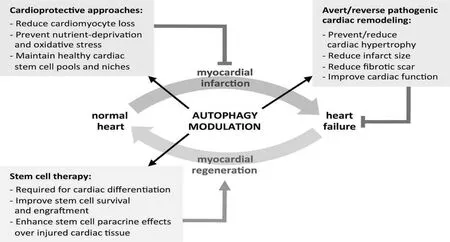
图1心肌梗死和心力衰竭发生过程中自噬促进心肌再生的示意图
3 问题与思考
心脏干细胞尽管在临床治疗心肌梗死后心肌损伤修复中可能会有非常好的应用前景,但移植细胞的高死亡率、移植的途径及移植细胞带来的风险仍是限制干细胞在临床应用的主要问题。细胞自噬具有维持细胞自稳的功能,Exosomes特异的miRNA是否通过调控心肌细胞自噬从而参与心肌细胞损伤的修复受到越来越多的关注。
