血脑屏障及其体外模型研究进展
2020-02-26周俊杰刘晓东
周俊杰,刘晓东
(中国药科大学药学院药物代谢研究中心,江苏 南京 210009)
血脑屏障(blood-brain barrier,BBB)是介于血液循环系统和脑部中枢神经系统(central nervous system,CNS)之间的一种动态界面,通过严格调节血液和脑部的物质交换,维持脑部内环境的稳态平衡和实现正常的CNS 功能[1]。BBB 在保护CNS 的同时,也使新型神经系统药物的开发要远落后于其他药物,其中的部分原因是药物在CNS 中的代谢动力学行为不佳[2],而在临床应用中CNS 活性药物数量较少的原因是大多数药物难以穿过BBB[3]。在药物开发过程中,一方面需要可靠的方法来筛选易通过BBB 的候选药物,另一方面要确定作用于外周的物质不会穿过BBB,以避免CNS 副作用[4]。体外研究有着比体内研究更加可控、简单易操作、使用的动物数量较少,以及更加符合伦理学的优点[5]。随着对BBB 研究的深入及各种新型技术的产生,各种高仿真、高效筛选、可重复的体外模型被应用到药物的开发和对BBB 的生理特性探究中。本文从BBB 的结构和功能特征出发,综述了构成BBB 的主要细胞及其特点,解释了BBB 高效屏蔽作用的原因,并基于此介绍了BBB 的特征标志物,为评价BBB 体外模型的优劣提供了参考。此外,列举了可用于构建体外BBB 模型的不同种属的细胞,分析了其优缺点及适用范围,为体外BBB 模型的应用提供了理论依据。
1 血脑屏障的组成
血脑屏障主要由脑微血管内皮细胞(brain microvascular endothelial cell,BMEC)、星形胶质细胞、周细胞和基膜构成[6]。内皮细胞构成毛细血管壁,因此是BBB 的主要屏障。星形胶质细胞终足包裹着BMEC(覆盖率约为99%)[7],细胞分泌的基质蛋白构成基膜,周细胞镶嵌在胶质细胞和BMEC 的基膜中[8](见图1)。虽然内皮细胞的物理屏障是BBB 的主要构成部分,但一些物质也可以经由BBB 上的蛋白转运体和囊泡进出,此外,CNS中的其他细胞对于诱导和维持BBB 的正常功能也是至关重要的[9]。为了讨论体外细胞模型的构建,以下先简要介绍这几种细胞的特性。
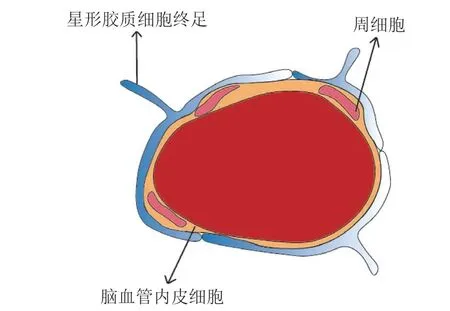
图 1 神经血管单元结构示意图Figure 1 Schematic overview of the structure of the neurovascular unit
BMEC 是一种特殊的内皮细胞。与外周内皮细胞相比,BMEC 在结构上有更多的线粒体和更少的质膜小泡[10],在功能上,BMEC 可形成比外周内皮细胞更紧密的毛细血管内皮[11],这使得BBB 基本上不能透过极性分子。紧密连接(tight junctions,TJ)填补了BMEC 之间的间隙,并通过表达TJ蛋 白(tight junction protein,TJP) 如occludin、claudins 和zonula occludens(ZOs, 包 括ZO-1、ZO-2、ZO-3)等来限制细胞旁通透性[12]。亲脂性的小分子如氧气和二氧化碳等可通过自由扩散透过BMEC,其他分子则需借助特殊的转运体[13]。这些转运体主要分为2 类:一是外排转运体,它将可能透过BBB 的亲脂性分子外排至血液[14],例如P-糖蛋白(P-gp)和乳腺癌耐药蛋白(BCRP);二是高度特异性的营养转运体,它可促进特定的营养物质通过BBB 进入CNS 中,以及从CNS 中排出特定的废物[15],例如葡萄糖转运蛋白,单羧酸转运蛋白等。因此,物理屏障作用(TJ、低胞吞作用),分子屏障作用(外排转运蛋白)以及特定营养物质转运蛋白构成了BBB 的主体,共同调节CNS 的稳态。
星形胶质细胞是大脑中最主要的胶质细胞[16],其终足约覆盖了血管表面99%,并且含有一系列与基膜紧密结合有关的蛋白[17]。星形胶质细胞连接着神经细胞和血管,可以介导它们之间的信号传播,使脑部毛细血管能够响应神经细胞的活动[18]。在体外研究中,已经发现星形胶质细胞可以诱导增强非CNS 血管的屏蔽作用[19],且在与BMEC 共培养过程中,显著增加了细胞的跨内皮电阻(transendothelial electric resistance,TEER),降低了多种物质的通透性[20-21]。这表明星形胶质细胞是BBB 结构和功能的重要组成部分。
周细胞是夹在BMEC 和星形胶质细胞终足之间,镶嵌在BMEC 基膜上的一种细胞[22],覆盖毛细血管表面约30%[7],且覆盖率与BMEC 通透性呈负相关。周细胞可以调节BMEC 中BBB 特异性基因的表达和诱导CNS 中星形胶质细胞终足的极化[23]。体外研究表明,周细胞可以使BMEC 与星形胶质细胞共培养BBB 模型中TEER 增加,并使得TJP 的表达增多[24-25]。这说明周细胞在BMEC 和星形胶质细胞功能的整合和BBB 功能的调节中起着关键性的作用。
除了上述3 种主要细胞外,还有其他种类的细胞和一些组织共同构成BBB。基膜是BMEC 和周细胞分泌的高度特化的细胞外基质,主要由4 种蛋白组成(Ⅳ型胶原蛋白、层黏连蛋白、巢蛋白、硫酸乙酰肝素蛋白聚糖),可为临近细胞提供结构支持,介导脉管系统中的信息传递,也为BBB 提供了额外的屏障[26]。神经元可通过影响BMEC 和星形胶质细胞来间接调节BBB 通透性[27],小胶质细胞主要起免疫作用,且可促使受损的BBB 修复[28]。
2 血脑屏障模型的主要标志物
由于对体内BBB 的研究还不够完善,难以建立一个能完全模拟体内BBB 的模型,且对模型的评价仍不全面。但随着蛋白组学技术的发展,研究人员发现一些重要蛋白的表达和功能对模型十分重要,可作为评价模型优劣的标志,故本综述列出几种主要的BBB 体外模型标志物[29]。
TJ 主要由跨膜蛋白和细胞质肌动蛋白构成,包含40 多种蛋白[30]。BBB 中TJ 的形成目前还没有明确的定论,但有研究表明周细胞和星形胶质细胞可通过分泌生长因子来促进TJ 的形成[31]。TJ 使BMEC 致密地结合在一起,构成了BBB 的高阻抗物理屏障,使得大部分物质难以通过细胞旁通路进入BBB[32]。
TJP 主要包含claudins、occludins、junction adhesion molecule(JAM) 和ZO[33]。 其 中,claudins 和ZO直接参与上皮细胞中TJ 的形成,起主要作用,而JAM 和occludins 等起辅助合成蛋白的作用[34-36]。许多TJP 如claudin-5、claudin-12、ZO-1 和ZO-2 在皮肤表皮、肾脏和呼吸道等其他组织和器官中都有表达[37],但在BBB 中的表达比其他部位都要高,这是BBB 比其他组织对于物质的运输限制性更强的原因之一。
TEER 是体外细胞培养模型中评价细胞屏障完整性的重要指标,可以在一定程度上反映TJP 的表达水平,但由于测量设备、温度、细胞培养环境等差别,TEER 值在不同的报道中有很大变化,难以直接比较[38];也可通过测量一些亲水性的示踪物质如荧光黄、荧光素钠、甘露醇、异硫氰酸荧光素-葡聚糖等的渗透率(Papp)来评价体外模型屏障的完整性,但由于分子的大小、实验方法(设备、采样时间等)的不同,也会有所差异。故常用以上2 种方法,结合Western Blot 实验共同评价TJP 的表达[39-40]。
BBB 细胞主要表达2 种转运体,即特异性的营养转运体和外排转运体。其中SLC 家族编码的蛋白和ATP 结合盒(ATP-binding cassette,ABC)转运体占据主导地位[41]。
大多数营养物质转运体属于SLC 转运体,如SLC2A1(转运葡萄糖)、SLC16A1(转运乳酸、丙酮酸),以及SLC7A5(转运中性氨基酸)等[42],这些物质会借助转运体顺浓度梯度进入CNS 中。还有一些受体介导的转运蛋白,如转铁蛋白、低密度脂蛋白受体相关蛋白(LRP1)等可以定向转运这些物质[43-44]。另外还有几种从脑内排出废物的蛋白,如Ager 等,对于维持CNS 的稳态也十分重要[32]。
外排转运体包含P-gp、BCRP 和多药耐药相关蛋白(MRP)等[45]。这些转运体利用消耗ATP 水解产生的能量,将潜在的可能通过BBB 的亲脂性小分子物质排出至血液中[46]。利用体外模型来研究这些外排转运体的底物,可以评价药物进入CNS 的能力,从而开发外排量小、易于进入CNS 发挥作用的药物。同时,也可开发转运体的抑制剂,协助小分子药物进入CNS。
3 常用的血脑屏障体外模型
体外BBB 模型的构建常用原代细胞和永生化的细胞株[32]。原代细胞是从动物组织直接消化培养的细胞,保持了组织原本的基因表达特性。而永生化的细胞系又有培养简单、易于改造、繁殖较快且多代内稳定遗传的特点。不同种属的细胞系又有不同的特征,常用的几个指标如TEER、Papp和一些蛋白的表达都有差异[4,47],故介绍几种BBB 体外模型构建常用的细胞,为不同目的的研究提供参考。根据模型能否模拟体内血液流动产生的剪切应力,可将模型分为静态模型和动态模型[48]。
3.1 静态模型
静态模型不能模拟血液流动产生的剪切应力,根据使用的细胞种类和培养方式,又可分为单独培养和共培养(见图2)。
3.1.1 单独培养 单独培养模型一般是将脑血管内皮细胞接种到Transwell 膜上(见图2A)。Transwell 呈小杯状,有一层孔径为0.4 ~ 8 μm 的微孔膜(一般是聚酯膜)将装置分为上下两室。微孔膜被胶原包被,有利于细胞黏附在其表面。上室模拟血液侧,下室模拟血管内侧,小分子、营养物质和一些特异性的生长因子可以进行交换,但细胞却不能在上下室迁移,可以简单模拟脑血管内皮细胞在BBB 上的作用。一般用于研究药物通透性、肿瘤药物毒性等[49]。
原代大鼠脑血管内皮细胞最早被用来构建体外BBB 模型[50],之后又研究开发出了永生化的大鼠脑血管内皮细胞系如GP8、RBE4 等,这些细胞单独培养都保持了内皮细胞的特性[4,51]。在用于构建BBB 体外模型的细胞中,人脑原代细胞无疑是最佳选择。然而由于伦理原因,很难稳定获取大量的细胞用于研究。hCMEC/D3 是一种很好的永生化人脑微血管内皮细胞系,已有大量使用该种细胞研究脑血管相关功能的报道[52]。hCMEC/D3 表达一系列的TJP,如claudin-3、claudin-5、occludin、ZO-1和ZO-2;以及表达一系列的细胞极性蛋白质,如细胞极性蛋白(Par)-3、Par-6 和蛋白激酶(PKCz)等[53-55]。这使得常规培养的hCMEC/D3 可形成一层物理屏障。然而与人脑微血管相比,claudin-5、occludin 的表达却降低[56]。在使用单独培养的hCMEC/D3 细胞作为模型研究阿尔茨海默病时,发现其TEER 较低,虽然对大分子FITC-葡聚糖的屏障作用较好,但对小分子的渗透率却较高。在研究阿尔茨海默病的特征蛋白β-淀粉样蛋白的通透性时,发现从底侧到顶端方向几乎没有屏障作用[57]。这表明hCMEC/D3 单独培养不适合药物和蛋白的渗透性实验。现已有多种方法来增加hCMEC/D3 的物理屏障作用,如2D/3D培养,用氢化可的松或氯化锂处理,都可使TJP 表达增加[52,58-59]。
在转录水平发现该细胞株表达100 多种SLC 转运蛋白,包括SLC2A1 (Glut-1)、SLC7A5 (LAT-1)和 SLC16 (MCT) 家族的一些蛋白[60],其中Glut-1 的表达与人脑微血管相似[60]。同样还发现了特异性的受体,如胰岛素受体和转铁蛋白受体[61]。hCMEC/D3在mRNA 水平上表达23 种ABC 转运体,包括P-gp、MRP-4 和 BCRP 等,在蛋白水平上P-gp 和BCRP也有较高表达[60,62-63]。
以上表明,hCMEC/D3 是一种易于获取、经济实用、可特异性表征人脑微血管内皮的细胞系,比较适用于药物摄取和病理模型研究。
3.1.2 共培养 共培养根据细胞的种类分为双层共培养和三重共培养。双层共培养常用的是脑血管内皮细胞-星形胶质细胞/周细胞共培养,主要分为2 种模式。一种是星形胶质细胞/周细胞接种在细胞培养板底,将接种BMEC 的Transwell 置于板上;另一种是星形胶质细胞/周细胞接种在Transwell 微孔膜的另一边,与BMEC 接近但不直接接触,可以有更多细胞间相互作用(见图2B)。三重共培养常在Transwell 微孔膜上部接种BMEC,底部接种周细胞,细胞培养板底接种星形胶质细胞,或者周细胞和星形胶质细胞位置对调[24](见图2C),此外神经细胞也可用于三重共培养中[64],与上述培养方式相比,更能体现出神经细胞对于血管内皮细胞的调控作用,还可将药物穿过血脑屏障和在脑内的代谢过程结合起来,更能表征BBB 动态调节的特点。共培养与单层培养相比,可表达更多的TJP 和特异性转运体,有更高的TEER 和更低的渗透率,能更好地表征BBB 特性[24]。共培养模型装置简单,操作便捷,可广泛应用于新药筛选、药物渗透率评估、细胞间相互作用和脑部疾病模型等方面的研究。
小鼠BBB 体外细胞模型常用小鼠原代脑血管内皮细胞和星形胶质细胞共培养,该模型具有典型的BBB 特性,例如表达claudin-3、claudin-5 和P-gp 等蛋白以及较高的TEER[65],是一种良好的体外BBB 模型。此外,永生化的小鼠脑血管内皮细胞如bEnd3、bEnd5 也常被用作体外研究,RT-PCR 分析表明这2 种细胞系可表达TJP 如:ZO-1、ZO-2、occludin和claudin-5,同时一些转运体如GLU-1、P-gp和BCRP 也有表达[66-67],这表明它们是优良的BBB模型细胞系。但有研究表明,这2 种细胞株单独培养以及与胶质细胞共培养,对于细胞旁通路并没有显著性差异,表明这2 种细胞系不适用于药物渗透性的研究[68]。
大鼠体外BBB 模型最常见的是BMEC 单独培养,近来研究表明与星形胶质细胞共培养能进一步表征BBB,而与星形胶质细胞和周细胞三重共培养则具有更为显著的BBB 特性[24,69]。3 种体外模型都表达TJP 如claudin-5、occludin 和ZO-1,但共培养模型中claudin-5 和ZO-1 的表达要高一些[24,70-71]。原代细胞在体外培养过程中会出现一定程度的去分化现象,研究表明,单独培养的内皮细胞中一些转运蛋白表达会下调,特别是Glut-1、P-gp 和转铁蛋白受体,在与星形胶质细胞共培养的模型中也出现了这种现象[39,72]。尽管如此,在共培养模型的mRNA和蛋白质水平上,P-gp、BCRP 和MRP 的表达仍是显著的[24,73],且有体外实验证明了P-gp 和BCRP仍有正常功能[39,71]。在一项研究中,研究者将体外大鼠原代BMEC 和星形胶质细胞在氢化可的松和cAMP 存在的条件下共培养,并测定了一系列物质在该模型中的通透性,如亲脂性的秋水仙碱、长春新碱;亲水性的菊粉、蔗糖;典型的外排转运体底物、罗丹明-123、哌唑嗪以及对照药物地西泮等,同时使用这些药物在大鼠中进行原位脑灌流实验。结果表明,体内外实验结果具有良好的相关性(R= 0.94)[74],表明该共培养模型具有实际科研价值。
大鼠BBB 体外模型的主要优点是可以建立同源的共培养模型,体外的实验数据可以与同品系的在体数据相关联,具有一定的实用参考价值。同时大鼠作为广泛使用的模式动物,易于获得,遗传背景较为清晰,有大量的抗体可用于科学研究,故大鼠体外BBB 模型的使用非常广泛。
除此之外,猪和牛的原代细胞也可用来构建体外BBB 模型。以原代猪脑血管内皮细胞构建的BBB 模型,有较高的TEER[5],且表达BCRP 与P-gp的比值接近于猴和人类[75]。牛也表达一系列BBB特征蛋白,有较高的TEER[40]。但猪和牛的体型较大,不同国家和地区使用的品系也很难相同,相应的科研技术支持还不够完善,故使用受到一定限制。
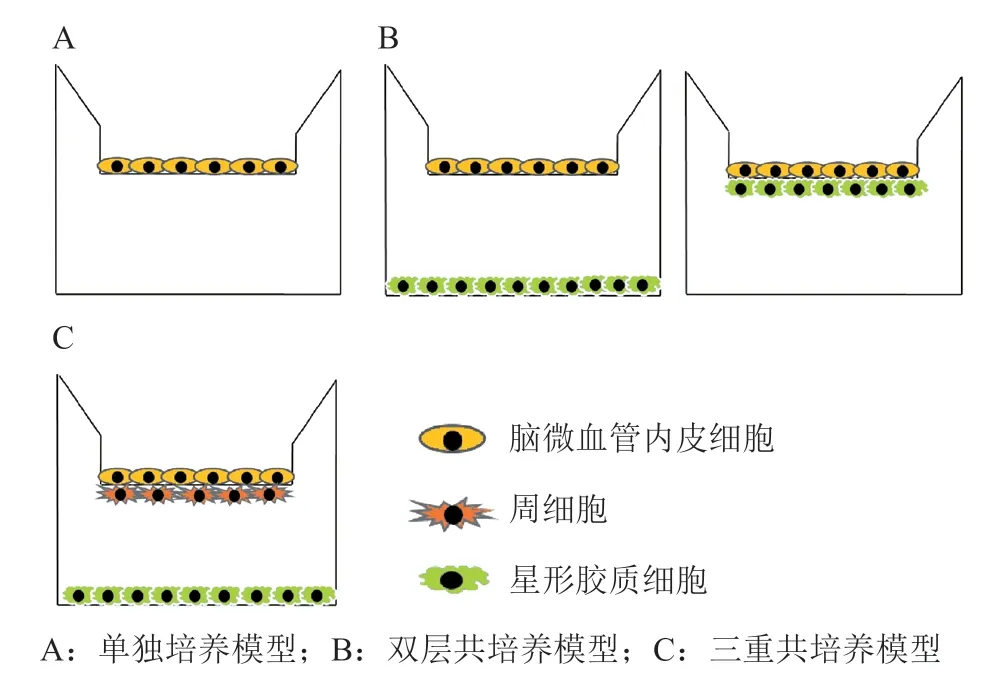
图 2 血脑屏障静态模型 Figure 2 The static models of blood-brain barrier
3.2 动态模型
体外BBB 模型研究表明,血液流动产生的剪切应力可促进一些TJP 和转运体的表达,增强BBB 的屏障作用[76]。故BBB 动态模型就是利用各种材料和装置,为培养的细胞模拟一个类似体内血液流动的环境。随着实验技术的发展,BBB 模型已趋向于集成化和微小化,然而不同的实验室使用的装置和材料各不相同,模型的适用范围也各异,故很难系统地将动态模型分类叙述。本文依据细胞培养的方式,大致将BBB 体外动态模型分为纤维管动态模型和平面微孔膜动态模型。
3.2.1 纤维管动态模型 纤维管动态模型即以中空的纤维管模拟脑部微血管,在管内壁接种BMEC,外壁接种星形胶质细胞来模拟脑微血管被星形胶质细胞终足包裹的生长状况。管道外接恒流泵和气体交换装置,为细胞生长提供营养(见图3A)。在使用牛主动脉内皮细胞和C6 神经胶质细胞共培养的纤维管动态模型中,其TEER 值比同样条件下培养在Transwell 中的模型要高10 倍以上[77],对蔗糖和苯妥英的通透性比在Transwell 模型中降低了90%和80%[78],这表明在纤维管内流动产生的剪切应力对BBB 模型的屏障作用非常重要。此外,该模型还可以用于脑部的病理研究,通过控制培养基中的氧气含量,可以模拟脑部的缺血再灌注损伤[79];可以培养癫痫病人的微血管内皮细胞,来研究癫痫患者BBB 生理功能的变化[80]。然而,此模型也有一些不足,首先,无法直接观测纤维管中细胞的生长状态;其次,构建纤维管装置和接种细胞有一定的技术难度;第三,较难收集纤维管中的细胞来研究其生理特性。
3.2.2 平面微孔膜动态模型 平面微孔膜动态模型通常分为上下2 个腔室,中间由微孔膜(大多是聚酯膜)隔开,细胞可以培养在膜上和腔室内部,构成类似Transwell 共培养的结构,体系内同样有流动的培养基提供营养物质(见图3B)。最简易的一种模型是微流体BBB 模型,将BMEC 接种在聚酯膜上,星形胶质细胞接种在下腔室内,或使用培养过星形胶质细胞的培养基灌注,构成动态的BBB 模型。装置内可加装电极来测定TEER,也可用来研究BBB对药物的通透性[81]。在此基础上,可以对装置进行各种改造,来实现研究目的。在一项报道中,研究者在下腔微孔通道里增加了3D 细胞培养室,使得该模型不仅能用来评价药物通过BBB 的能力,还可用来评价该药物对于培养室中细胞的作用[82]。平面微孔膜模型相对于纤维管模型而言,便于观察细胞的生长状况,需要的细胞数量较少,且对技术的要求也较低,是一种易于实现的动态模型。
相比于静态模型,动态模型的构建方法较多,装置各异,各有优缺点,应结合实验研究目的来选择。
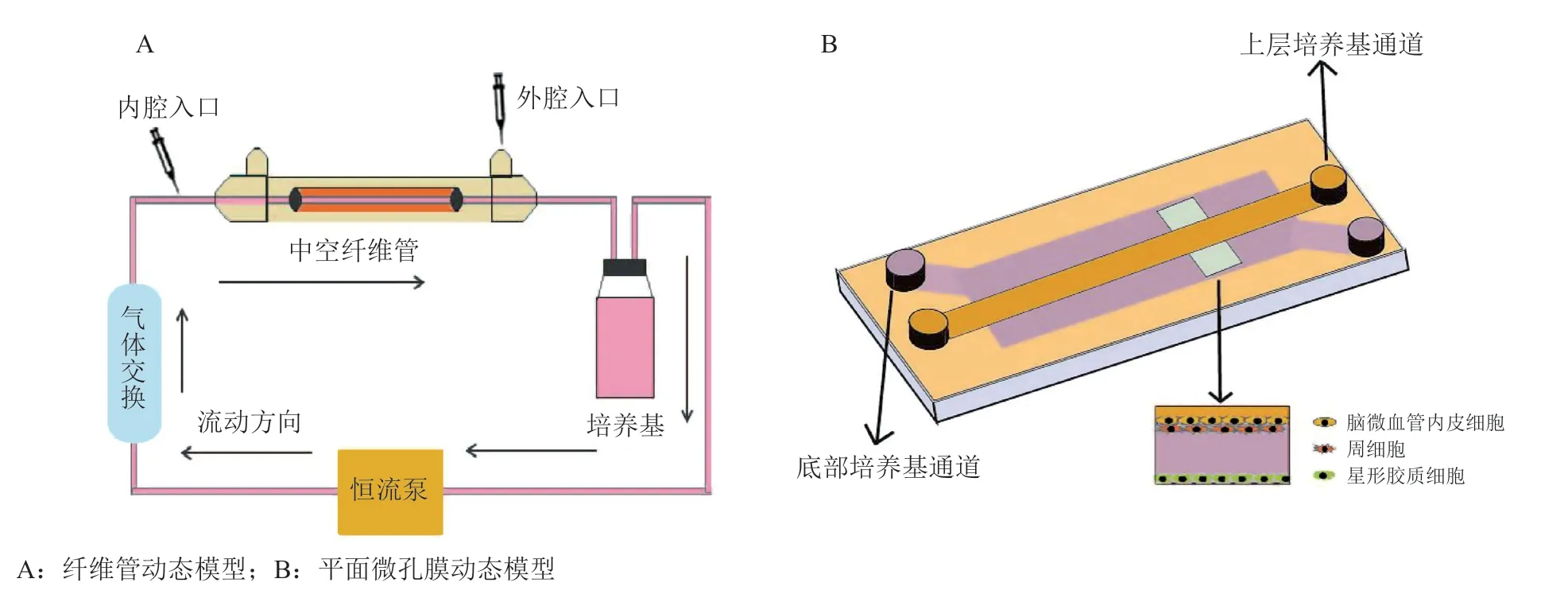
图 3 血脑屏障动态模型Figure 3 The dynamic models of blood-brain barrier
4 结语
血脑屏障体外模型的构建从一开始的单独培养脑血管内皮细胞,到与星形胶质细胞和周细胞共培养,再到可调节细胞微环境的动态微控系统,都一步步向着更贴近于模拟体内真实的环境发展。随着对血脑屏障研究的深入,会有越来越完善的BBB 体外模型被构建出来,应用于各种科研与药物开发中。体外模型虽然无法替代体内实验,但与在体实验相比,有着操作简单、条件可控、经济实用,以及减少动物使用、更符合伦理学的优点,在药物渗透性及血脑屏障生理病理的研究中仍有不可替代的作用。在实际科研与药物开发过程中,应根据研究的目的来选择合适的模型。
