药用大豆磷脂高含量组成物的拉曼光谱特征峰及其分析方法研究进展
2020-02-26安远陈峰顾宁
安远,陈峰,顾宁,*
(1. 东南大学生物科学与医学工程学院,江苏 南京 210096; 2. 南京医科大学生物医学工程与信息学院,江苏 南京 211166)
大豆磷脂通常由磷脂酰胆碱(phosphatidylcholine,PC)、磷脂酰乙醇胺(phosphatidylethanolamine,PE)、磷脂酰肌醇(phosphatidylinositol,PI)和磷脂酰丝氨酸(phosphatidylserine,PS)等组分构成,在化妆品、食品、药物与医疗保健品行业占有重要的地位[1]。随着先进药物输运系统的不断改进,基于磷脂分子等组装体携载治疗成分甚至协同发挥作用的高端药物研究也层出不穷[2-4]。
目前,基于拉曼光谱技术的大豆磷脂分析研究对象主要有PC 和PE。大豆磷脂中,PC 中含量较多的成分为二棕榈酰磷脂酰胆碱(1,2-dipalmitoyl-snglycero-3-phosphocholine,DPPC,1)、二硬脂酰磷脂酰胆碱(1,2-distearoyl-sn-glycero-3-phosphocholine,DSPC,2)、二油酰磷脂酰胆碱(1,2-dioleoyl-snglycero-3-phosphocholine,DOPC,3)和二亚油酰磷脂酰胆碱(1,2-dilinoleoyl-sn-glycero-3-phosphocholine,DLPC,4)[5];PE 中含量较多的成分为二硬脂酰磷脂酰乙醇胺(1,2-distearoyl-sn-glycero-3-phosphoethanolamine,DSPE,5)和二油酰磷脂酰乙醇胺(1,2-dioleoyl-snglycero-3-phosphoethanolamine,DOPE,6)[6]。这 些组分的拉曼光谱及其特征峰已被独立研究,且从不同方面对其特征峰的研究、分析已有相关报道。近年来,在药物生产工艺中,与大豆磷脂的提取物相关的生产环节对质量控制的要求越来越高,而拉曼光谱分析可以有效满足这些要求。本文对药用大豆磷脂的拉曼光谱特征峰及其分析方法进行归纳整理,有助于进一步研究药用磷脂的质量控制及检测方法。
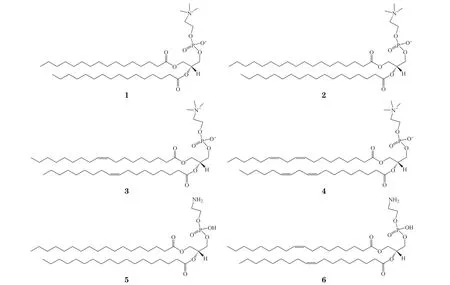
1 大豆磷脂中磷脂酰胆碱的拉曼光谱特征峰
PC 的结构由1 个亲水的头基和2 个疏水的酰基链构成。其中,头基的顶端是1 个N 原子连接3 个甲基,疏水的酰基链由含C 链的棕榈酰、硬脂酰、油酰、亚油酰等酰基链组成。
DPPC 的拉曼光谱特征峰集中分布于多个区间。715 cm-1附近的峰与DPPC 胆碱残基中C-N键振动相关[7];1 000 ~ 1 200 cm-1为C-C 拉伸模式区域,可以基于分别代表偏转构象和反式构象的1 090 和1 130 cm-1处特征峰的强度比值I1090/1130,解析不同浓度和温度下DPPC烷基链构象的信息[8];1 200 ~1 600 cm-1为C-H 键变形密集的区域,主要的峰在1 157、1 184、1 300、1 440 和1 455 cm-1;1 733 cm-1附近的峰包含羰基拉伸振动的信息[9];2 080、2 090、2 100 和2 190 cm-1在通过氘原子取代DPPC 中H 原子的研究中提供了重要信息[10-12];在2 800~3 100 cm-1的特征峰提供了烃链的C-H拉伸模式、DPPC 烷基链之间相互作用以及DPPC构象相关的信息[8,13-14],其中2 850 ~ 2 880 cm-1的特征峰对分子间振动耦合敏感,因此对烃链的横向堆积敏感[15]。
在文献中提到的关于DPPC 特征峰比值的意义中,有几个值得关注的部分。I1090/1130和I2844/2880代表了不同浓度和温度下DPPC 烷基链构象的信息[13],同时也反映了脂质的相态[16];I2935/2880则代表了脂质双层的流动程度[13,16]。
由于分子结构的改变可以导致拉曼光谱特征峰的强度和位置发生变化,利用这种关系,可以分析新形成的化合物的结构变化以及与其他结构结合的位点。由DPPC 的拉曼光谱特征峰(见图1)与其分子结构可知,DPPC 头部与其他结构的结合情况以及构象变化可反映在715、1 055、3 033 及3 042 cm-1的峰值处;2 条C 链的结构变化体现在1 000 ~ 1 200 cm-1及1 733 cm-1的部分峰值处;DPPC 尾端的甲基的峰值和位置变化反映在1 455、2 847、2 938 cm-1等峰值处[7-20]。由于光谱峰值和分子的结构存在直接的对应关系,我们假设二者存在一个函数关系,可以将结构和光谱变化联系在一起,通过计算光谱特征峰位置或积分面积的变化来研究化学反应过程。
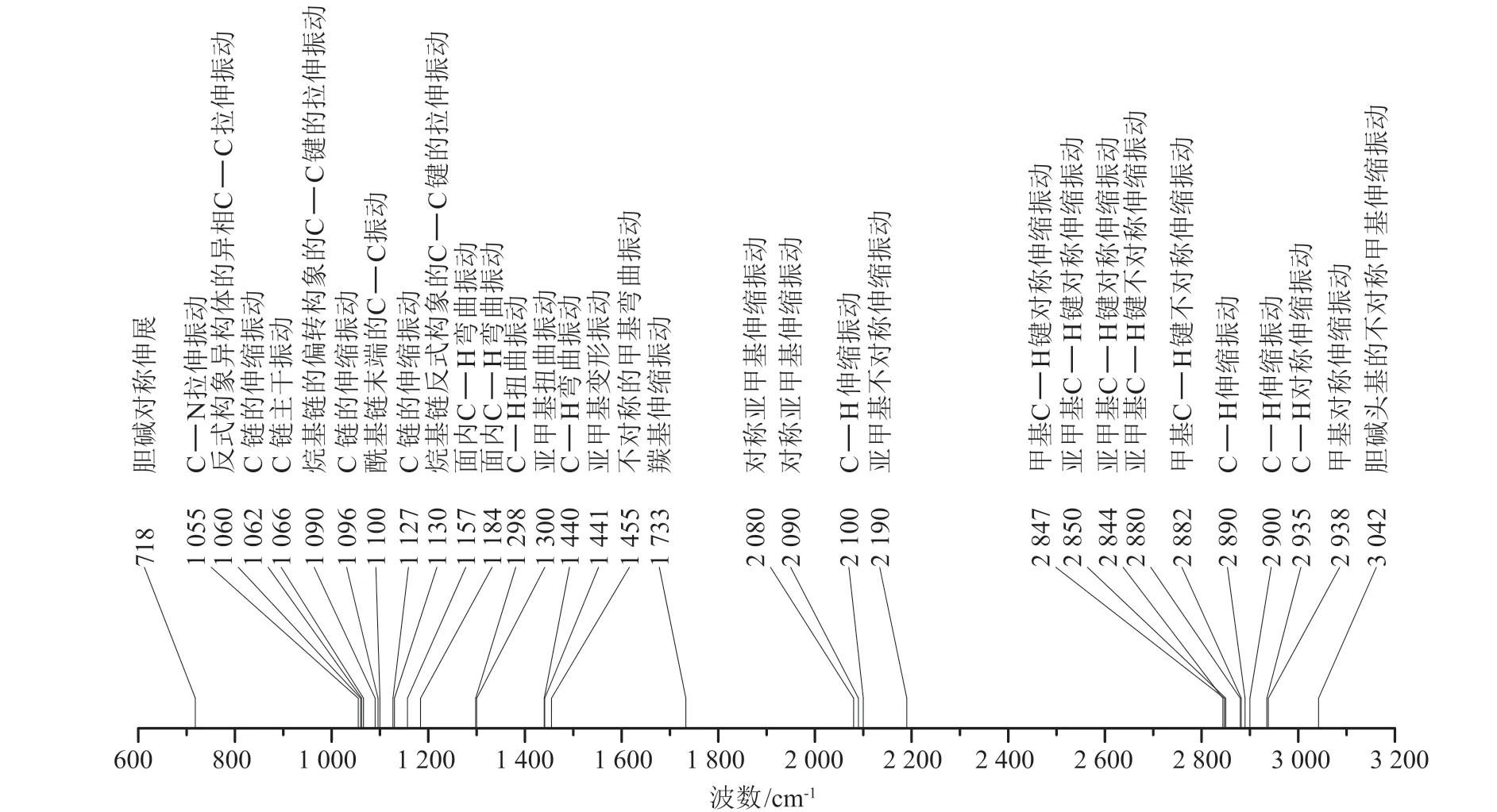
图 1 DPPC 的拉曼光谱特征峰分布Figure 1 The peak distribution of DPPC
DSPC 的疏水部分为18 个C 的饱和脂肪酰基链,而DPPC 的疏水部分为16 个C 的饱和脂肪酰基链,导致DSPC 在拉曼光谱上对于磷脂分子构象敏感的C-C 振动谱线(1 062、1 128 cm-1)与C-H 振动谱 线(2 800、2 849、2 881、2 934 和2 962 cm-1)和DPPC 稍有差别。另一方面,由于2 种磷脂的极性头部基团相同,因此二者在拉曼光谱上对于磷脂头部结构敏感的PO2- 振动(1 090 cm-1)等谱线无明显差别[21-22]。
利用拉曼光谱研究DOPC 和DSPC、DPPC 结构和构象区别的谱线主要在3 个区域:C = C 键振动区域(1 641、1 654、1 659、1 686 cm-1)、C-C 键 振动区域(1 062、1 128 cm-1)和C-H 键振动区域(2 800、2 849、2 881、2 934、2 962 cm-1)。C = C 键振动区域主要给出结构是否含有不饱和链的信息,用于区分混合物是否含有DOPC。C-C 键振动区域和C-H 键振动区域主要给出结构中酰基链长度的信息,可以将含16 个C 的酰基链的结构(DPPC)和含18 个C 的酰基链的结构(DSPC、DOPC)区分开[23-27]。
DLPC 中与C = O 键有关的特征峰分布在1 763 cm-1附 近;2 800~3 000 cm-1是CH2 和CH3 的C-H键拉伸振动集中分布的区域,包括与CH2 振动相关的特征峰(2 850、2 880、2 935 cm-1)以及与CH3 振动相关的特征峰(2 895、2 935、2 962 cm-1)[8,25]。
DLPC 的酰基链不饱和程度较DOPC 更高。更高的不饱和程度使C = C 键振动(1 655 cm-1)和与之相连的= C-H 键振动(3 010 cm-1)的峰强度发生明显变化。在DLPC 分子构象改变导致流动性和有序性发生变化时可以通过PO2- 相关的1 100、1 087 和1 076 cm-1的特征峰谱线来区分不同的DLPC 异构体[8,28]。
2 大豆磷脂中磷脂酰乙醇胺的拉曼光谱特征峰
PE 和PC 的最大的区别在于,PC 的亲水端头基为胆碱残基,而PE 的亲水端头基为乙醇胺残基。
DSPE 亲水头部为一个胆碱残基,不含甲基,因此光谱中代表C-N 键振动的谱线(718、874 cm-1)[29]与磷脂酰胆碱的谱线(715、760、1 055 cm-1)有较大差别。DSPE 疏水部分为2 条18 个C的饱和脂肪酰基链,这部分结构体现在C-C 键振动(1 062、1 100、1 130 cm-1)和CH2结构C-H键振动(1 295、1 456、2 846、2 881 cm-1)的谱线。反映DSPE 的C = O 键振动的谱线出现在1 737 cm-1;在2 959 cm-1可以观察到与末端甲基振动相关的特征峰[29]。
DOPE 的疏水部分为含有一个C = C 键的不饱和脂肪酰基链。与DSPE 相比,DOPE 存在C = C键振动,该振动反映在1 656 和3 006 cm-1的谱线处。DOPE 的C = O 键振动主要体现在1 727 和1 744 cm-1谱线,对磷脂分子构象敏感的CH2 的C-H 键振动谱线出现在1 300、1 442、2 851、2 885 cm-1,酰基链末端CH3的C-H 振动反映在1 457、2 930、2 961 cm-1谱线处[30]。
3 磷脂结构改变对拉曼光谱特征峰的影响
分子结构的改变,以及与其他分子的相互作用都会影响拉曼光谱特征峰,可将变化的特征分为3类:亲水头部基团的结构变化引起的拉曼光谱特征峰变化;C 链与其他结构相互作用引起的拉曼光谱特征峰变化;酰基链末端甲基与其他结构相互作用引起的拉曼光谱特征峰变化。
二甲氧基姜黄素(dimethoxycurcumin,DiMC)与DPPC 相互作用时,在715 cm-1处峰的强度变化说明了DPPC 亲水头部基团与DiMC 发生相互作用,使得结构改变;拉曼光谱特征峰I2935/2880、I2844/2880和I1090/1130这3 个强度比代表DiMC 与烷基链的相互作用程度[7]。将发生相互作用前后的数据作图进行对比,利用其光谱结构变化,可以得到不同键或不同原子的振动情况。
通过DSPC 的密度泛函理论(density functional theory,DFT)计算可以得到部分拉曼光谱C-H振动,其结果表明,在接近2 900 cm-1的峰值处,游离DSPC 分子的末端甲基的振动强度高于配对DSPC 分子的末端甲基的振动强度。由此说明,随机堆积的DSPC 分子以及游离的DSPC 分子无序程度更高,而末端甲基振动强度降低是由于DSPC 分子形成结晶相,结构更稳定[31]。在实际应用中,分子自身结构的相互作用,在拉曼光谱的分析中也应当被考虑。不同的晶体结构,会带来拉曼光谱特征峰的一些变化。
Tantipolphan 等[29]通过物理混合、制粒、共沉淀、65℃加热水合和单纯120℃加热5 种方法,制备卵磷脂和胆固醇的二元混合物,并研究其拉曼信号。各种制备方法得到的疏水区域拉曼特征峰,其光谱未见明显差异。当通过共沉淀、65℃加热水合和单纯120℃加热制备样品时,观察到亲水头部甲基不对称拉伸模式的拉曼光谱变化,说明这些样品的头部甲基发生了改变[29]。这项研究说明:物理混合等方法制备的磷脂-胆固醇混合物中没有相互作用时,可以通过特征峰的代数和来判断此类二元混合物的拉曼光谱特征峰变化。
4 大豆磷脂拉曼光谱数据处理分析方法
在关于药用大豆磷脂高含量组成物的文献中,最常用的分析方法是分析2 个拉曼光谱特征峰强度的比值[7,8,11,13,18,20,25,32],通过将2 个键振动的强度相比较来判断2 个组分的比例,或者是2 种组分的结合情况。另外一种报道较多的是根据光谱随温度的变化来分析结构改变对光谱造成的影响[25,27,29,33],温度改变会影响磷脂的结构,使部分键振动的拉曼光谱特征峰发生变化,甚至会影响到磷脂组成物的相态。拉曼光谱随样品的浓度变化也是研究的重点之一[7,11,13,18,29]。
在对实验数据进行处理时,有文献提到一些应用较少但有一定参考价值的方法,例如通过减去背景噪声来降低干扰[17-18]、将分析结果叠加在明场图像[19,34],以及通过DFT 计算来分析拉曼光谱特征峰的信息[31]等。
5 结语与展望
大豆磷脂提取物在药物的制造过程中正扮演着越来越重要的角色,通过实时的技术手段分析大豆磷脂的组成成分是亟待进一步研究的重要问题。拉曼光谱是研究分子组成及其结构的一种重要手段,在当前利用拉曼光谱进行物质分析的研究中,大多是对单一化合物结构进行分析。在磷脂的混合物分析方面,无相互作用以及含相互作用的多成分混合分析方法有待进一步探索。深度学习有别于传统的机器学习专家系统,为复杂特征分析提供了更加有效的手段,因此,有望通过将拉曼光谱与深度学习结合,构建混合物分析的理论基础,对药物制造过程中使用的大豆磷脂提取物进行实时的组成分析,进而实现更加精确的质量控制。我们期待在未来会有更多通过拉曼光谱对各类药物进行组成分析和质量控制的研究报道。
