T细胞在IgA肾病发病机制中的作用
2020-02-26李婷婷
李婷婷, 石 磊
(天津中医药大学研究生院/天津中医药大学第一附属医院, 天津 300000)
IgA肾病是世界上许多地区最常见的原发性肾小球肾炎,发病前常有上呼吸道和/或消化道感染存在[1]。发病时青少年常表现为无痛性肉眼血尿和蛋白尿;成人则表现为镜下血尿、蛋白尿、高血压和不同程度的慢性肾病。该疾病最典型的特征是肾小球系膜中含有完全属于IgA1亚型的IgA免疫沉积物。经过多年的研究,目前人们普遍认为,IgA肾病由“多重打击”进展而来[2,3]。第一重打击指铰链区异常O-糖基化的循环IgA1水平升高。这些分子在铰链区的一些O-聚糖中缺乏半乳糖(半乳糖缺乏型IgA1,Gd-IgA1),因此暴露N-乙酰半乳糖胺(GalNAc)作为末端聚糖;第二重打击指聚糖特异性IgG或IgA1自身抗体的形成,其靶向作用位点为Gd-IgA1含有GalNAc的铰链区末端;第三重打击指含有Gd-IgA1和IgG自身抗体的循环免疫复合物形成;第四重打击指一些循环免疫复合物通过肾小球毛细血管中的窗孔进入系膜区,引起系膜细胞增殖和细胞外基质、细胞因子及趋化因子的过量产生,最终导致慢性肾小球损伤。本文我们重点关注T细胞及其细胞因子在其发病进程中的作用。
1 Gd-IgA1的合成
IgA肾病发病机制的第一重打击是在循环中出现半乳糖缺乏型IgA1,即Gd-IgA1。Gd-IgA1的出现是IgA1翻译后修饰过程中半乳糖基化减少的结果[3]。有两种原因可能导致半乳糖基化速率降低:①ST6 N-乙酰半乳糖胺α-2,6-唾液酸转移酶2(ST6GALNAC2)的过早唾液酸化,可阻止将半乳糖添加到GalNAc中;②核心1β1,3-半乳糖基转移酶(C1GALT1)的活性降低,其活性依赖于C1GALT1特异性伴侣蛋白1(C1GALT1C1),此蛋白之前被称为特异性分子伴侣(COSMC)。事实上,IgA肾病患者产生Gd-IgA1的细胞反过来能够升高ST6GALNAC2的表达,降低C1GALT1和C1GALT1C1的表达[4]。
T细胞及其细胞因子参与IgA1铰链区的翻译后修饰开始于将GalNAc添加至位于铰链区的丝氨酸或苏氨酸。如图1所示,生理上该过程由活性C1GALT1向GalNAc添加半乳糖维持。随后通过ST6GALNAC2的唾液酸化可阻止GalNAc的进一步半乳糖基化。在IgA肾病中,白细胞介素(IL)-4(Th2型白细胞介素),IL-17(Th17型白细胞介素)和转化生长因子β(TGF-β)的水平升高与C1GALT1及C1GALT1C1的表达降低有关。IL-6可升高ST6GALNAC2的表达并降低C1GALT1的表达。IL-21(Tfh型白细胞介素)能够增强IgA1的产生,并参与刺激抗Gd-IgA1的产生。即所有提及到的细胞因子均对Gd-IgA1的产生发挥了刺激作用。
首先,IL-4通过抑制C1GALT1及C1GALT1C1的表达而导致C1GALT1活性下调,从而促进了IgA1的产生并改变了分泌型IgA1的末端糖基化。其还可通过促进C1GALT1C1基因启动子中CpG岛的高甲基化,下调C1GALT1C1 mRNA的表达,刺激B细胞中异常糖基化IgA1的更高分泌[5]。另一方面,IL-4诱导的C1GALT1C1 mRNA水平降低在IgA肾病B细胞中高于健康儿童和患有其他肾脏疾病儿童的淋巴细胞[5],即来自IgA肾病患者的B细胞对IL-4更敏感。IL-17有着相似的作用机制,在IL-17刺激的B细胞系中,C1GALT1和C1GALT1C1 mRNA的表达显著降低。同时发现5-氮杂胞苷逆转了由IL-4或IL-17诱导的IgA1低糖基化[5],也证明Th2和Th17衍生的白细胞介素通过表观遗传机制干扰IgA1的半乳糖基化。此外,用IL-6刺激IgA肾病患者的IgA1分泌细胞后,ST6GALNAC2活性增加,C1GALT1的活性降低,说明IL-6促进了IgA1的低半乳糖基化。
其次,Tfh通过IL-21参与IgA和Gd-IgA1的合成过程[6](图2所示)。IL-21在成熟B细胞中上调活化诱导的胞苷脱氨酶(AID)、DNA编辑酶的表达,在活化B细胞分化为浆细胞期间介导IgA类转换[6]。IgA转换的特异性T细胞依赖机制是通过CD40L介导的,这种膜结合细胞因子在除调节性T细胞(Tregs)的所有Th亚群(Th1,Th2,Tfh,Th17)上激活后存在。除此之外,TGF-β是由许多细胞如γδT细胞和Tregs产生的细胞因子,通过刺激IgA肾病患者B细胞中T细胞依赖性IgA类转换参与Gd-IgA1的合成过程。更重要的是,TGF-β显著降低C1GALT1和C1GALT1C1的mRNA水平,从而有助于产生更高水平的Gd-IgA1。诸多研究也证实了这一点,孟等在IgA肾病患者中发现血清TGF-β1浓度与总血清浓度和分泌型IgA与Gd-IgA1之间存在正相关联系[7]。此外还发现IgA肾病患者γδT细胞比例、产生IgA的B细胞比例和血清IgA水平呈正相关。除上述T细胞依赖性IgA类转换外,非T细胞依赖性IgA转换同样参与了IgA肾病患者IgA和Gd-IgA1的产生过程。这种IgA转换是通过分子如肿瘤坏死因子配体超家族成员13[8]和13b[9](分别称为April和BAFF)介导的。而且已经发现IgA肾病患者April和BAFF血清水平均升高,且April诱导了IgA肾病患者培养淋巴细胞中Gd-IgA1的过量产生[8]。
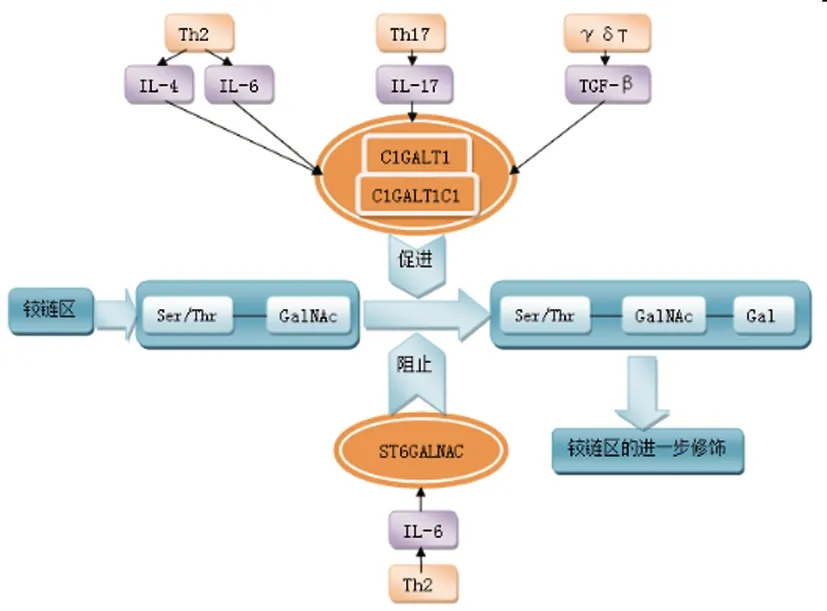
图1 T细胞及其细胞因子参与IgA1铰链区的翻译后修饰
2 抗Gd-IgA1自身抗体的产生
IgA肾病发病机制的第二重打击是抗Gd-IgA1自身抗体的产生,这些自身抗体主要存在于IgG2亚类中。异常糖基化的IgA1是一种自身抗原,针对它的免疫反应导致抗IgA1抗体的产生[10]。抗Gd-IgA1自身抗体来自于产生抗Gd-IgA1细胞中VH基因区段的体细胞超突变(SHM),而IL-21通过增加IgA肾病患者B细胞中AID的表达促进了SHM。
此外有研究发现,与上呼吸道感染有关的病毒和革兰氏阳性细菌表面具有含GalNAc的结构,可以模拟Gd-IgA1铰链区的GalNAc[10](图2所示)。因此,这种感染刺激了与Gd-IgA1交叉亲和抗体的产生,随后导致病理性免疫复合物形成。

图2 T细胞及其白介素参与抗Gd-IgA1自身抗体的产生
3 病理性循环免疫复合物形成
IgA肾病发病机制的第三重打击是含有Gd-IgA1和IgG自身抗体的循环免疫复合物形成。目前认为肾小球系膜细胞上的转铁蛋白受体(CD71)在与含Gd-IgA1免疫复合物的结合和系膜细胞的活化中起重要作用[3]。CD71是一种多配体受体,已被证明可与多聚IgA1结合。而且CD71在IgA肾病患者肾小球系膜细胞表面过表达,其定位与IgA沉积部位相关。另一方面,免疫复合物的大小和组成决定了其生物活性。根据大小,IgA肾病患者含有IgA1的循环免疫复合物可分为两组:高分子量(>800kDa)的免疫复合物和低分子量(≤800kDa)的免疫复合物。高分子量复合物能够激活培养的人肾小球系膜细胞,导致细胞增殖、细胞因子(如IL-6和TGF-β)和细胞外基质成分的过量产生,而低分子量复合物则表现出抑制作用。组成方面,在培养的人肾小球系膜细胞模型中发现,IgA肾病患者的含Gd-IgA1的免疫复合物结合细胞的效率高于未复合的IgA1或来自健康对照的免疫复合物。具有较高Gd-IgA1含量的循环免疫复合物具有增强诱导肾小球系膜细胞增殖的能力,而不含Gd-IgA1的复合物或单独的Gd-IgA1不具有增殖作用,体外形成的免疫复合物实验也证实了这一点。但T细胞及其细胞因子是否参与了受体与Gd-IgA1免疫复合物的结合过程、是否对免疫复合物的大小和组成产生影响目前尚不清楚,有待进一步研究。
4 肾小球损伤
IgA肾病发病机制的第四重打击指一些循环免疫复合物进入系膜区,最终导致肾小球损伤。IgA肾病肾活检的免疫组织化学染色表明肾脏主要由αβT细胞浸润,进展期则主要由γδT细胞浸润。多变量分析显示肾小管间质T细胞浸润与IgA肾病的进展独立相关,这表明T细胞参与IgA肾病的肾损伤过程[11]。

图3 肾小球损伤的形成
一方面,Gd-IgA1通过刺激系膜细胞使其产生Th17(CCL20)和Th22细胞(CCL20,CCL22和CCL27)的趋化因子[12]。患者外周血中Th22细胞水平升高与肾脏组织学的较差表现相关,Th22细胞百分比与肾脏MEST评分呈正相关。而研究发现IgA肾病患者的CCL20、CCL22和CCL27在肾脏中的表达较高,尤其是伴有扁桃体炎的患者更为明显。由此可见,扁桃体炎通过诱导Th22淋巴细胞增多、Th22促进肾纤维化加重了IgA肾病的肾损伤[13]。此外,Th2的极化增强了肾小球细胞对IgA免疫复合物的反应,并直接和间接降低肾小球滤过率(Glomerular filtration rate,GFR)。
另一方面,在IgA肾病的动物模型中发现,患者的Tregs不能有效抑制系膜区IgA的沉积、系膜基质扩张,以及肾小球系膜细胞的广泛增殖,即IgA肾病中Tregs的免疫抑制功能降低。导致这种结果的原因可能有:①IgA肾病患者外周血单核细胞(PBMC)中miR-155缺乏、miR-133a和miR-133b表达升高抑制了Treg细胞的成熟和分化[14]。②慢性扁桃体炎的影响。2010年黄等发现IgA肾病患者扁桃体Tregs比率下降,扁桃体切除术后血液中Treg细胞数量有所增加,但仍低于健康受试者[15]。③CTLA-4(一种膜结合蛋白)的表达下降。Jacob等发现由CTLA-4基因表达下降导致的多态性与IgA肾病患者的高蛋白尿有关[16]。IgA肾病患者肾活检的组织学严重程度往往更差,并且与血液Tregs水平的降低同时发生。因此,Treg群体不能有效抑制IgA肾病的肾损伤是导致损伤加重的另一原因。
5 小 结
T细胞尤其是Th2,Th17,Tfh和Th22亚群的过度激活,在IgA肾病发病机制中起重要作用。Th2、Th17和Tfh型白介素有助于Gd-IgA1的合成升高,并且Tfh细胞可通过IL-21刺激抗Gd-IgA1自身抗体的产生。同时Th2、Th17、Th22和Treg细胞以不同作用形式加重了肾小球的损伤。T细胞及其亚群在IgA肾病发病机制中作用的阐明有助于IgA肾病早期生物标志物及治疗靶点的发现。但是目前使用的用于治疗IgA肾病的免疫抑制药物靶向所有的T细胞群,是非特异性的。因此,通过调节细胞因子水平或抑制细胞因子受体来降低特定T细胞亚群的活性,同时改善Treg细胞的功能减轻肾损伤可能是IgA肾病的最佳免疫疗法。除此之外,增加体内异常IgA1的清除途径、改变关键遗传易感点、平衡体内糖基化转移酶、抑制免疫复合物形成等对发病过程各个环节采取针对性治疗措施也是未来疾病靶向疗法的发展方向。
