泊沙康唑临床应用专家共识
2020-02-25泊沙康唑临床应用专家组
泊沙康唑临床应用专家组
近年来,随着各类免疫缺陷人群及危重疾患的增多,侵袭性真菌病(invasive fungal disease,IFD)的整体发病率逐年上升[1-5],且非白念珠菌、曲霉及毛霉等真菌感染的比例在血液科、呼吸科、器官移植科等科室普遍呈升高趋势[6-10]。泊沙康唑属于第二代三唑类抗真菌药物,其抗菌谱和药物代谢过程有别于其他三唑类药物,口服混悬液、肠溶片和注射剂分别于2005、2013和2014年经美国食品药品监督管理局批准先后上市。在我国,泊沙康唑口服混悬液于2013年上市,肠溶片也于2018年12月上市,在IFD的预防和治疗领域适用范围广泛。本专家组在系统复习泊沙康唑现有临床研究成果的基础上,结合国内外权威指南和国内临床应用经验,制订本共识,以期规范泊沙康唑在我国的临床应用。
1 临床药理学特性
1.1 作用机制及分子结构特征 泊沙康唑与其他三唑类抗真菌药物作用机制相似,主要通过抑制细胞色素P450依赖的14α-脱甲基酶进而抑制麦角甾醇的合成,导致真菌细胞膜的生物合成障碍,细胞膜通透性改变,从而抑制真菌生长[11]。泊沙康唑在三唑类母环基础上延伸出一条侧链,苯环中氟取代氯,同时侧链进行羟基化,一系列结构改造使其和真菌亲和力更强,稳定性更高,细胞毒性增加,在保留药物亲脂性的同时水溶性增加,更容易进入组织并释放。另外,长侧链结构增加了药物对靶点(CYP51)的亲和力,对人类细胞色素P450酶影响更小,仅是CYP3A4抑制剂,药物活性更高、更安全,而且受14α-脱甲基酶密码子突变的影响更小,与跨膜转运蛋白(外排泵)的结合力更低,更不容易耐药[12-17]。
1.2 药代动力学(pharmacokinetics,PK) 泊沙康唑的吸收会因剂型不同而有差异,主要在胃部溶解[18],在十二指肠部位吸收。口服混悬液口服后3 h达血药峰浓度(Cmax),7~10 d达稳态血药浓度[19],其吸收不受性别、年龄、种族和体质量等因素影响[20-21],而服用时间、方法、次数和某些药物则会明显影响其吸收[18,22-23]。国外PK研究显示,餐后服用、分4次服用、与营养液同服、与碳酸饮料同服,药物吸收将分别增加了约3.6倍、1.5倍、0.6倍、和0.8倍;而与质子泵抑制剂类药物和甲氧氯普胺同服,药物吸收则将分别减少了约2/5和1/5;此外泊沙康唑的吸收还受腹泻、胃肠道黏膜炎等机体状态影响[19,24-26]。
肠溶缓释片剂使用独特的热熔挤压工艺将药物分散在p H敏感的高分子聚合体中,有效避免药物在低p H的胃部释放,利于在中性p H的小肠溶解,从而使泊沙康唑吸收达到最大化。缓释片剂口服后4~5 h达到血药峰浓度,较口服混悬液生物利用度提高[19],如禁食状态下单剂量100 mg泊沙康唑给药,缓释片剂的Cmax和从0到无穷大时间的血药浓度时间曲线下面积(area under curve,AUC)分别较口服混悬液提高近4倍和3倍;进食条件下,片剂制剂的暴露率高出约35%[27]。国际多中心评估泊沙康唑肠溶片PK特性的研究显示,可计算预测平均浓度(predicted average concentration,pCavg)的186例受试者[急性髓细胞白血病(acute myeloid leukemia,AML)/骨髓增生异常综合征(myelodysplastic syndrome,MDS),造血干细胞移植(hematopoietic stem cell transplantation,HSCT)]中,81%每日1次接受300 mg药物治疗的患者达到了稳态p Cavg(0.500~2.5 mg/L)[28]。中国评价泊沙康唑肠溶片多中心PK研究(n=65,AML/MDS)显示,接受泊沙康唑肠溶片300 mg治疗的受试者中92.2%的p Cavg达到了0.5 mg/L以上,受试者达到稳态时pCavg为1.77 mg/L[28]。此外,缓释片剂的吸收受饮食影响很小,几乎不受抑酸及促胃动力药物影响[29-30],且除首日双倍剂量外每日仅服用1次[31]。缓释片剂必须完整服用,不能压碎或咀嚼,因此可能不适用于吞咽困难、儿童和肠内管饲患者[19]。
与其他2种剂型相比,注射针剂几乎在注射完毕时即可达血药峰浓度,且除首日双倍剂量外每日仅需给药1次,适用于不能耐受口服剂型的患者。注射针剂要求通过中央静脉导管给药,其辅料中含有环糊精[19]。
泊沙康唑血浆蛋白结合率为98%,主要由游离原形药物发挥抗真菌活性。其表观分布容积为261~1 774 L,广泛分布于各组织器官。尸检结果显示,在脑、心脏、肺、肝脏和肾脏中浓度最高可分别达血药浓度的8倍、18倍、20倍、66倍及32倍[32]。泊沙康唑与肺泡上皮细胞具有高亲和力,一项对健康成人志愿者使用液相色谱法测定泊沙康唑的PK研究结果显示,泊沙康唑在肺泡上皮浓度是血浆浓度的40倍,其肺泡上皮细胞内及肺泡上皮衬液的稳态药物浓度在24 h内均能维持在烟曲霉的90%最小抑菌浓度(90%minimum inhibitory concentration,MIC90)之上[33]。肺移植患者体内研究也显示,在血浆、肺上皮细胞衬液及上皮细胞三者中,肺上皮细胞内泊沙康唑浓度最高,即使在血浆和肺上皮细胞衬液中泊沙康唑的浓度仍高于其对曲霉的MIC90,且此高浓度特点可以在最后一次给药后持续近24 h[34]。一项评估抗真菌药物在细胞内积累是否为其预防效果重要决定因素的基础体外研究证实,泊沙康唑可高效持久抑制曲霉生长达48 h[35]。在曲霉感染时,泊沙康唑可快速地从肺泡上皮细胞转移至曲霉内发挥抗真菌效应,这使得泊沙康唑在预防和治疗肺真菌病时,虽然血药浓度较低但仍能取得较好疗效[16,32-36]。
泊沙康唑在体内消除缓慢,半衰期为27~35 h,其中仅约15%的药物在肝脏转化为多种形式的葡萄苷酸化衍生物经肾脏排泄,而大部分(77%)药物则不经代谢以原形通过粪便排出体外(表1)。
1.3 治疗药物监测(therapeutic drug monitoring,TDM) 在深部真菌病的预防治疗中,基础疾病、合并用药、饮食情况、诊疗措施等多种因素都会对抗真菌药物的吸收、分布、代谢和清除产生影响,TDM既是保证治疗充分的重要手段,又是避免过度药物暴露、减少药物相关不良反应的重要措施。因此,三唑类抗真菌药物的TDM近年来受到了广泛重视。
研究结果表明,泊沙康唑的血药浓度与临床疗效具有明确相关性。在用于IFD的预防时,泊沙康唑血药平均浓度低于0.7 mg/L时真菌突破性感染发生率为3.9%~6.5%,而血药平均浓度高于0.7 mg/L时真菌突破性感染发生率仅为0%~1.9%[38];在侵袭性曲霉病挽救治疗中,泊沙康唑血药平均浓度为1.25 mg/L、0.411~0.719 mg/L和0.134 mg/L时治疗应答率分别为75%、53%和24%[39]。因此,临床中泊沙康唑用于预防IFD时血药谷浓度应维持在0.7 mg/L以上,而用于治疗IFD时血药谷浓度应维持在1.0~1.25 mg/L以上[40]。
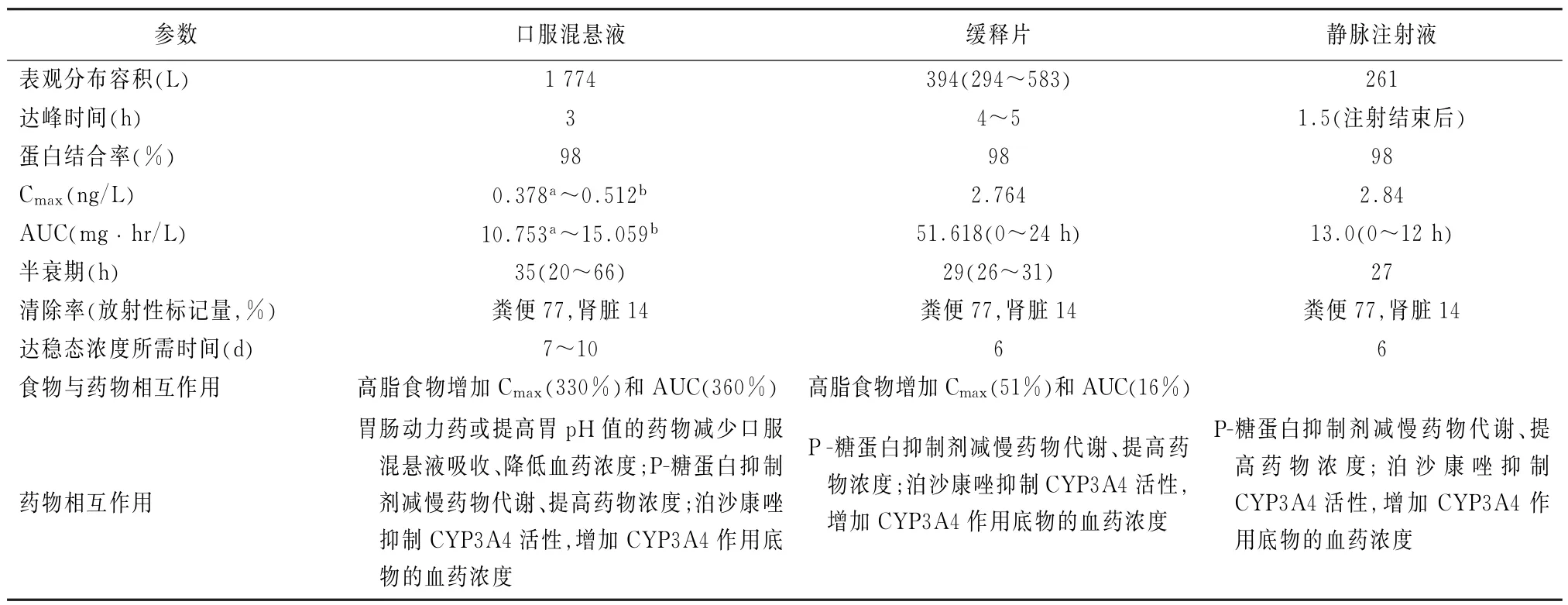
表1 泊沙康唑3种剂型主要的药代动力学情况参数(健康志愿者)[19,37]
2018年一项评估61例血液系统恶性肿瘤患者真实世界的研究,在服用泊沙康唑肠溶缓释片或口服混悬液进行泊沙康唑Cmax持续检测,缓释片患者(n=48例)和口服混悬液患者(n=13例)的中位服药时间分别为92 d和124 d。在至少接受1次Cmax监测的患者中,服用缓释片患者Cmax>0.7 mg/L的比例高于接受口服混悬液治疗的患者(91%比52%,P=0.001);在单样本检测结果逐一分析中,服用缓释片患者Cmax>0.7 mg/L的比例明显高于口服混悬液患者(91.4%比70.3%,P<0.001)。可见,无论是对患者分析,还是对每批次样本分析,服用泊沙康唑缓释片患者Cmax>0.7 mg/L的比例均高于服用口服混悬液患者[41]。
对于与药物不良反应相关的泊沙康唑血药浓度上限,目前尚无相关研究资料。在泊沙康唑现有的3种剂型中,口服混悬液的生物利用度及血药浓度变异幅度要大于片剂及静脉注射剂,TDM更为重要。
专家建议:有条件的医疗机构应积极开展泊沙康唑的TDM,监测指标为泊沙康唑血药谷浓度。首次泊沙康唑血药谷浓度监测的采血时间建议为用药后第5天。用于预防IFD时,泊沙康唑的血药谷浓度应维持在0.7 mg/L以上;用于治疗IFD时,泊沙康唑的血药谷浓度应维持在1.0~1.25 mg/L以上。并非所有接受泊沙康唑预防或治疗的患者都需要常规进行TDM,但存在下列情况时TDM是必要的:治疗确诊的IFD(尤其是三唑类敏感性较差的真菌);患者伴有腹泻、胃肠道黏膜炎等胃肠吸收功能障碍的疾病;治疗效果欠佳,需排除泊沙康唑剂量不足;出现药物相关不良反应怀疑与泊沙康唑有关;患者治疗依从性较差;需要同时服用或终止服用影响泊沙康唑吸收、代谢或排泄的药物。
1.4 药物间相互作用 泊沙康唑是P-糖蛋白泵的作用底物和抑制剂,而并非CYP450酶系统的作用底物。因此,影响CYP450酶系统的其他药物不会明显干扰泊沙康唑的代谢。泊沙康唑作为强效的CYP3A4抑制剂,会导致经CYP3A4代谢的其他药物血药浓度升高,但是对CYP450酶系统中其他亚型的活性没有影响[6,16,24]。泊沙康唑的主要药物相互作用结果及应对措施见表2。泊沙康唑肠溶片有不同于口服混悬液的PK特性,肠溶缓释片与抗酸剂、H2受体拮抗剂和质子泵抑制剂同时使用时,临床上未观察到对泊沙康唑PK具有相关影响。泊沙康唑肠溶片与抗酸剂、H2受体拮抗剂、质子泵抑制剂及胃肠动力药(如多潘立酮)同时使用时,不需要调整泊沙康唑肠溶片的给药剂量[28]。另外,应关注血液病相关新型靶向药物与泊沙康唑的相互作用,如Venetoclax和Midostaurin等,在联合使用时可能会增加靶向药物的血药浓度,或可适当减少靶向药物剂量。
1.5 安全性及耐受性 泊沙康唑口服混悬液常见不良反应为恶心、头痛、呕吐、腹痛、皮疹等,症状较轻微,大多数情况下不需要停药[16,44],长期治疗(≥6个月)时QT间期延长、肝酶升高等不良反应的发生率仍然保持在较低水平[45]。2007年美国一项国际多中心研究证实,对于其他三唑类抗真菌药物治疗效果不佳的口咽念珠菌病经泊沙康唑口服混悬液长期治疗安全性良好,最常见治疗相关不良事件在早期随诊期间(≤105 d)为呕吐(4%),在长期随诊期间(>105 d)为肝酶升高(6%)[46]。

表2 泊沙康唑的药物相互作用及应对策略[24,28,42-43]

续表2
泊沙康唑缓释片剂常见不良反应同样为胃肠道不良反应,目前尚未发现药物浓度升高增加不良反应发生率的证据[47-49]。泊沙康唑静脉针剂使用中可能出现注射部位反应,如血栓性静脉炎,多次给药应通过中央静脉导管给药。
专家建议:对于服用口服混悬液后出现消化道不良反应的患者,应对血药浓度和突破性真菌感染进行监测。对于有肝脏基础疾病患者,在使用泊沙康唑期间应监测肝酶水平。对于基础心电图有QT间期延长或接受泊沙康唑治疗期间同时使用其他可导致QT间期延长的药物时,应加强心电图监测。
1.6 抗菌谱/抗真菌活性 泊沙康唑抗菌谱既包含常见的念珠菌、隐球菌和曲霉,也包含毛霉、球孢子菌、镰刀菌、多育赛多孢子菌等罕见真菌[15,50]。与棘白菌素和其他三唑类药物相比,泊沙康唑抗菌谱更广,抗菌活性较强(表3)。
一项美国大型药物体外敏感性研究结果显示,泊沙康唑抗霉菌作用明显优于其他药物,对于检测的霉菌泊沙康唑MIC90为1.0 mg/L,而氟康唑、伊曲康唑、伏立康唑和两性霉素B的MIC90分别为256.0 mg/L、4.0 mg/L、2.0 mg/L、2.0 mg/L[52]。2018年一项奥地利真菌感染监测研究显示,泊沙康唑对烟曲霉、土曲霉、黄曲霉和黑曲霉的MIC90分别为0.25 mg/L、1 mg/L、0.5 mg/L、0.5 mg/L,略低于伏立康唑、棘白素类及两性霉素B等药物,且近年来耐药率一直保持在较低水平(表4)[53]。同时,我国2017年的研究报道,在2012~2015年间南京4家医院分离的126株烟曲霉中伊曲康唑耐药率为3.17%,泊沙康唑和伏立康唑耐药率均为0.8%[54]。
泊沙康唑目前是除两性霉素B及其脂质制剂之外唯一具有抗毛霉活性的抗真菌药物[50]。最近的体外药敏监测结果显示,泊沙康唑对各种毛霉的MIC90分别为:根毛霉(4 mg/L)、伞状毛霉(2 mg/L)、横梗霉(1 mg/L)、小孢根霉(1 mg/L)、大根霉(2 mg/L)、根霉(2 mg/L)、冻土毛霉(2 mg/L)及毛霉(4 mg/L)[53]。
泊沙康唑对念珠菌一直保持着较高的敏感率,对多数非白念珠菌也具有较好抗菌活性[55-56]。美国体外药物敏感性研究显示,针对白念珠菌、光滑念珠菌,泊沙康唑和伏立康唑的MIC90均为0.063 mg/L和2.0 mg/L;针对热带念珠菌,泊沙康唑和伏立康唑的MIC90分别为0.125 mg/L和0.5 mg/L[15]。我国历时3年的全国性抗真菌药物敏感监测显示,对近平滑念珠菌、光滑念珠菌、克柔念珠菌、季也蒙念珠菌等,泊沙康唑敏感性均在90%~100%(除热带念珠菌为68.3%)[57-58]。
国外研究显示针对隐球菌泊沙康唑MIC90在0.25~0.5 mg/L之间[52],我国研究显示泊沙康唑对各种隐球菌敏感性均保持在98%以上[59]。此外,泊沙康唑还对镰刀菌、多育赛多孢子菌、尖端赛多孢子菌、球孢子菌、皮炎芽生菌等真菌具有较强的抗真菌活性[50,52]。
2 临床应用
2.1 在IFD预防中的临床应用
2.1.1 预防血液肿瘤化疗后IFD

表3 抗真菌药物抗真菌谱及活性一览表[51]
2.1.1.1 血液肿瘤患者预防IFD的必要性 血液系统疾病患者本身多存在白细胞质量及数目的异常,当接受化疗,尤其是高强度化疗后,自身免疫功能进一步降低,极易发生IFD[60]。我国大型流行病学调查CAESAR研究显示,在接受化疗的血液系统恶性肿瘤患者中男性、中性粒细胞绝对计数(absolute neutrophil count,ANC)<500/mm3、IFD病史、基础疾病为AML/MDS、接受诱导化疗、留置静脉导管、低白蛋白及无预防治疗是发生IFD的独立危险因素。此外,伴IFD病史、低ANC的巩固化疗患者IFD风险也不容忽视[61-63]。除以上危险因素,国外研究指出接受挽救化疗的AML、强化化疗后再接受阿扎胞苷挽救化疗的MDS/淋巴管肌瘤病、老年急性淋巴细胞白血病等均为IFD的高危因素[64]。众多临床研究及系统评价显示,预防治疗可显著降低血液恶性肿瘤化疗患者IFD发生风险[65]。CAESAR研究显示,我国血液恶性肿瘤化疗人群中IFD发病率(确诊/临床诊断/拟诊)为8.3%[61]。由于漏诊率高,实际IFD发病率可能远高于该数值[66],预防药物选择不当是IFD发生率高的主要原因之一(我国预防药物多选择氟康唑,而氟康唑抗菌谱窄、耐药性增加已不适合作为高危患者首选的预防药物)。另外,预防比例低、预防起始时间晚、预防用药疗程较短也是部分原因[61,67-68]。
2.1.1.2 泊沙康唑预防血液肿瘤患者继发IFD的临床研究结果 2007年大型随机对照研究(randomized controlled trial,RCT)纳入602例化疗粒细胞缺乏的AML/MDS患者,随机接受泊沙康唑或氟康唑/伊曲康唑进行预防,结果显示,泊沙康唑预防组确诊或临床诊断IFD的发病率和侵袭性曲霉病发病率均明显低于氟康唑/伊曲康唑预防组(IFD发病率为2%比8%,P<0.001;侵袭性曲霉病发病率为1%比7%,P<0.001),泊沙康唑预防组的100 d死亡风险也显著低于氟康唑/伊曲康唑预防组(P=0.04),2组间导致终止用药的不良反应发生率并无显著差别(8%比8%,P=0.94)[69]。2018年西班牙的一项真实世界研究显示,在接受强化化疗的AML/MDS患者中,泊沙康唑预防治疗组后续经验性治疗及治疗失败率显著低于伊曲康唑组[70]。2013年发表的一项国内多中心随机、开放研究结果显示,泊沙康唑组和氟康唑组在确诊、临床诊断或拟诊IFD发病率分别为9.4%和22.2%(P=0.011 4)[71]。2017年发表的一项国内单中心、观察性回顾研究发现,氟康唑组、伊曲康唑组、伏立康唑组和泊沙康唑组IFD突破性感染发生率分别为6.5%、5.5%、5.4%和5.3%,而需要经验性/诊断驱动抗真菌治疗的患者分别为45.7%、23.3%、18.9%和10.5%[72]。另一项国内回顾性分析研究中,泊沙康唑组IFD发病率显著低于未进行广谱抗真菌预防的对照组(P=0.001),泊沙康唑组后续静脉抗真菌药物使用率显著低于对照组(18.5%比50.0%,P<0.001)[73]。
2017年一项对比泊沙康唑片剂与口服混悬液预防疗效的回顾性临床研究,纳入了64例和118例分别使用片剂和口服混悬液AML/MDS患者,研究结果显示,2组患者IFD突破性感染发生率差异无统计学意义(P<0.05)[74]。2018年一项对比泊沙康唑片剂与口服混悬液预防疗效的大型、回顾性临床研究,纳入了547例血液恶性肿瘤患者(AML/MDS患者比例71.7%),研究结果显示,片剂和口服混悬液组中IFD发病率、病死率、早期停药率的差异均无统计学意义(P值均<0.05)[75]。
2.1.1.3 说明书及相关指南对泊沙康唑的推荐对AML/MDS(中性粒细胞减少)患者,泊沙康唑是国内外权威指南高级别推荐的抗真菌预防药物(表4),其中明确指出,急性白血病(包括MDS)初次诱导或挽救化疗患者、预期粒细胞缺乏持续>10 d、伴有严重粒细胞缺乏等高危因素的患者应进行预防治疗,药物首选泊沙康唑,其次为氟康唑、伊曲康唑及伏立康唑等,疗程覆盖整个粒细胞缺乏阶段。
专家建议:现有研究结果表明,预防性抗真菌治疗可以降低血液肿瘤化疗后粒细胞缺乏继发IFD的风险,可以获益的人群包括:接受初次诱导化疗或挽救性化疗的急性白血病(包括MDS)患者、既往有IFD病史需接受化疗的恶性血液病患者、预计化疗后粒细胞缺乏(ANC<0.5×109/L)持续时间>10 d的恶性血液病患者、化疗后粒细胞缺乏(外周血ANC<0.5×109/L)持续时间>7 d的恶性血液病患者等。考虑到泊沙康唑具有较广的抗真菌谱,有高等级的临床研究数据证实其在预防化疗后粒细胞缺乏继发IFD中的有效性和安全性,结合国外相关指南和共识的意见,本共识建议:(1)泊沙康唑可以做为预防恶性血液病(包括MDS)化疗后粒细胞缺乏(外周血ANC<0.5×109/L)继发IFD的首选药物;(2)预防用药疗程应持续至粒细胞缺乏恢复(外周血ANC>0.5×109/L)。
2.1.2 预防HSCT患者发生IFD
2.1.2.1 HSCT患者预防IFD的必要性 国外的临床研究结果显示,异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)后罹患IFD的危险因素包括急性白血病、脐带血移植、伴移植抗宿主病(graft versus host disease,GVHD)、巨细胞病毒感染、预期粒细胞缺乏>14 d、铁负荷过量等[64,81]。基于我国31家HSCT中心的前瞻性、观察性CAESAR研究结果可见,HSCT患者IFD发病率为26.7%(确诊/临床诊断/拟诊),即使接受预防治疗仍有36.7%的患者因出现疑似IFD临床症状而接受抗真菌治疗[82]。临床医师对于HSCT患者已具备一定预防意识,但预防效果仍难以令人满意,究其原因除预防药物选择不当外(多选择氟康唑),还可能与预防疗程不足(疗程中位时间为35 d)有一定关系。自体造血干细胞移植(autologous hematopoietic stem cell transplantation,auto-HSCT)患者发生IFD的独立危险因素包括既往IFD病史、长期严重粒细胞缺乏(ANC<0.5×109/L>14 d);allo-HSCT患者发生IFD的独立危险因素包括合并糖尿病、非亲缘HLA相合移植、长期严重粒细胞缺乏(ANC<500/mm3且持续>14 d)、使用CD25单克隆抗体及未进行预防性抗真菌治疗等。CAESAR研究也表明,抗真菌预防是显著降低allo-HSCT患者IFD风险的独立保护因子[82]。

表4 血液病化疗患者泊沙康唑抗真菌预防推荐
2.1.2.2 泊沙康唑预防HSCT患者继发IFD的临床研究结果 一项纳入600例HSCT后GVHD患者的大型RCT结果显示,泊沙康唑预防组和氟康唑预防组在规定随诊期内IFD(确诊或疑似)的发病率和总体病死率差异均无统计学意义(P值均<0.05)。泊沙康唑预防组在规定随诊期内侵袭性曲霉病发病率、IFD归因病死率以及在预防药物暴露期内的IFD发病率、侵袭性曲霉病发病率均明显低于氟康唑预防组[83]。其他临床研究结果显示,泊沙康唑用于HSCT患者预防性抗真菌治疗的临床疗效优于伊曲康唑[84]及米卡芬净[85]。2017年我国的一项RCT纳入80例allo-HSCT患者,随机给予口服泊沙康唑或静脉米卡芬净预防IFD,结果显示,泊沙康唑组患者IFD发生率显著低于米卡芬净组(9%比26%,P<0.05)[85]。一项口服抗真菌药物预防的系统评价共纳入5项RCT,合计2 147例allo-HSCT患者,结果显示,相对于氟康唑,伊曲康唑、泊沙康唑和伏立康唑抗真菌预防降低确诊/临床诊断IFD发生风险48%、44%和54%;使用泊沙康唑(OR=0.31)和伏立康唑(OR=0.33)预防较伊曲康唑(OR=0.68)更能减少侵袭性曲霉菌病的发生风险;所有霉菌活性药物的全因死亡率相似[86]。
一项意大利的多中心、回顾性临床研究纳入229例接受HSCT治疗AML患者,诱导/挽救性化疗期间接受泊沙康唑预防的患者在HSCT后1年IFD累积发病率明显低于接受氟康唑/伊曲康唑预防的患者(4%比14%,P=0.012)。
在法国,2018年一项对比泊沙康唑片剂(n=50)和口服混悬液(n=104)预防治疗血液恶性肿瘤患者(allo-HSCT患者比例82.5%)的回顾性研究显示,预防治疗中侵袭性曲霉病在片剂组和口服混悬液组的发病率为0%和8.7%,差异有统计学意义(P=0.032)[87]。目前,泊沙康唑肠溶片应用于移植患者体现出较高生物利用度,明显提高了预防疗效。
2.1.2.3 相关指南对泊沙康唑的推荐 国内外权威指南一致明确推荐(表5),allo-HSCT及伴GVHD等高危因素的患者应进行预防治疗,且药物首选泊沙康唑,其次为米卡芬净、氟康唑、伊曲康唑等。疗程应自预处理开始,一般至少覆盖移植后3个月。合并急性或慢性GVHD接受免疫抑制药物治疗的患者则疗程应延长至GVHD临床症状控制,免疫抑制剂基本减停为止[76-78]。
专家建议:allo-HSCT是发生IFD的高危因素,接受allo-HSCT的恶性血液病患者无论是在预处理后的粒细胞缺乏期还是在使用免疫抑制剂治疗移植后GVHD期间都容易发生IFD,对此类患者进行预防性抗真菌治疗是十分必要的。现有的相关循证医学证据支持将泊沙康唑做为allo-HSCT预防性抗真菌治疗的首选药物。预防应从预处理开始,疗程覆盖整个粒细胞缺乏期,HSCT治疗患者一般至少覆盖移植后3个月,伴GVHD的患者预防应持续至GVHD消失或免疫抑制剂停用。
2.1.3 预防重型再生障碍性贫血(severe aplastic anemia,SAA)发生IFD SAA患者持续、严重的中性粒细胞减少的典型特征是发生致命性感染的最主要原因,其感染发生率高,相关病死率也高,因此必须进行感染预防。常规应用覆盖曲霉菌的药物进行抗真菌预防[88]。此外,SAA患者如果接受免疫抑制治疗还会进一步增加真菌感染的风险和死亡风险[89-90]。目前,泊沙康唑用于SAA患者预防IFD的研究较少。2018年国内一篇回顾性研究纳入了58例接受强化免疫抑制治疗的SAA或极重型再生障碍性贫血患者,结果显示,泊沙康唑组无IFD发生,氟康唑/伊曲康唑组IFD发病率为15.8%[91]。一项再生障碍性贫血患者接受allo-HSCT的单中心回顾性研究,所有患者在移植预处理期间均服用泊沙康唑口服混悬液200 mg每日3次,直至移植后中性粒细胞植活。结果显示预防治疗中位时间为26 d(15~41 d),结束后1、2及4周分别行G试验、GM试验及胸部CT均未发现真菌感染征象,均判定为真菌预防成功,且无患者因药物不良反应停药[92]。
我国《血液病/恶性肿瘤患者侵袭性真菌病的诊断标准与治疗原则》[78]和《再生障碍性贫血诊断与治疗中国专家共识》[93]均明确指出:伴有严重粒细胞缺乏或接受抗胸腺细胞免疫球蛋白(antithymocyte globulin,ATG)/抗淋巴细胞免疫球蛋白(antilymphocyte globulin,ALG)治疗的高危患者应进行抗真菌预防治疗。而英国《成人再生障碍性贫血诊断和管理指南》建议SAA合并粒细胞缺乏患者进行预防性抗真菌治疗时应优先选择伊曲康唑、泊沙康唑等有抗霉菌活性的药物[94]。
专家建议:SAA伴有严重粒细胞缺乏、接受抗ATG/ALG治疗、allo-HSCT患者IFD发生风险高,应进行抗真菌预防治疗。此类患者进行预防性抗真菌治疗时应选择具有抗霉菌活性的药物,泊沙康唑可作为首选药物之一。对于合并粒细胞缺乏的患者,预防性抗真菌治疗应持续至ANC>0.5×109/L为止。对于接受allo-HSCT患者,抗真菌预防从预处理开始,直至粒细胞缺乏恢复。对于接受ATG/ALG治疗的SAA患者,应于开始应用ATG/ALG前1~7 d开始,持续用药至ATG/ALG治疗后或ANC>0.5×109/L。
2.1.4 预防实体器官移植(solid organ transplantation,SOT)患者继发IFD SOT术后继发IFD的风险与移植器官的种类、GVHD的严重程度、抗排异治疗的强度、移植后是否再次手术、术前是否存在真菌定植、术后是否继发巨细胞病毒感染等有关。SOT患者一旦发生IFD,不仅影响移植器官功能,还会危及患者生命,因此应采取合理措施积极预防IFD。具体而言,肺移植、心肺联合移植、胰腺移植、小肠移植等继发IFD的风险较高,原则上均应进行预防性抗真菌治疗;心脏移植或肝脏移植患者如果存在特定的继发IFD的高危因素,也应接受预防性抗真菌治疗[95-97]。
目前报道的泊沙康唑SOT研究多集中在肺移植,这可能与泊沙康唑在肺组织浓度高、能够满足临床高效抑菌需求密切相关。泊沙康唑在肺泡上皮的浓度与血浆浓度比较的倍数较伏立康唑增加33倍[33,98]。肺上皮细胞衬液中的泊沙康唑基本不与蛋白结合,游离药物多更好保证抑菌活性。一项动物研究显示,即使在最小的给药剂量(4 mg/kg)下,血浆及肺上皮细胞衬液中的泊沙康唑浓度都足以预防烟曲霉的感染(最小抑菌浓度≤0.5),且肺上皮细胞衬液中药物浓度随泊沙康唑血浆药物浓度提高呈线性升高,从而实现较高的预防应答率[99]。德国一项纳入9例使用泊沙康唑预防治疗的肺移植患者的回顾性临床研究显示,在6~10个月的预防治疗中,7例患者达到了完全成功预防,无患者发生IFD突破性感染,2例患者发生了曲霉定植,总体预防治疗成功率高达78%[100]。
现阶段泊沙康唑用于SOT患者预防治疗的临床研究数量有限,但国外已有众多临床研究报道泊沙康唑在治疗肝、肾和肺移植术后的继发IFD方面展现出了优越的临床疗效及良好的安全性特点[101-104]。
专家建议:目前泊沙康唑用于预防SOT患者IFD的临床研究开展尚少,尤其缺乏多中心RCT临床数据,但在现有的小样本病例报道中显示出了较好的临床效果,因此,可以作为SOT患者预防IFD的备选抗真菌药物,用于常规抗真菌药物不适用或不能耐受、但确实需要进行预防性抗真菌治疗的SOT患者(尤其是肺移植患者或心肺联合移植患者)。
2.1.5 IFD预防治疗的药物经济学 众多国内外学者发表了对泊沙康唑临床使用的药物经济学评价研究[105-118]。在预防治疗中,不论在化疗人群还是移植人群,泊沙康唑(包括口服混悬液和缓释片剂)均较氟康唑和伊曲康唑更具成本效益或节约总治疗费用,这主要归因于泊沙康唑较高的预防疗效和良好的安全性特点,如较低的IFD发病率和突破性感染发生率、较低的系统性抗真菌治疗率和不良事件发生率、较高的患者生存率等。
2017年我国北京协和医院完成了一项关于泊沙康唑的药物经济学评估[119],该研究旨在从我国医疗保健系统的角度评价泊沙康唑与氟康唑在中性粒细胞缺乏的我国患者中预防IFD的经济性。结果显示,以IFD突破率为短期临床结局,泊沙康唑预防中突破率比氟康唑低12.8%,每例患者总成本节约505元;终生模型中,使用泊沙康唑预防每个患者总成本亦节约505元,且每例患者多挽救0.115 2生命年。此外,泊沙康唑口服混悬液于2017年正式纳入我国国家医保目录,并大幅降价。2019年一项较新的国内经济学评价结果显示,泊沙康唑肠溶片较伏立康唑片(进口)在短期内可降低IFD突破率(绝对值降低1.2%),且成本更低,每避免1例IFD的增量成本效果比为52 373元,低于1倍的国民生产总值(意愿支付阈值为3倍人均国民生产总值,即193 932元);长期来看,每增加一个质量调整生命年的增量成本效果比为124 806元,也具有成本效果优势(泊沙康唑肠溶片属于新剂型,该研究模型中使用的价格是企业自主定价,考虑到进入医保药品目录后价格可能下调,届时其经济性将会更加明显)[118]。
2.2 在IFD治疗中的临床应用
2.2.1 泊沙康唑在念珠菌病治疗中的应用 口咽念珠菌病是人类免疫缺陷病毒感染者的常见并发症,治疗口咽念珠菌病(包括氟康唑和/或伊曲康唑难治性口咽念珠菌病)是泊沙康唑的重要适应证之一。2006年美国一项关于泊沙康唑对比氟康唑治疗人类免疫缺陷病毒感染者口咽念珠菌病的多中心RCT结果显示,虽然泊沙康唑治疗组和氟康唑组第14天的临床治疗成功率和真菌学成功率差异无统计学意义,不良事件发生率相似,但泊沙康唑组的第42天微生物学疗效显著高于氟康唑组(40.6%比26.4%,P=0.038),且泊沙康唑组临床复发率较低(31.5%比38.2%,P=0.24),真菌根除率具有更优趋势(35.6%比24.2%,P=0.084)[120]。2007年发表的一项针对人类免疫缺陷病毒感染者继发口咽念珠菌病或食道念珠菌病的国际多中心、Ⅲ期、开放性临床研究也显示,对于氟康唑和/或伊曲康唑治疗失败的患者,泊沙康唑治疗28 d临床应答率高达75%,因不良反应终止治疗的比例仅4%[121]。
专家建议:治疗口咽念珠菌病是泊沙康唑的重要适应证之一,对于氟康唑或伊曲康唑等治疗失败的难治性口咽念珠菌病,泊沙康唑可作为首选治疗药物。
2.2.2 泊沙康唑在曲霉病治疗中的应用
2.2.2.1 侵袭性曲霉病 美国一项多中心、开放标签研究纳入了193例传统治疗不耐受或难治性侵袭性曲霉病患者,泊沙康唑组在治疗结束末的总治疗成功率显著高于标准挽救治疗方案组(42%比26%,P=0.006)[39]。另一项美国临床研究纳入了143例其他抗真菌治疗不耐受或难治性侵袭性曲霉病患者,结果显示泊沙康唑组挽救治疗总体应答率(40%)显著高于两性霉素B或其联合治疗,且不良反应发生率显著降低[122]。德国一项回顾性临床研究纳入36例伏立康唑难治或不耐受的侵袭性曲霉病患者,泊沙康唑挽救治疗60 d总治疗成功率高达72.2%,且伏立康唑治疗期间升高的实验室指标(如天冬氨酸转氨酶、丙氨酸转氨酶、碱性磷酸酶等)均有不同程度降低[123]。基于以上泊沙康唑挽救治疗的疗效及安全性证据,2016年美国感染病学会《曲霉病诊断和管理实践指南》推荐泊沙康唑用于侵袭性曲霉病挽救治疗(强推荐,中等质量证据)[80]。2017年由欧洲临床微生物和感染性疾病学会-欧洲医学真菌学联盟-ERS指南建议泊沙康唑作为血液病患者鼻窦曲霉病的备选治疗(C级推荐)[40]。
专家建议:现有临床研究数据尚不支持将泊沙康唑口服制剂作为治疗侵袭性曲霉病的一线药物,但是,对于病情稳定的非重症感染患者,泊沙康唑可作为备选治疗药物或标准一线治疗方案治疗失败(包括临床疗效不佳或不能耐受)后的挽救性治疗药物。
2.2.2.2 慢性肺曲霉病(chronic pulmonary aspergillosis,CPA) 英国一项回顾性临床研究总结了79例接受泊沙康唑治疗(其中58位为挽救治疗)的CPA患者资料,结果显示6个月的有效应答率为61%,12个月时为46%[124],与既往临床研究中伏立康唑和伊曲康唑的临床疗效相似[124]。另一项英国临床研究,纳入了78例一线治疗失败或不耐受的成年CPA患者,接受泊沙康唑挽救治疗4或6个月时44%的患者应答良好并可接受长期治疗[125]。2016年欧洲临床微生物和感染疾病学会/ERS联合发布的《慢性肺曲霉病的诊断和管理指南》推荐泊沙康唑作为治疗CPA的口服抗真菌药物之一(B级推荐)[126],2016美国感染病学会《曲霉病诊断和管理实践指南》推荐泊沙康唑为CPA治疗的备选(挽救性治疗)药物之一[80]。
专家建议:研究结果显示泊沙康唑治疗CPA的临床疗效与伏立康唑、伊曲康唑等CPA一线治疗方案相似,在其他唑类药物治疗失败或不能耐受的CPA患者中,泊沙康唑具有一定良好疗效。建议在CPA的初始治疗时将泊沙康唑作为备选方案。对于伏立康唑或伊曲康唑治疗失败或不能耐受的CPA患者,泊沙康唑可以作为挽救性治疗药物之一。
2.2.3 泊沙康唑在毛霉病治疗中的应用 美国一项回顾性临床研究纳入了91例其他抗真菌药物难治和/或不耐受的毛霉病患者(其中主要为肺毛霉病和鼻窦毛霉病),接受泊沙康唑治疗12周,完全和部分缓解率为60%,疾病稳定率为21%[127]。另一项美国研究报道了24例接受泊沙康唑挽救治疗的毛霉病患者(主要为鼻脑型),治疗成功率为79%,90 d毛霉病相关存活率高达82.8%[128]。德国一项基于Pub Med的病例报道研究,收集2003~2011年间共96例使用泊沙康唑治疗的毛霉病患者病例的分析结果显示,其中81.3%患者联合两性霉素B脂质制剂治疗,毛霉病的完全应答率高达64.6%,其中多为已经侵犯了中枢神经系统的鼻脑型患者,且大部分完全应答患者为一线治疗[129]。我国一项收集1970~2015年间发表的174例肾移植患者感染各种毛霉病的研究发现,13例为泊沙康唑治疗患者,泊沙康唑治疗的总生存率为92.3%,优于去氧胆酸两性霉素B(47.4%)和两性霉素B脂质体(73.4%)[104]。此外,在一些个案报道中,不同剂型的泊沙康唑也曾成功用于中枢神经系统毛霉病的治疗[101,130]。根据2013年欧洲临床微生物和感染性疾病学会毛霉病指南的推荐,对于存在毛霉感染流行环境暴露的粒细胞缺乏患者或GVHD患者,泊沙康唑可作为预防性抗真菌治疗的首选药物(C级推荐);在毛霉病的初始治疗方案中,泊沙康唑是唯一获得推荐的非两性霉素B类抗真菌药物(B级推荐,推荐等级仅次于L-AmB);在毛霉病的挽救性治疗中(包括难治性病例及不能耐受病例),泊沙康唑是首选药物(A级推荐)。欧洲白血病感染会议指南ECIL-6推荐泊沙康唑单药或联合方案均可作为毛霉病一线治疗药物之一(CⅢ级推荐),同时推荐为挽救和维持治疗药物(BⅡ级推荐)[131]。欧洲临床微生物和感染性疾病学会-欧洲医学真菌学联盟联合指南明确:对于挽救治疗,强烈推荐泊沙康唑4×200 mg/d[132]。
专家建议:对于存在毛霉感染流行环境暴露的粒细胞缺乏患者或GVHD患者,建议将泊沙康唑作为预防性抗真菌治疗的首选药物。在毛霉病的初始治疗中,建议泊沙康唑作为两性霉素B类抗真菌药物的备选,用于病情稳定的非危重患者或不能使用两性霉素B类抗真菌药物的患者。在毛霉病的挽救性治疗中(包括难治性病例及不能耐受病例),泊沙康唑可作为替换两性霉素B类抗真菌药物的首选药物。
2.2.4 泊沙康唑治疗其他少见IFD的临床研究球孢子菌病多数情况下为自限性疾病,通常无症状或症状轻微,但是严重病例(如肺球孢子菌病和播散性球孢子菌病)治疗较为困难,常发生于免疫低下患者。美国一项开放标签、跨国临床研究纳入了15例两性霉素B难治性肺或播散性球孢子菌病患者,给予泊沙康唑口服混悬液治疗34~365 d,结果显示73%的患者获得了完全或部分应答,且不良反应发生率较低[133]。美国一项回顾性分析显示,泊沙康唑挽救治疗21例球孢子菌病患者17个月,临床改善率为75%[134]。另一项美国多中心临床研究,纳入了20例慢性肺球孢子菌病或非脑膜播散性球孢子菌病患者,给予泊沙康唑中位治疗时间为173 d,结果85%的患者应答良好,且常见不良反应仅为口干及头痛等[135]。
镰刀菌病也是血液系统恶性肿瘤和HSCT患者常见的IFD类型,其病死率可高达70%,且目前两性霉素B类药物治疗失败率较高。美国一项回顾性分析纳入21例两性霉素B难治性侵袭性镰刀菌病患者,其中主要为肺镰刀菌病和播散性镰刀菌病,泊沙康唑治疗12个月的成功率为48%[136]。
临床中有泊沙康唑成功治疗新生隐球菌性脑膜炎[137]和肺移植后尖端赛多孢子病[138]的病例报道。同时亦有动物研究证明,泊沙康唑治疗小鼠毛孢子菌病在降低组织真菌负荷和延长生存方面较氟康唑和两性霉素B有显著优势[139]。
专家建议:有小样本的回顾性病例研究或个案报道显示泊沙康唑治疗球孢子菌病、镰刀菌病、尖端赛多孢子菌病等少见IFD也可能获得较好疗效,但仍需高质量的临床研究对其疗效进行准确评价。对于标准方案治疗失败的上述少见IFD,泊沙康唑可以作为挽救性治疗的药物选择之一。
2.2.5 泊沙康唑在IFD治疗的药物经济学 一项侵袭性曲霉病挽救治疗的国外药物经济学研究显示,泊沙康唑(n=94)较两性霉素B和/或伊曲康唑(n=68)标准治疗能够显著提高难治性侵袭性曲霉病患者任意随访观察时间点(第28、42、84、182及365天)的生存率,2组患者1年生存率差异明显,分别为41%和14%(P=0.000 1),并且泊沙康唑肠溶缓释片挽救治疗可缩短整体治疗时间及节省总治疗费用[140]。
3 特殊人群使用
3.1 泊沙康唑在青少年/儿童患者中的应用 IFD是儿童血液恶性肿瘤患者,尤其是伴严重粒细胞缺乏和HSCT等高危因素患者的主要死亡原因之一,但患者疾病的临床表现、药物代谢特征均有别于成人患者等。泊沙康唑口服混悬液及泊沙康唑肠溶片的安全性和有效性在13~17岁年龄组中已得到证实[28]。虽然在13岁以下儿童患者中尚未明确,但众多临床研究也对<13岁人群使用进行了探索,且在预防治疗中表现出优于氟康唑、伊曲康唑和伏立康唑的趋势[141]。
泊沙康唑在青少年/儿童的PK与成年患者相似。一项对年龄为11个月至<18岁患者服用泊沙康唑口服混悬液的研究(n=136),每日总剂量不超过18 mg/kg,每日分3次使用结果显示,约50%患者达到了目标稳态血药浓度,平均浓度暴露在0.5~2.5 mg/L[28]。<13岁儿童使用泊沙康唑12 mg·kg-1·d-1预防治疗时,接受化疗的粒细胞缺乏患者中位血药浓度为0.438 mg/L,而HSCT患者血药浓度相对较高,约65%患者可达目标血药浓度之上(0.700 mg/L)。值得注意的是,上述两类患者无论泊沙康唑血药浓度高低,均可高效预防IFD,和氟康唑、伊曲康唑等相比预防IFD效果更好[142-145],充分说明泊沙康唑血药浓度虽与疗效有一定关系。但其在宿主细胞膜的高效聚集及抗真菌作用是其预防效能的关键。尽管如此,在临床中仍应密切关注可能影响血药浓度的各种不利因素,如胃肠道黏膜炎、使用质子泵抑制剂、急性胃肠GVHD等[146-147]。
泊沙康唑预防治疗青少年/儿童患者的真菌感染突破率低。2015年发表的一项回顾性、单中心临床研究纳入了93例中位年龄12岁伴粒细胞缺乏的儿童血液恶性肿瘤患者,分别接受泊沙康唑(12 mg/kg,分3次口服)、氟康唑和伊曲康唑预防治疗。结果显示,观察期内3组中均有1例确诊为侵袭性曲霉病,氟康唑组和伊曲康唑组分别有1例和2例拟诊为IFD,3组间治疗相关不良事件发生率差异无统计学意义[142]。另一项回顾性、多中心临床研究纳入了33例中位年龄8岁的粒细胞缺乏患者,使用泊沙康唑预防治疗中1例患者在预防104 d时发生了侵袭性曲霉病,总体预防突破发生率为3%[143]。2012年发表的一篇回顾性、单中心临床研究纳入60例年龄12岁以下的HSCT治疗血液恶性肿瘤患者,在接受泊沙康唑预防治疗期间,单次口服5 mg/kg和4 mg/kg剂量组均无IFD发生[144]。一项前瞻性、单中心临床研究纳入150例年龄范围为0.6~17.7岁的HSCT治疗患者,分别接受泊沙康唑、伊曲康唑和伏立康唑预防治疗,观察期内均无确诊IFD发生,但伊曲康唑组和伏立康唑组分别有2例和3例拟诊为IFD,3组间治疗相关不良事件发生率差异无统计学意义[145]。另有一项单中心临床研究纳入63例≤17岁接受泊沙康唑预防治疗的HSCT患者,其中31例接受口服混悬液,32例接受缓释片剂,结果显示在观察期内均无IFD发生,2种剂型疗效相当,但缓释片剂组泊沙康唑血药浓度更高[148]。
泊沙康唑治疗青少年/儿童IFD患者的研究也已开展。美国一项临床研究发现,在接受泊沙康唑挽救治疗时青少年(平均年龄14岁)患者中平均血药浓度为0.776 mg/L,治疗成功率为62.5%,均与成年患者血药浓度和治疗成功率相当[149]。德国一项多中心、回顾性临床研究纳入了接受泊沙康唑挽救治疗的15例中位年龄10岁的IFD儿童患者(包括侵袭性毛霉病及播散性念珠菌病等),泊沙康唑日治疗剂量为21 mg/kg,中位治疗时间为32 d,患者完全及部分应答率为60%,3个月总生存率为73%,且无患者因不良事件停药[150]。另一项意大利多中心、回顾性临床研究纳入了13例中位年龄11.7岁使用泊沙康唑进行挽救治疗的IFD患者,泊沙康唑日治疗剂量为12.5~16.5 mg/kg,中位治疗时间为147 d,中位随访时间为2.9年,患者总生存率高达84.6%[151]。
专家建议:泊沙康唑用于预防和治疗≥13岁的青少年患者IFD是有效和安全的,在儿童和青少年中其PK和临床疗效与成年患者相似。虽泊沙康唑目前暂未获批<13岁人群预防治疗适应证,但在预期氟康唑、伊曲康唑预防效果欠佳或不耐受情况下仍可考虑使用。泊沙康唑口服混悬液12 mg·kg-1·d-1,分3次口服方案在大部分儿童患者中预防疗效显著且安全性良好。
3.2 泊沙康唑在老年人中的应用 老年人服用同等剂量泊沙康唑药物浓度较高。美国一项PK研究显示,老年人相较年轻人Cmax和AUC分别提高26%和29%,但差异无统计学意义[20]。美国另一项基于18项对照研究的安全性评价研究显示,年龄<65岁和年龄≥65岁的健康志愿者服用泊沙康唑后总体不良反应发生率分别为57%和64%,其中肝酶升高发生率分别为1%和12%[152]。研究显示老年患者在使用泊沙康唑时无需调整剂量,但应该密切监测肝功能。
3.3 泊沙康唑在肥胖患者中的应用 目前基于化疗和HSCT等人群的PK研究显示,体质量并不影响泊沙康唑的血药浓度,但肥胖可能与表观分布容积较大有关[21,153-154]。目前,不建议在肥胖人群中对泊沙康唑剂量进行调整,但在肥胖人群中(体质量指数≥35 kg/m2)应适当延长泊沙康唑与雷诺嗪、鲁拉西酮等通过细胞色素P450-3A酶代谢药物的使用间期[155-157]。
3.4 泊沙康唑在肝功能不全患者中的应用 美国一项研究对不同肝功能分级患者单次口服泊沙康唑混悬液400 mg后的PK进行评估,结果显示轻、中、重度肝功能不全患者平均AUC与正常者相比分别升高43%、27%和21%,Cmax与正常者相似,不良反应发生率差异亦无统计学意义。以上结果提示肝功能不全对泊沙康唑PK无显著影响。因此,肝功能不全患者服用泊沙康唑无需进行剂量调整[158]。
3.5 泊沙康唑在肾功能不全患者中的应用 单次口服400 mg泊沙康唑混悬液后,轻、中度肾功能不全患者PK参数与正常者差异无统计学意义,但是在重度肾功能不全患者中AUC范围存在较高的变异性。因此,对于肾功能不全患者泊沙康唑无需调整剂量,但是在重度肾功能不全患者中应对突破性真菌感染进行密切监测。
美国一项Ⅲ期、多中心、开放标签研究的分析显示,在使用泊沙康唑对IFD进行挽救治疗时,肾功能不全和肾功能正常患者的治愈率分别为49%和42%,而2组不良反应比较差异亦无统计学意义。可见,肾功能不全并不影响泊沙康唑治疗IFD的疗效和耐受性[159]。
3.6 泊沙康唑在重症患者中的应用 危重症患者特殊机体状态及复杂用药情况均会对口服泊沙康唑PK产生影响,因而这类患者应首选泊沙康唑静脉剂型。德国一项研究显示,外科ICU接受腹部手术患者经鼻饲给予泊沙康唑时,因吸收欠佳导致泊沙康唑血药浓度不足[160]。澳大利亚一项针对ICU患者的PK研究显示,在接受治疗剂量泊沙康唑时,仅17%的患者Cmin达到了预防治疗目标血药浓度,4%的患者Cmin达到了治疗目标血药浓度,药物相互作用的存在可能是导致泊沙康唑吸收不良的主要原因[161]。2018年澳大利亚一项ICU患者中静脉剂型泊沙康唑PK研究显示,泊沙康唑剂量300 mg静脉用药时,患者从0到无穷大时间的血药浓度时间AUC仅是健康人群的39%,而表观分布容积和清除率是健康人群的2倍,预估达到稳态时平均血药浓度为747μg/L,可见即便使用静脉剂型制剂ICU患者的药物暴露仍低于健康人群[162]。因此,泊沙康唑在ICU患者中的使用需要密切监测和更多探索。
泊沙康唑作为第二代三唑类抗真菌药物,2005年国外首次上市以来十几年的临床实践证明,其在血液恶性肿瘤化疗粒细胞缺乏患者及伴GVHD的HSCT患者中预防IFD效果和获益显著优于其他常用抗真菌药物;同时在侵袭性曲霉病、CPA、毛霉病及球孢子菌病等较罕见真菌感染的挽救及一线治疗中也展现出明显的优势,较同类药物更具药物经济学价值,为临床真菌感染防治提供了更多选择。本共识专家组以国内外临床实践及相关研究为依据,提出了上述专家建议,供读者参考。
共识编写组成员
(按姓氏汉语拼音排序)
陈佰义(中国医科大学附属第一医院)
冯四洲(北京协和医学院)
贺 蓓(北京大学第三医院)
胡 炯(上海交通大学医学院附属瑞金医院)
黄 怡(上海长海医院)
刘又宁(解放军总医院)
刘正印(北京协和医院)
佘丹阳(解放军总医院)
施 毅(解放军东部战区总医院)
孙于谦(北京大学人民医院)
王明贵(复旦大学附属华山医院抗生素研究所)
王 睿(解放军总医院)
谢灿茂(中山大学附属第一医院)
徐英春(北京协和医院)
执笔者
佘丹阳
利益冲突所有作者均声明不存在利益冲突
