肿瘤相关血管内皮细胞对单核细胞趋化的影响
2020-02-25陈雨蒙乔春燕刘欣辰任春霞郑梦丹郑适泽孙宏晨
陈雨蒙 乔春燕 刘欣辰 孟 琳 任春霞 郑梦丹 郑适泽 孙宏晨
(1.吉林省牙发育及颌骨重塑与再生重点实验室 吉林 长春 130021;2.吉林大学口腔医院病理科,3.牙体牙髓科,4.牙周科,吉林 长春 130021)
头颈部鳞状细胞癌(HNSCC)是一种常见的恶性肿瘤,有局部浸润率高、颈部淋巴结转移和预后不良的特点。目前该肿瘤的常规治疗手段并没有取得令人满意的效果。长期以来,肿瘤被认为是孤立的肿块,在器官的特定部位独立存在。近年来,人们逐渐认识到肿瘤微环境 (tumor microenvironment,TME)在肿瘤的发生、发展、侵袭和转移中发挥重要作用。TME是一个动态网络,它包括肿瘤细胞、细胞外基质和肿瘤间质组织等,是影响肿瘤进展和转移的关键因素。其中,肿瘤相关成纤维细胞(cancerassociated fibroblast,CAF)、肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)、间充质干细胞(mesenchymal stem cell,MSC)和血管内皮细胞(VEC)等都是TME的重要组成部分。这些细胞通过分泌多种细胞因子、趋化因子、生长因子和酶,影响肿瘤的发生、发展、侵袭和转移[1-2]。
TAM作为肿瘤微环境及免疫细胞的重要组成部分,已经成为抗肿瘤研究中的关键靶点。作为浸润在TME中最丰富的免疫细胞,TAM从早期癌变到肿瘤转移的过程都发挥着重要作用。TAM在TME内主要极化为2种类型:一种是经典激活类型(M1型巨噬细胞),具有抑制肿瘤的作用;另一种是交替激活类型(M2型巨噬细胞),具有支持肿瘤侵袭和进展的作用,且与多种癌症的不良预后显著相关。在肿瘤形成的初始阶段,外周血中的单核细胞聚集到肿瘤周围,主要极化为M1型巨噬细胞,发挥抗肿瘤的免疫作用。然而,一旦肿瘤形成,在局部缺氧偏酸的TME条件下,巨噬细胞极化为M2型,具有促进肿瘤生长、侵袭、血管生成以及抑制免疫应答的作用[3-4]。本课题组已通过实验证实,在口腔鳞状细胞癌中存在大量的M2型巨噬细胞[5]。因此,研究TAM募集和极化的机制有助于研究新的抗肿瘤疗法,并改善HNSCC的治疗效果。
近年来不断有研究表明,VEC在肿瘤的进展和转移中也发挥重要作用[6-8]。VEC具有不规则的形态结构,细胞质可形成穿过血管腔的细长突起,细胞边缘皱缩导致细胞间连接丧失,细胞间出现缝隙使血管通透性增加,加之动、静脉分布不均且排列混乱,同时有大量新生血管形成,为肿瘤提供生长所需的氧气和营养。这些特殊的形态结构均为肿瘤的发生、发展、侵袭及转移提供了便利。然而,VEC作为单核细胞输送至TME的重要路径,是否对TAM的募集和极化产生影响,仍有待研究。
本研究以肿瘤诱导的VEC入手,观察TME中VEC的形态变化,利用Transwell及RT-PCR等技术探讨HNSCC中TAM的来源及极化的可能机制,从而为HNSCC的治疗提供理论依据。
1 材料和方法
1.1 实验细胞
HNSCC Cal-27细胞株由上海交通大学口腔医学院陈万涛教授馈赠,人脐静脉内皮细胞(human umbilical vein endothelial cells,Huvecs)、 舌鳞状细胞癌(tongue squamous cell carcinoma,TSCC)细胞、人咽鳞状细胞癌细胞 (human pharyngeal squamous cell carcinoma,Fadu)细胞株购自美国模式培养物集存库(ATCC),THP-1人单核细胞系由中国科学院生物化学与细胞生物学研究所馈赠。
1.2 主要试剂与仪器
H-DMEM 培养基粉剂(Gibco公司,美国)、1640培养基粉剂(Gibco公司,美国)、ECM培养基(Sciencell公司,美国)、胎牛血清(BI公司,以色列)、青霉素-链霉素(Hyclone公司,美国)、磷酸盐缓冲盐粉剂(中杉金桥公司,中国)、胰蛋白酶粉剂(Sigma公司,美国)、PMA (Solarbio 公司,中国)、Hoechst染液(Sigma 公司,美国)、Transwell小室(Costar公司,美国)、Trizol试剂(Invitrogen 公司,美国)、Primer Script Treagent Kit试剂盒 (生工生物公司,中国)、SYBR remix Ex Taq试剂盒 (生工生物公司,中国)。
1.3 细胞培养
Cal-27、Fadu细胞培养于含10%胎牛血清的HDMEM培养基 (含100 U/mL青霉素和100 μg/mL链霉素)中,Huvecs培养于ECM培养基,THP-1培养于含10%胎牛血清的1640培养基 (含100 U/mL青霉素和100 μg/mL链霉素)中,将其置于37℃、5%CO2的恒温培养箱中培养。贴壁细胞每3 d传代,THP-1悬浮细胞每2~4 d换液,取对数生长期细胞进行实验。
1.4 收集条件培养基
Cal-27、Fadu细胞培养于含10%胎牛血清的H-DMEM培养基中,于37℃、5%CO2的恒温培养箱中培养48 h;收集培养基,0.22 μm滤器滤过细胞碎片,-70℃保存备用,此即条件培养基(conditioned medium,CM)。
1.5 显微镜观察形态
取对数生长期的Huvecs细胞接种于培养皿中,分别使用ECM培养基和Cal27条件培养基培养24 h,在倒置显微镜下拍照观察。
1.6 Transwell小室检测细胞迁移情况
采用5 μm微孔聚碳酸酯膜Transwell小室,将Hoechst染液预处理30 min的THP-1细胞以每孔1×105个接种于上室,在下室分别加入600 μL正常血管内皮细胞条件培养基或Cal27诱导的内皮细胞培养基,每组设置3个复孔,避光培养6 h后,取出上室,在荧光显微镜下观察。随机选取3个视野计数细胞并拍照,计算穿膜细胞数。
1.7 实时定量RT-qPCR
用HNSCC的条件培养基将VEC诱导为肿瘤相关VEC。将THP-1细胞分为3组,使用PMA诱导THP-1贴壁为巨噬细胞,分别与正常内皮细胞、Cal27相关 VEC、Fadu相关 VEC共培养 72 h。按Trizol说明书步骤分别提取每组细胞的总RNA,使用Primer Script Treagent Kit试剂盒将提取的纯度和完整性良好的RNA反转录成cDNA;再以cDNA为模板,使用SYBR remix Ex Taq试剂盒进行RT-qPCR。以β-actin为内参,检测白细胞介素-10(interleukin 10,IL-10)、白细胞介素-6(interleukin 6,IL-6)、白细胞介素-1β(interleukin 1β,IL-1β)、 肿瘤坏死因子 α (tumor necrosis factor α,TNF-α)、 精氨酸酶 1(arginase 1,Arg-1)、集落刺激因子(colony stimulating factor ,CSF)、趋化因子 2(chemokine ligand 2,CCL2)、趋化因子 5(chemokine ligand 5,CCL5)、趋化因子 8(chemokine ligand 8,CCL8)、趋化因子 12(chemokine ligand 12,CXCL12)、 趋 化 因 子 16(chemokine ligand 16,CXCL16)的表达,引物序列见表1。采用2-ΔΔCt法计算目的基因相对表达量。
1.8 统计学分析
采用SPSS 17.0统计软件进行单因素方差(One Way ANOVA)分析,各组间比较采用Tukey法及LSD法。P<0.05表示差异具有统计学意义,P<0.01及P<0.001表示差异具有显著统计学意义。
2 结果
2.1 肿瘤诱导VEC形态变化
如图1A所示,显微镜下观察内皮细胞形态,正常VEC呈梭形,细胞形态清晰,排列整齐,呈单层铺路石状,细胞长满时呈漩涡状或鱼群状。如图1B所示,用Cal27诱导24 h后的内皮细胞,细胞形态伸长,变为多角形,细胞间连接疏松,排列紊乱,细胞内颗粒状物质增多。
2.2 单核细胞趋化实验
用HNSCC的条件培养基将VEC诱导为肿瘤相关VEC,使用Hoechst染液预处理单核细胞THP-1,分别使用正常内皮细胞条件培养基,Cal27及Fadu相关VEC条件培养基趋化单核细胞。Transwell实验结果表明,与正常内皮细胞相比,Cal27相关VEC趋化单核细胞能力显著增强 (P<0.001),Fadu相关VEC趋化单核细胞能力也增强(P<0.05)。详见图2。

表1 RT-qPCR引物序列Table 1 Primer sequences used for RT-qPCR
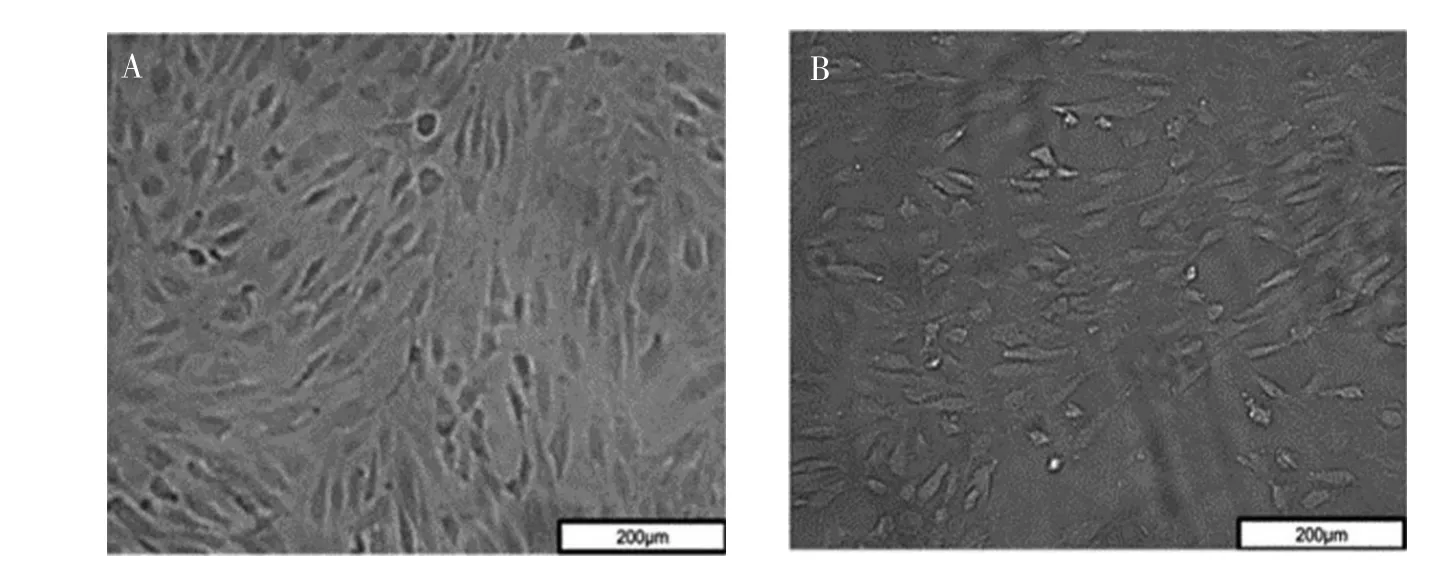
图1 VEC的形态学表现(×20)Figure 1 Morphology of vascular endothelial cells(×20)
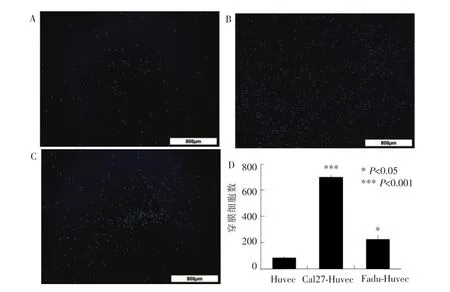
图2 VEC胞经不同细胞诱导后的Tanswell实验(×4)Figure 2 Transwell experiment of vascular endothelial cells induced by different tumor cells(×4)
2.3 VEC分泌单核细胞趋化因子
分别使用Cal27和Fadu诱导VEC 24 h,通过RT-qPCR实验发现,与正常VEC相比,肿瘤诱导后的VEC分泌多种单核细胞趋化因子的能力增强。如图 3所示,Cal27相关 VEC分泌 CCL2、CXCL16、CSF 增多 (P<0.05),CCL8 的表达明显升高 (P<0.01),CCL5 的表达显著上调(P<0.001)。 Fadu 相关VEC 分泌的 CCL2、CCL12 增多 (P<0.05),CCL5、CCL16、CSF 的表达明显上调 (P<0.01),CCL8 的表达显著升高(P<0.001)。

图3 RT-qPCR检测单核细胞趋化因子Figure 3 Detection of monocyte chemokines by RT-qPCR
2.4 肿瘤诱导后的VEC影响巨噬细胞极化表型
用PMA将单核细胞THP-1诱导为巨噬细胞,分别用正常VEC、Cal27相关VEC、Fadu相关 VEC与巨噬细胞共培养,72 h后检测巨噬细胞极化相关基因的表达。结果如图4所示,与正常内皮细胞组对照,实验组发现M1型巨噬细胞相关基因TNF-α、IL-6和IL-1β无明显变化,差异没有统计学意义。M2型巨噬细胞相关基因IL-10及Arg-1的mRNA表达明显上调(P<0.05)。

图4 RT-qPCR检测巨噬细胞极化表型Figure 4 Detection of macrophage polarization phenotype by RT-qPCR
3 讨论
如图5所示,本实验发现肿瘤诱导后的血管内皮细胞形态发生改变,细胞质形成较长的突起,细胞皱缩使细胞间连接疏松;RT-qPCR发现肿瘤相关血管内皮细胞可以分泌大量单核细胞趋化因子,将循环系统的单核细胞募集至TME,并进一步通过分泌某种细胞因子将巨噬细胞极化为IL-10、Arg-1高表达的M2型巨噬细胞,而M1型巨噬细胞的标志物 IL-6、TNF-α、IL-1β 变化不明显。
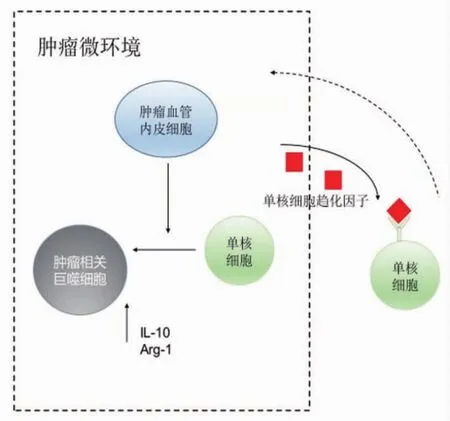
图5 实验模式图Figure 5 Experimental model diagram
目前研究发现,TAM具有促进肿瘤生长、侵袭、血管生成以及抑制免疫应答的作用,故TAM的来源引起人们的密切关注。现TAM通常被认为来源于外周血单核细胞,被基质细胞和肿瘤细胞表达的多种趋化因子和细胞因子招募至TME中,如单核 细 胞 趋 化 因 子 CCL2、CCL3、CCL5、CCL8、CXCL12、CXCL16和巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)等。 进一步,募集而来的单核-巨噬细胞在TME中可能被极化为M1型和M2型。研究发现,在大部分肿瘤内,单核细胞受Toll样受体相关配体和γ-干扰素(interferon-γ,IFN-γ) 激活可极化为 M1 型 TAM,促炎细胞因子表达明显升高,如IL-1、IL-6、IL-12和TNF-α等,可以在一定程度上抑制肿瘤的生长;TME 内的多种细胞因子如 IL-4、IL-6、IL-10、IL-13、IL-21和IL-33,可将单核细胞极化为M2型TAM,并分泌大量与组织重塑相关的因子,如血管内皮生长因子(vascular endothelial growth factor,VEGF)、基质金属蛋白酶 (matrix metalloproteinases,MMPs)家族的MMP-2和MMP-9等,促进肿瘤生长[9-11]。本实验发现VEC使巨噬细胞IL-10、Arg-1高表达。已有研究表明M2型巨噬细胞通过高表达Arg-1,将精氨酸水解为鸟氨酸和尿素,而L-精氨酸衍生的代谢产物、半胱氨酸和色氨酸是髓系来源的抑制性细胞(myeloid-derived suppressor cells,MDSCs)发挥免疫抑制作用的重要介质[12]。此外,TAM通过消耗Arg-1在一定程度上抑制了T细胞的免疫应答,促进了肿瘤的发展[13]。Colegio等[14]在多种小鼠肿瘤模型中发现,TAM通过缺氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)介导的缺氧或经乳酸途径诱导Arg-1表达升高,Arg-1的高表达促进了肿瘤的生长,而抑制Arg-1则可以抑制肿瘤生长[15]。IL-10是TME中重要的免疫抑制因子,与肿瘤进展及治疗中的免疫耐受密切相关[16]。且有研究表明,在HNSCC中,IL-10通过促进T细胞凋亡和抑制机体免疫系统促进肿瘤进展[17]。
现阶段已有大量以TAM为靶点进行抗肿瘤免疫治疗的研究[18],主要分为以下几个方面:抑制巨噬细胞募集进入肿瘤;抑制TAM的生存;将TAM转化为抗肿瘤M1表型,并阻断M2型TAM的极化。例如曲贝替定(trabectedin)是靶向单核细胞趋化因子CCL2的一种新型抗肿瘤药物。各种实验研究表明,trabectedin可以减少肿瘤组织中单核细胞的募集及其向TAM分化,目前它在治疗人体乳腺癌和其他实体恶性肿瘤的临床应用中取得了良好的效果[19]。有文献报道,使用M-CSF受体抑制剂可极大减少肿瘤中TAM的数量,并抑制肿瘤的进展、血管生成和转移[20]。血红素氧合酶-1(heme oxygenase-1,HO-1)能特异性地将血红素代谢为一氧化碳(CO)、胆绿素和亚铁离子,在抗炎、组织保护和抗氧化应激反应中发挥重要作用。在小鼠乳腺癌的研究中发现,抑制HO-1可使M2型TAM向M1型TAM极化,从而抑制肿瘤生长[21]。除此之外,已有研究报道二甲双胍作为一种广为人知治疗糖尿病的药物,在体内可诱导M1型TAM重编程并抑制M2型TAM极化,且在不同癌症模型中发挥积极作用[22-23]。而其在HNSCC的治疗方面,鲜少报道。
尽管研究表明癌细胞衍生的趋化因子可促进TAM的募集和极化[24],但VEC作为TME中重要的细胞群体,在TAM积累中的作用及在HNSCC的确切来源,仍未被完全了解。在本研究中,我们发现HNSCC的VEC分泌的多种趋化因子能募集并极化单核细胞。因此靶向这些趋化因子可能抑制HNSCC的发展和转移。
综上所述,本研究证实了在HNSCC中,VEC将单核细胞趋化至TME,并将其极化为IL-10、Arg-1高表达的M2型TAM,提出了一种HNSCC中TAM的来源和极化的可能机制,为HNSCC的免疫治疗提供理论依据。
