火鸡组织滴虫不同地区分离株的致病性比较
2020-02-24禚振男孔令明曲昌宝王子静刘丹丹陶建平许金俊
禚振男,孔令明,郭 平,曲昌宝,王子静,刘丹丹,陶建平,许金俊*
(1.扬州大学 兽医学院,江苏 扬州 225009;2.江苏动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009;3.山东省诸城市畜牧兽医局,山东 诸城 262200)
组织滴虫病是由火鸡组织滴虫引起的鸡形目禽类的一种原虫病,以肝脏坏死、盲肠肿大和排硫磺样粪便为主要特征[1]。组织滴虫病在火鸡中的死亡率接近100%,而在鸡中仅有10%~20%的病死率[2]。出于公共卫生的考虑,目前用于预防和治疗组织滴虫病的药物基本已被禁止和限制使用,而使用驱虫剂虽然可以控制通过鸡异刺线虫的传播,但不能预防通过泄殖腔途径的水平传播,使得该病在火鸡群和鸡群中经常暴发和流行,给养禽业造成了巨大的经济损失[3]。已有研究报道表明,火鸡组织滴虫激发机体的免疫以细胞免疫为主,且体外连续培养传代后其毒力会显著降低,对火鸡和鸡安全无副作用,免疫后能有效抵抗强毒的感染,因此,研制能激发细胞免疫且安全的致弱活疫苗是该病免疫预防的有效途径,有很好的应用前景[4-5]。
组织滴虫病暴发时,一些火鸡群或者鸡群仅表现出轻微发病和死亡,而有些火鸡群或者鸡群则表现较高的死亡率。这些差异表明,在火鸡组织滴虫中不同虫株间的毒力可能存在差异性,不同虫株之间存在不同的基因型差异[6]。本研究通过火鸡组织滴虫泄殖腔感染黄羽肉鸡的方法,比较了从江苏扬州市不同地区分离得到的2株火鸡组织滴虫JSYZ-A和JSYZ-B致病力的差异,为进一步建立动物感染模型,开展组织滴虫病致弱活疫苗的研究奠定基础。
1 材料与方法
1.1 主要试剂Medium 199(1×)、灭活马血清购自美国Gibco公司;米粉购自美国Sigma-Aldrich公司;台盼蓝染色液购自北京索莱宝科技有限公司;其他试剂为国产分析纯。
1.2 试验动物与虫株1日龄苏禽黄羽肉鸡30只,购自中国农科院家禽研究所育种中心,出壳后即饲喂在严格消毒的适宜环境中,供给充足的水和饲料,饲料和水中未添加任何药物。
火鸡组织滴虫JSYZ-A株为从江苏省扬州市仪征市暴发组织滴虫病的草鸡群中分离得到的单克隆虫株;JSYZ-B株为从江苏省扬州市邗江区暴发组织滴虫病的草鸡群中分离得到的单克隆虫株。虫株在含90% M199培养基,10%马血清,11 mg米粉和健康鸡盲肠细菌的基础培养基中40℃厌氧培养繁殖,在含10%二甲基亚砜的基础培养基中进行液氮冻存,并且冻存的虫株能够成功复苏。
1.3 试验设计对复壮培养2 d的火鸡组织滴虫JSYZ-A和JSYZ-B株经台盼蓝染色后计数,调整各株火鸡组织滴虫的数量达到105个/mL,吸取1 mL培养液分装到10个1.5 mL EP管中,3 000 r/min离心5 min,弃上清700 μL,将沉淀轻轻吹匀,接种前放入40℃恒温培养箱中保存。将饲养至7 d的苏禽黄羽肉鸡测体质量,随机分为A、B、C 3组,每组体质量基本一致。A组感染火鸡组织滴虫JSYZ-A株,B组感染火鸡组织滴虫JSYZ-B株,C设为阴性对照组接种空白对照培养基,各组均经泄殖腔感染途径感染,试验分组设计见表1。感染后每天观察记录鸡的精神、食欲、粪便、发病与死亡情况,死亡鸡立即剖检观察内脏病变。感染后15 d 对所有组存活的鸡测体质量并扑杀。
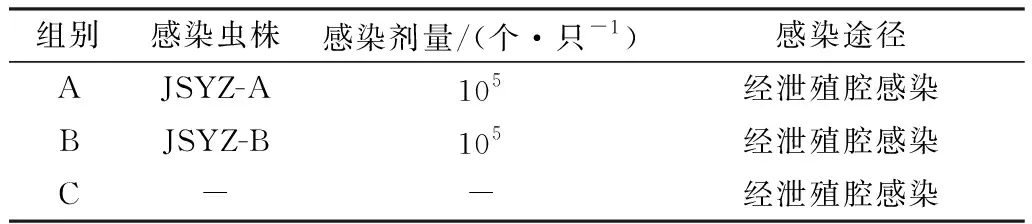
表1 试验设计和接种途径
1.4 虫株的致病力评价以每组的病死率、平均增重、相对增重率和病变计分作为主要评价指标:病死率(%)=(死亡鸡数/开始鸡数)×100%;平均增重=(试验结束时体质量-接种时体质量)/试验天数;相对增重率(%)=接种组平均增重÷未接种组平均增重;盲肠和肝脏病变计分标准参照文献[6]的标准,具体标准如下:
盲肠:0分.盲肠壁纵向褶皱特征良好,缺乏肉眼可见的损害,盲肠内容物呈稠状,粪便深色,没有干酪样的渗出液;1分.盲肠壁增厚或存在散在瘀点,或两者兼而有之;2分.盲肠壁增厚适中,盲肠有干酪样渗出液或内容物形成干酪样核心,盲肠内容物颜色改变或盲肠没有内容物和出血点;3分.盲肠壁增厚,盲肠内容物呈明显的干酪核心,或盲肠无内容物或盲肠壁出现瘀点;4分.盲肠壁显著增厚,盲肠黏膜层出现纤维性坏死和溃疡,盲肠内有干酪样核心或无内容物,存在出血性盲端,或盲肠断裂导致腹膜炎发生。
肝脏:0分.没有肉眼可见的圆形坏死灶;1分.存在1~5个小型的圆形坏死灶(直径小于5 mm);2分.出现许多小的圆形坏死灶(超过5个),或出现大的坏死灶(直径超过5 mm);3分.肉眼可见许多小的和大的坏死灶;4分.呈现复杂病灶和许多混合性损害。
1.5 数据处理与分析用SPSS软件对平均增重进行一维方差描述性统计分析。应用GraphPad Prism 软件对肝脏和盲肠平均病变计分进行统计分析,并以P<0.05作为显著性判断标准。
2 结果
2.1 发病和死亡情况于感染6~7 d后,鸡群开始发病,病鸡表现为精神萎靡,食欲下降,羽毛蓬乱,粪盘中出现硫磺样粪。A组发病情况相较B组情况稍微严重,C组未出现任何症状。感染JSYZ-B株的B组在感染后15 d内鸡未出现死亡,感染JSYZ-A株的A组在感染后15 d内鸡死亡1只,病死率为10%。
2.2 平均增重与相对增重率感染后15 d扑杀时各组的增重情况详见由表2。结果显示,3组试验鸡感染前的平均体质量差异不显著(P>0.05);感染15 d 后试验结束,空白对照组C与感染A、B组的平均体质量和平均增重差异显著(P<0.05),虫株感染后增重显著降低;不同株对试验鸡体质量有一定影响,其中JSYZ-A株对增重的影响稍大于JSYZ-B株,但不同虫株间的平均增重和相对增重率的差异不显著(P>0.05)。
2.3 病变计分不同虫株感染引起鸡盲肠和肝脏病变损伤计分的统计结果见图1。由图1可知,JSYZ-B株与JSYZ-A株的肝脏病变计分存在显著性差异(P<0.05),而盲肠病变计分差异不显著。感染后15 d部分鸡肝脏和盲肠的大体病变见图2。

表2 不同虫株感染对鸡增重的影响 g
3 讨论
自火鸡组织滴虫病首次报道以来,已经有过不少关于人工感染模型建立方面的研究和探索。现已经证实获得成功的感染方式有:将禽类暴露于虫体污染的土壤与或水;经口感染的阳性禽类的组织器官或排出粪便,或口服含有火鸡组织滴虫虫体的鸡异刺线虫卵,或口服蚯蚓;经过泄殖腔接种阳性禽类感染的脏器或粪便,或泄殖腔接种含有火鸡组织滴虫虫体的异刺线虫的幼虫等等。但是,这些方法或途径均存在影响因素多、不可控、难以重复和复制等缺点,在一定程度程度上也制约了该病的研究[3]。近十年来,随着火鸡组织滴虫体外分离培养技术的成功,口服和经泄殖腔接种体外培养的虫体相比过去常用的方法结果更为可靠和信赖,重复性也更好,两者相比,
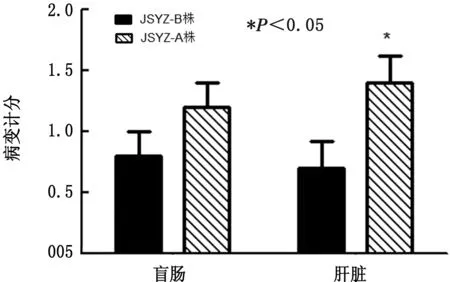
图1 不同虫株感染鸡的盲肠和肝脏病变计分统计分析
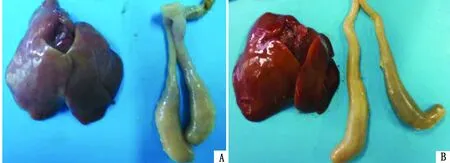
图2 火鸡组织滴虫人工感染15 d后的大体病变 A.JSYZ-A株感染鸡的肝脏、盲肠;B.JSYZ-B株感染鸡的肝脏、盲肠
尤以泄殖腔接种效果最佳[7]。大多数的研究者通过研究发现经泄殖腔感染火鸡组织滴虫时,感染体积应该控制在0.5~1.0 mL,并且在感染后需要将鸡倒提5 min,以防止培养基流出,影响感染效果[8]。研究中我们发现,泄殖腔感染体积为0.3 mL时感染效果最佳,并且因其感染体积小,对直肠的刺激微弱,不易引起鸡的努责排便。此外,在接种前6 h 对鸡进行禁饲,能够提高火鸡组织滴虫感染的成功率。
无论是自然感染还是人工感染,火鸡组织滴虫在不同品种、品系或不同地区的家禽群体中导致的发病率、病死率、临床表现和脏器的大体变化均有不同程度的差异[3,7]。究其原因,禽类年龄、感染剂量、品系以及不同地区的虫株来源均会导致这种差异的产生[9-11], 其中毒力和基因型差异是一个重要的因素[6]。本试验感染的虫株为鸡源火鸡组织滴虫JSYZ-A株和JSYZ-B株分别分离自扬州仪征市和扬州邗江区,两者的实验室的体外培养过程和传代环境及次数是相同的。从人工感染的病死率和对肝脏、盲肠的损伤情况证实,JSYZ-A株的毒力更强,尤其在导致脏器的组织损伤方面差异显著,进一步验证了不同地区分离获得的火鸡组织滴虫虫株的毒力存在一定的差异。为进一步建立体外动物模型,研究其致病机制奠定了很好的基础,也为致弱活疫苗的制备提供了很好的候选虫株。
