金黄色葡萄球菌侵染对奶牛乳腺上皮细胞Nrf2和NF-κB信号通路转导的影响
2020-02-24王建强马晓敏崔璐莹李建基
王建强,李 俊,马晓敏,崔璐莹,孟 霞,李建基,王 亨*
(1.扬州大学 兽医学院,江苏 扬州 225009;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
奶牛乳腺炎是由各类病因引起的乳腺炎症,其特征在于乳汁的物理、化学和细菌学变化,以及乳腺组织的病理变化,并严重影响着乳汁的产量和质量[1]。奶牛乳腺内感染通常由病原微生物引起,目前已知的能引起奶牛乳腺炎的病原微生物有150种之多[2]。比较常见的有金黄色葡萄球菌(S.aureus)、大肠杆菌、克雷伯菌、链球菌等,其中以金黄色葡萄球菌较为常见,且可造成严重经济损失,不易被清除[3]。
核因子-E2相关因子2(Nrf2)信号转导通路是氧化还原反应的主要调控途径。Nrf2信号通路调控某些主要的抗氧化酶和Ⅱ期解毒酶基因的编码,例如谷氨酸半胱氨酸连接酶(GCLM)、硫氧还蛋白还原酶1(TrxR1)、血红素加氧酶1(HO-1)、醌氧化还原酶1(NQO-1)等[4],因此,Nrf2信号通路在细胞抵御氧化应激的过程中起着重要的作用。有研究表明,热应激情况下奶牛乳腺上皮细胞(BMECs)内Nrf2及下游基因NQO-1表达升高以抵抗热应激对细胞的损伤。另有研究表明,脂多糖(LPS)与脂磷壁酸(LTA)刺激均可引起Nrf2下游基因HO-1和GCLM的上调[5],但Nrf2信号通路是否参与了S.aureus诱导的BMECs损伤仍不明确。核因子κB(NF-κB)信号转导通路在免疫调节中起重要作用,是免疫系统正常发育、特异性免疫和非特异性免疫中所必须的,也是介导炎症的主要信号通路[6-7]。有研究显示,S.aureus感染24 h上调了小鼠乳腺内TNF-α和IL-6的表达[8],同时,S.aureus感染BMECs 1 h后,NF-κB通路被显著激活[9]。但在S.aureus感染BMECs过程中,炎性因子及NF-κB信号通路的表达是否存在差异目前仍有待研究。本试验旨在通过体外建立的S.aureus感染BMECs模型,观察S.aureus侵袭过程中,Nrf2和NF-κB信号通路主要相关基因和蛋白表达的变化,以及对炎性因子表达的影响,为探讨奶牛乳腺炎的发病机制提供理论基础。
1 材料与方法
1.1 主要试剂与设备原代BMECs由扬州大学兽医学院外科课题组进行原代培养、纯化、鉴定与保存;S.aureus(ATCC 29213),购自美国典型菌种保存中心;无内毒素胎牛血清(Gibco,美国);DMEM/F-12培养液、L-谷氨酰胺、Ⅱ型胶原酶(Sigma,美国);胰蛋白酶(Amresco,美国);兔源Nrf2抗体(Abcam,USA);兔源β-actin、p65、P-p65、IκBα、P-IκBα抗体、山羊抗兔二抗(CST,美国);Trizol、逆转录试剂盒、SYBR荧光染料预混液、ECL发光液(诺唯赞,中国);BCA蛋白检测试剂盒、细胞蛋白抽提试剂盒(碧云天,中国);PVDF膜(Millipore,德国);蛋白电泳系统、PCR扩增仪、实时荧光定量PCR系统(Bio-Rad,美国)。
1.2 原代BMECs的分离与培养原代BMECs为本实验室通过酶消化法分离鉴定所得[10]。无菌采集健康的荷斯坦奶牛的乳腺组织,裁切成3 cm3左右立方小块,用含有300 IU/mL青链霉素的PBS反复冲洗后,置于含有5%胎牛血清的DMEM/F12培养液中,低温带回实验室进一步处理。用PBS反复清洗后,剪切成糊状,重悬洗涤,直至上清液清亮。用0.25%的Ⅱ型胶原酶按2∶1重悬组织,置于37℃培养箱内消化2~3 h。依次用20和80目的筛网过滤消化液,1 600 r/min离心6 min,收集细胞团块。使用PBS重悬并清洗细胞团块3次后,使用DMEM/F12完全培养液重悬细胞团块并置于37℃、5% CO2恒温培养箱中培养。待细胞铺满80%培养瓶底面后,利用差时消化法纯化BMECs。
1.3S.aureus的培养将S.aureus(ATCC 29213)接种至血液琼脂培养皿上,37℃培养10 h,挑取单个菌落接种至20 mL LB液体培养基中,在37℃恒温摇床中以120 r/ min培养至平台期。按1∶100转接至20 mL LB液体培养基中,37℃恒温摇床中以120 r/min培养至对数生长期,根据生长曲线计数备用。
1.4 qRT-PCR检测炎性因子和Nrf2信号通路关键基因表达将细胞按5×105个/孔接种至六孔培养板,待细胞汇合80%后更换无血清培养液;S.aureus按MOI = 1∶1侵染细胞。于感染后0,0.5,1,2,3,4,6,8 h提取RNA检测炎性因子;同时于感染后0,2,4,6,8 h提取RNA检测Nrf2信号通路关键基因表达水平。方法如下:使用Trizol法提取细胞总RNA,将RNA逆转录为cDNA,qRT-PCR检测Nrf2信号通路关键基因Nrf2,Keap1和NQO-1,炎性因子TNF-α、IL-1β和IL-8的表达量。引物如表1所示,每个样本重复3次,并以β-actin为参照,按照2-△△Ct法计算出每个基因的相对表达量。

表1 qRT-PCR扩增引物序列
1.5 Western blot检测Nrf2蛋白和NF-κB信号通路关键蛋白表达水平将BMECs按106个/孔接种至60 mm细胞培养皿,待细胞汇合80%以上后更换无血清培养液;S.aureus按MOI = 1∶1侵染细胞。于感染后0,1,2,4,6,8 h提取蛋白检测Nrf2蛋白表达量;于感染后0,0.5,1,2,3,4,5,6 h提取蛋白检测NF-κB信号通路关键蛋白p65,P-p65,IκBα和P-IκBα表达量。方法如下:BCA法调整蛋白浓度,进行聚丙烯酰胺凝胶电泳。转印至PVDF膜后,在5%脱脂乳内室温封闭2 h,一抗4℃孵育过夜。TBST漂洗PVDF膜后,在二抗内室温孵育2 h,显影后,通过灰度值对蛋白表达进行定量分析。
1.6 统计学分析使用SPSS17.0软件对结果进行统计学分析,结果以平均值±标准差表示。*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。
2 结果
2.1S.aureus侵染对Nrf2信号通路关键基因表达的影响S.aureus侵染BMECs后,Nrf2基因在侵染的2,4 h表达呈极显著上升(P<0.01),且在6,8 h 时呈极显著下降(P<0.01)(图1A);Keap1基因表达在侵染的2,4 h呈显著或极显著下降(P<0.05 或P<0.01),且在侵染的8 h呈显著上升(P<0.05)(图1B);NQO-1基因在侵染后2,4 h表达呈显著或极显著上升(P<0.05或P<0.01)(图1C)。故,S.aureus侵染细胞2,4 h时,细胞内Nrf2信号通路被激活,细胞内抗氧化水平提升;而在侵染的6,8 h时,细胞内Nrf2信号通路被抑制,细胞内抗氧化水平下降。

图1 S.aureus侵染BMECs对Nrf2通路关键基因表达的影响 A.Nrf2相对表达量;B.Keap1相对表达量;C.NQO-1相对表达量。注:与0 h相比,*表示差异显著,P<0.05;**表示差异极显著,P<0.01。下同
2.2S.aureus侵染对TNF-α、IL-1β和IL-8基因表达的影响S.aureus侵染BMECs 1,2,3,4,6,8 h后,TNF-α、IL-1β和IL-8基因的表达均呈现显著或极显著上调(P<0.05或P<0.01)(图2);故S.aureus侵染细胞后,可引发细胞内的炎性因子的合成和释放。
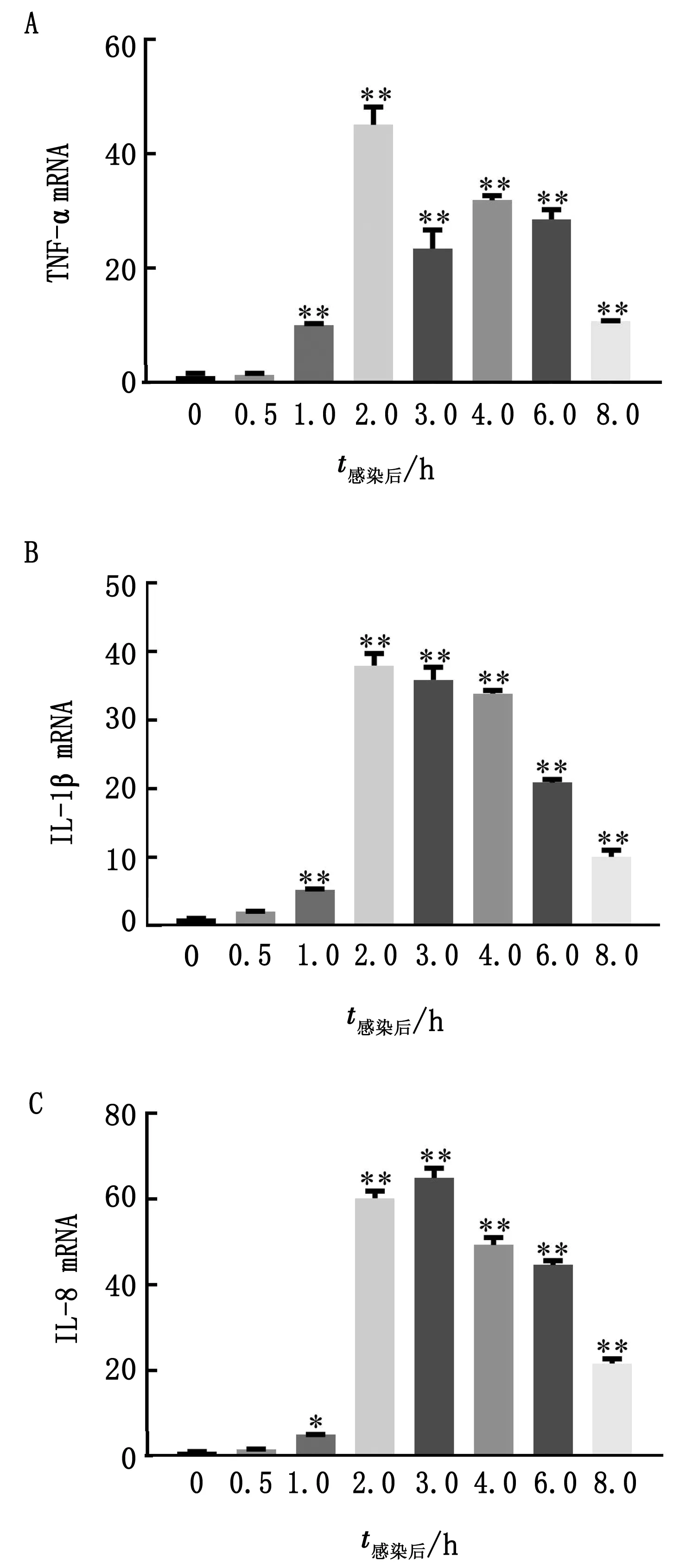
图2 S.aureus侵染BMECs对炎性因子基因mRNA表达的影响 A.TNF-α相对表达量;B.IL-1β相对表达量;C.IL-8相对表达量
2.3S.aureus侵染对Nrf2蛋白表达水平的影响S.aureus侵染BMECs 2 h后,Nrf2蛋白表达量显著上升(P<0.05),而在侵染后的6,8 h,Nrf2蛋白表达量呈显著或极显著下降(P<0.05或P<0.01)(图3);故Nrf2信号通路在感染后2 h时被激活,而在感染后6,8 h时被抑制。
2.4S.aureus侵染对NF-κB信号通路关键蛋白表达水平的影响S.aureus侵染BMECs 0.5,1,2,3,4,5,6 h后,p65磷酸化水平呈显著或极显著升高(P<0.05或P<0.01)(图4);IκBα磷酸化水平在感染后1,2,3,4 h呈显著或极显著升高(P<0.05或P<0.01);故S.aureus侵染BMECs后,可激活NF-κB信号通路。

图3 S.aureus侵染BMECs对Nrf2蛋白表达的影响 A.Western blot检测Nrf2蛋白表达结果;B.Nrf2相对表达量

图4 S.aureus侵染BMECs对NF-κB信号通路关键蛋白表达的影响 A.Western blot检测NF-κB信号通路关键蛋白表达结果;B.p65磷酸化水平;C.IκBα磷酸化水平
3 讨论
Nrf2信号通路是细胞氧化还原的主要调控通路,在生理条件下,Keap1通过泛素化降解Nrf2,从而抑制Nrf2的转录活性[4]。而在自由基和病原的刺激下,Nrf2在DJ-1蛋白的作用下被释放并入核,Nrf2与抗氧化元件(ARE)结合后激活下游靶基因的表达[11-12]。SUN等[13]还发现在细胞氧化还原稳态恢复后,Keap1重新入核并从ARE中释放Nrf2,将Nrf2运输回胞浆中。对Nrf2基因缺失小鼠模型的研究表明,Nrf2的缺失可能会加重S.aureus引起的败血症和急性肺损伤,这说明了Nrf2信号通路在S.aureus感染过程中的重要性[14-15]。本试验结果表明,在S.aureus感染后2 h,细胞Nrf2蛋白表达显著升高,Nrf2、NQO-1基因显著上调,Keap1基因显著下调,表明S.aureus刺激激活了Nrf2信号通路,释放下游解毒酶;而在感染后6,8 h时,Nrf2表达受到抑制,说明此时S.aureus抑制了Nrf2信号通路的表达。JI等[16]发现使用LPS作用于细胞24 h后Nrf2蛋白表达量显著降低;另有研究指出,LPS似乎对Nrf2的表达无影响[17];然而,低剂量的LPS诱导了Nrf2信号通路激活[18],因此,Nrf2信号通路的激活可能与LPS的剂量和作用时间有关。结合本试验结果,我们推测在S.aureus感染初期,细胞通过激活Nrf2途径上调解毒酶基因(如NQO-1)的表达,而在感染后期Nrf2信号途径可能受到抑制,表明此时抗氧化系统受到损伤。这也与曾慰等[19]观察到的结果相似。
NF-κB信号通路对免疫的主要调节作用分为经典通路与非经典通路。通常情况下,p65与p50构成的NF-κB异二聚体被IκB蛋白结合,从而使NF-κB结合DNA的特性被抑制。当宿主受到病原侵袭时,病原被模式识别受体(PAMP)识别,NF-κB通路被激活,IκB蛋白在IκB激酶的作用下发生磷酸化并与p65/p50二聚体解离,该二聚体核转位并作用于相应的靶基因[6-7]。本试验研究发现,在S.aureus侵染BMECs后,p65与IκBα蛋白的磷酸化水平明显上升,表明NF-κB通路被激活,p65与IκB蛋白分离并入核表达。这与吴建美等[20]发现的结果相符。
TNF-α是一种具有多生物功能的小分子蛋白,当炎症发生时,细胞产生的促炎性因子TNF-α与膜受体结合,促进了IκB蛋白磷酸化,进一步介导p65蛋白的入核[21]。IL-1β是炎症发生早期的重要促炎因子,可由多种细胞分泌[22],IL-1β能够提高细胞组织对TNF-α的敏感程度,同时刺激其他炎性因子产生,进一步放大炎性作用[23]。IL-8是一类趋化因子,可特异性趋化炎症细胞,是各种免疫细胞游走至炎症发生部位的关键因子[24]。关立增等[25]发现,S.aureus感染上调了BMECs内IL-6和IL-8的表达。在本试验中,在S.aureus感染后的1~8 h,BMECs内的TNF-α、IL-1β与IL-8的表达水平均显著升高,从而进一步说明细胞内炎性的发生。WANG等[26]研究表明,S.aureus诱导BMECs炎性因子TNF-α、IL-1β、IL-8表达,同时NF-κB信号通路被激活,这与本试验观察的结果相一致。
综上所述,S.aureus感染BMECs后,激活了Nrf2和NF-κB信号通路,促进炎性因子的表达和释放,说明Nrf2和NF-κB信号通路可能参与了S.aureus对BMECs的氧化和损伤过程,为探讨奶牛乳腺炎发病机制和防控提供了理论依据。
