绵羊弓形虫病垂直传播研究进展
2020-02-24杨玉荣
姜 楠,杨玉荣
(河南农业大学 牧医工程学院,河南 郑州 450002)
弓形虫(Toxoplasmagondii)是一种全世界普遍存在的机会性致病原虫,可感染几乎所有恒温动物的有核细胞,包括家畜和人类[1]。感染弓形虫是获得性免疫缺陷综合征患者死亡的主要原因之一[2-3]。弓形虫的传播途径包括水平传播和垂直传播。恒温动物可经摄入弓形虫卵囊污染的水果、蔬菜或水;输入含弓形虫速殖子的血液;摄入含速殖子的奶和奶酪;食用未煮熟的含有弓形虫包囊的肉品而水平感染。弓形虫速殖子可经母体胎盘或精液垂直传播[1]。母体感染弓形虫,虫体不仅在宿主细胞内生长、繁殖,还会通过胎盘、乳汁传染给后代,先天性感染的后代可能会发生流产、死胎、神经系统疾病、视网膜脉络膜炎、脑积水、颅内钙化[1,4-5]和间质性肺炎[6]。牛对弓形虫感染有一定的抵抗能力,而绵羊是弓形虫的易感宿主,弓形虫病是绵羊流产的主要的原因之一[7]。此外,根据绵羊弓形虫病流行病学特点,推测其呈现的弓形虫病高阳性率可能主要是内源性包囊激活传播途径,而不是外源性经卵囊传播途径[8]。
目前,对绵羊弓形虫病垂直传播的情况报道尚少。本研究就绵羊弓形虫病垂直传播情况、感染形式、致病特点以及防控进行综述,为了解绵羊弓形虫病垂直传播情况提供参考依据,为有效防控弓形虫对绵羊生殖健康的影响保障绵羊产业的持续发展提供指导依据。
1 绵羊弓形虫病流行病学
1.1 绵羊弓形虫病流行病学及风险因子世界范围内,山羊和绵羊广泛感染弓形虫,已从羊肉、羊奶和羊奶制成的奶酪中分离到活的弓形虫虫株[9-10]。血清学方法广泛用于弓形虫病的流行病学调查研究。目前,全世界约有140项研究对绵羊弓形虫病血清流行病学进行了调查研究,其阳性率为3%~96%[1]。我国约有50项关于绵羊弓形虫病的血清学调查研究,其阳性率为1%~39%[11-12]。世界范围绵羊弓形虫病感染率表现为大洋洲>北美洲>欧洲>亚洲>南美>非洲,中国的绵羊弓形虫病感染率(11.8%)低于亚洲(33.9%)平均水平(表1),可能与我国畜牧业集约化程度高和饮食习惯有关。不同地区的绵羊弓形虫病阳性率有差异,主要与猫的分布和数量、温暖潮湿的气候、流产史、海拔高度、绵羊的年龄、水源和降水量、集约化程度、放牧的密度、饲料类型、管理措施和周边环境有关[12]。
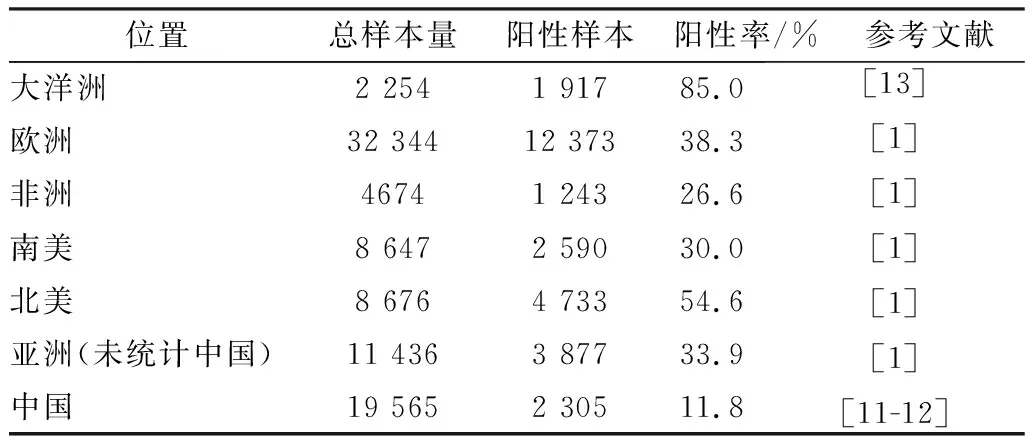
表1 绵羊弓形虫病流行病学及风险因子
1.2 不同绵羊种群弓形虫病感染率与流产率差异绵羊弓形虫病阳性率因种群不同而有差异。一般认为,绵羊弓形虫病主要是经摄入弓形虫卵囊途径感染,草食动物采食含弓形虫包囊的可能性比较小。但研究结果显示,位于同一地区的同一品种不同家族绵羊的弓形虫病,呈不平均分布,且差异较大。进一步研究发现,弓形虫感染和流产在家族之间不呈现随机分布,而与家族流产率呈显著相关,因此推测除卵囊途径以外,内源性垂直传播可能在绵羊弓形虫病传播过程占有一定的比例[14]。此外,如果卵囊是弓形虫病主要感染来源,那么不同动物的感染率是接近的,且随年龄增长感染率增高,然而流行病学调查发现绵羊弓形虫感染率明显高于其他动物[15],这种差异说明绵羊弓形虫病的传播可能还有其他的替代机制。
1.3 流产胎儿的弓形虫病流行病学衣原体、布鲁菌、沙门菌和弓形虫等病原均是引起绵羊流产的主要原因。研究发现,怀孕母羊因感染弓形虫病而引起流产、死胎的数量,占全部流产母羊的20%[1],经济损失巨大。2 000个弓形虫卵囊可引起母羊流产[16]。90%的流产胎儿组织(大脑、心脏、肺脏、肝脏、舌)可检测到弓形虫DNA,明显高于活胎儿(脐带)的弓形虫阳性率(46%),说明弓形虫与流产密切相关[17]。PEREIRA等[18]对流产胎儿进行了广泛的调查,23%(n=173)的流产胎儿体内有弓形虫或弓形虫DNA。MASALA等[19]对流产绵羊的胎盘和胎儿组织进行了分子流行病学调查发现弓形虫为最常见的病原,从流产胎儿的肌肉、肝脏、胃、脾脏、大脑和胎盘均可检出弓形虫DNA,11%的胎儿(n=2 471)组织中发现弓形虫DNA,其中胎盘的阳性率最高(32%),其次是肌肉和大脑;另外的调查发现,18%的流产胎儿和13%的胎盘(n=366)检测到弓形虫DNA[20],从而推测弓形虫病与绵羊流产密切相关。DUNCANSON等[21]从绵羊胎盘组织、胎儿大脑和心脏组织中检测到弓形虫DNA(61%,54/88),其中流产绵羊的弓形虫阳性率(94%,17/18)明显高于非流产绵羊(42%,37/70),推测弓形虫垂直传播是影响绵羊生殖健康的重要因素。HURTADO等[22]对流产绵羊调查发现,19%的流产胎儿和死胎(n=53)可检出弓形虫DNA,胎儿的大脑、脾脏、肺脏、胎盘、肝脏、肾脏和胎儿体液均可检出弓形虫DNA,其中大脑的阳性率最高。HIDE等[8,23]研究发现,绵羊弓形虫病垂直传播发生的比例很高,可达69%,并推测母羊弓形虫病垂直传播的感染途径可能主要是内源性包囊激活传播途径。
1.4 关于是否根据弓形虫感染史选择后备母羊的争论关于是否选用弓形虫感染史绵羊作为后备母羊,有两种观点。弓形虫慢性感染小鼠可发生高比例的先天性弓形虫感染[24],而弓形虫慢性感染大鼠仅发生低比例的先天性弓形虫感染[25]。但关于弓形虫慢性感染绵羊的情况,还不明确。新西兰、法国和英国绵羊广泛使用的S48株弓形虫速殖子活疫苗,一般在配种前3周注射,可有效防控绵羊弓形虫病引起的流产[26]。绵羊配种前8周口服感染弓形虫卵囊(大于200个),能在一定程度防御妊娠中期弓形虫感染而引起的流产[27]。这些报道推测绵羊感染弓形虫可获得终生性免疫,选择慢性弓形虫病母羊繁殖后代,可在一定程度上降低因弓形虫感染而引起的流产率。然而,MORLEY等[28]研究发现因感染弓形虫而流产的母羊,在后续妊娠过程中有55%的母羊连续发生因弓形虫引起的流产,弓形虫抗体不能有效防御先天性弓形虫病。CHIEBAO等[29]也发现,妊娠期慢性弓形虫病绵羊,可以再感染其他弓形虫虫株,说明选用慢性弓形虫感染期的母羊繁殖,不能有效降低弓形虫感染而引起的流产。这些观点的差异,可能与绵羊品系、家族、妊娠期、弓形虫基因型和虫株、感染途径等有关系,还需要鉴定感染虫株的基因型来进一步研究。
1.5 感染绵羊弓形虫虫株的基因型关于自然发生的绵羊弓形虫垂直传播的基因型,还未见报道。我们总结了全世界和我国绵羊弓形虫流行的主要基因型。目前,从绵羊分离到的虫株主要是ToxoDB#1和ToxoDB#3型弓形虫(Ⅱ型),其次是ToxoDB#2(Ⅲ型)[1,30-31]。从我国绵羊组织共分离得到14株弓形虫,其中有1株为ToxoDB#1或ToxoDB#3[32],有2株是ToxoDB#9[11],有7株为ToxoDB#2[33],有4株为ToxoDB#4[33]。全基因组测序证明ToxoDB#4和ToxoDB#9属于Ⅱ型弓形虫的同一分支[34]。
2 弓形虫引起绵羊流产的影响因素及对传播机制的初步研究
2.1 绵羊不同妊娠期感染弓形虫对传播效率和胎儿的影响绵羊弓形虫垂直传播途径包括内源性速殖子或活化的包囊经胎盘传播、外源性卵囊经胎盘传播和速殖子经乳汁传播[35-36]。大多数绵羊出生后经弓形虫卵囊途径感染弓形虫,但在绵羊孕期初次感染弓形虫,可引发弓形虫从母代传递到子代,约占绵羊弓形虫总感染率的4%[36]。牛对犬新孢子虫易感,新孢子虫病垂直传播的风险与孕期有关,妊娠中期感染易导致流产,孕晚期感染则可使胎儿获得免疫力,从而抑制虫体的增殖,产出临床上正常的胎儿,但为带虫者。与新孢子虫类似,弓形虫垂直传播的效率取决于母羊感染时的妊娠期,其传播效率在妊娠早期最低,在妊娠晚期最高。而弓形虫对妊娠早期的胎儿影响最大,常引起胚胎死亡、吸收、木乃伊胎和停止发育,导致母羊不育[37]。母羊妊娠中期感染弓形虫,87%的母羊流产或分娩死胎[38],引起胎儿的神经病理损伤,且损伤程度重于妊娠后期[39]。妊娠后70 d,胎儿可稳定产生抗弓形虫IgM和IgG抗体,具有一定程度的抗弓形虫作用[37]。而在怀孕后期感染弓形虫,母羊通常会产出健康的羔羊或弓形虫阳性的活胎[36-37,39-40]。弓形虫可突破胎盘屏障,感染滋养层巨细胞[41],但关于弓形虫引起绵羊生殖障碍的机制还不清楚,可能是弓形虫在胎盘和胎儿体内增殖,引起胎盘和胎儿损伤,诱发胎儿缺氧的直接影响,也可能是弓形虫感染后引起母羊激素或免疫系统异常而间接引起胎儿发育停止或流产[40]。
2.2 弓形虫感染妊娠期绵羊对宿主免疫反应的影响流行病学调查发现,育龄妇女的弓形虫血清阳性率较高,可能与妊娠期间激素水平的剧烈变化,抑制机体的免疫防御反应,对弓形虫更易感有关系[42-43]。而弓形虫感染妊娠期宿主,可启动Th1免疫反应的发生,抑制Th2免疫反应,产生活性氧自由基和一氧化氮等代谢产物。Th1免疫反应有利于控制寄生虫感染,但不利于胎儿存活,而Th2免疫反应不能有效控制弓形虫感染,但可促进妊娠的顺利进行,推测免疫反应的变化促进了胎盘损伤和流产[44-45]。
2.3 绵羊弓形虫病慢性感染期弓形虫的重新激活新孢子虫慢性感染期的怀孕母牛,新孢子虫可重新激活,启动内源性跨胎盘传播,且传播效率很高,其后代的阳性率可达95%,而经卵囊感染的母牛仅占1.9%[46-47]。弓形虫慢性感染期可以发生弓形虫的内源性跨胎盘传播,但效率低于新孢子虫[17,48]。关于弓形虫慢性感染绵羊垂直传播的临床发生比例,还不明确。已有报道表明,弓形虫慢性感染期的孕妇可发生弓形虫包囊活化,发生垂直传播[49-52]。
胎儿感染弓形虫可能是母体寄生虫血症、胎盘或子宫局部感染弓形虫所引起的,但也不能排除慢性感染的重新激活[52]。弓形虫慢性感染期弓形虫的重新激活可能与调节怀孕期间的T细胞免疫反应有关[53-54]。慢性弓形虫感染期,CD8+T细胞出现功能障碍,具体表现为凋亡增多、效应反应降低、淋巴细胞免疫抑制分子PD-1增多,可促进弓形虫缓殖子向裂殖子转化[55]。弓形虫慢性感染期(Me 49)Calomys callosus鼠孕期再感染RH虫株,结果发现胎盘可检测到弓形虫(活虫株和核酸),但胚胎未受感染,说明慢性弓形虫感染对先天性弓形虫传播有一定的保护力,然而胎盘感染的弓形虫没有确定是重新激活Me 49,还是再感染的RH虫株[56]。进一步的研究证实,弓形虫慢性感染期(Me 49)的Calomys callosus鼠孕期再感染巴西虫株TgChBrUD1或TgChBrUD2,不仅可以引起Me 49的重新激活,也可以再感染TgChBrUD1 或 TgChBrUD2,并引起不孕、胎儿发育异常和先天性弓形虫传播[57]。弓形虫慢性感染期孕畜是否会发生胎儿先天感染弓形虫,可能与宿主种类、虫株毒力和怀孕阶段有关系,关于这方面的研究尚需更多的证据,以推测其对人类的风险。
3 绵羊弓形虫病垂直传播的诊断方法
3.1 母羊弓形虫病急性期的临床表现一般认为,弓形虫卵囊的感染效率高于包囊和速殖子。绵羊感染弓形虫常呈现一过性发热和短暂的虫血症反应[58],在感染后7~14 d引起妊娠期母羊流产、死胎,少有成年绵羊因感染弓形虫而死亡的报道。绵羊灌胃GT-1卵囊,56%的绵羊在感染后6~11 d出现虫血症,可持续1~2 d[59]。免疫力正常的绵羊感染弓形虫卵囊(M3株)后3~8 d,出现发热反应,且发热开始的时间与卵囊数量呈正相关,50%的绵羊在感染后2~14 d可检测到虫血症(6~8 d概率最高)[60]。妊娠绵羊灌胃感染弓形虫卵囊(M4株)后,约在3~11 d有发热反应,妊娠早期感染弓形虫可引起明显的胎盘和胎儿损伤、流产[16,40]。
3.2 绵羊弓形虫病胎盘及胎儿的特征性病理学变化及诊断因弓形虫感染导致母羊流产的胎盘和胎儿的病理变化是:胎盘呈暗红色,羊水浑浊,有的胎盘自溶,胎儿常表现不同程度的出血、水肿、木乃伊胎和自溶[40]。母体胎盘、胎儿胎盘和胎儿的器官(肝脏和大脑)表现为多个散在坏死灶[22,39-40]。弓形虫感染可引起明显的胎盘子叶和绒毛坏死,坏死灶呈浅黄白色,直径约3 mm,病变范围可侵及几乎所有的子叶[40,61]。显微镜下,出现不同程度的坏死性胎盘炎,坏死区域与相邻的健康组织有较明显的界限。坏死表现为凝固性坏死,多位于肉阜和子叶绒毛,有明显的血栓和梗死,有的坏死灶发生钙化,坏死灶周围浸润巨噬细胞、嗜中性粒细胞和淋巴细胞,有的可见弓形虫速殖子[37,40,58]。
研究认为,发热、免疫反应的变化或胎盘局部血液循环障碍诱发的胎儿缺血、缺氧性损伤,可能与弓形虫急性期感染引发的流产有关[16,58]。胎儿大脑软化,大脑、肺脏和肝脏出现典型的血管周围炎,主要是巨噬细胞浸润[40,58]。胎盘、流产胎儿的大脑、肺脏和脾脏的弓形虫核酸检出率较高。此外,因母源弓形虫抗体不能穿过胎盘屏障,胎儿体液弓形虫抗体可以提示是否感染弓形虫,然而胎儿胎龄较小(<70胎龄)或感染时间短(<28 DPI),胎儿体液弓形虫抗体会呈阴性反应[22,62]。
3.3 胎儿弓形虫病的诊断方法血清学、分子生物学、病理组织学和动物生物学分析等方法广泛应用于评价弓形虫在绵羊流产中的作用,研究发现血清学方法的检出率高于病理组织学或PCR方法[18]。但也有一些例外,如感染弓形虫的小鼠血清呈阴性[63-64],从血清阴性的自然感染小鼠[65]、大鼠[25]和猪[65]中分离出活的弓形虫虫株。因此,没有弓形虫抗体也不能排除没有感染弓形虫的可能。PCR方法在检测绵羊弓形虫垂直传播中具有较高的敏感性和特异性,能克服胎儿自溶和免疫状态的影响[22,24]。病理组织学诊断方法可鉴别病理损伤是否由弓形虫感染所引起[66]。小鼠或猫的生物学分析方法能分析较大体积的组织(50或500 g),可鉴别出胎盘或流产胎儿体内是否含有弓形虫活虫株。临床诊断需联合几种方法,客观分析诊断结果。
4 展望
绵羊感染弓形虫后,一般可获得终生免疫。临床上绵羊因弓形虫垂直传播而引起流产的危害较大,探索妊娠期绵羊弓形虫病来源于外源性卵囊传播,还是内源性包囊重新激活的机制和发生的比例,可以指导临床生产如何选育后备母羊,此外,也可为评估孕妇弓形虫病风险因素提供参考依据。
