免疫治疗在宫颈癌中的作用机制及对PD-1/PD-L1 信号通路的影响研究
2020-02-23孙晓华
孙晓华
(河北省秦皇岛市妇幼保健院妇二科,秦皇岛 066000)
宫颈癌作为一种妇科常见的恶性肿瘤,通常发生于宫颈阴道、宫颈管内柱状上皮细胞和移行带鳞状上皮细胞的交界处[1-2]。在宫颈癌病情的发生、发展过程中,人乳头瘤病毒(HPV)扮演着极为重要的角色,高危型的HPV 持续感染导致宫颈粘膜细胞出现免疫障碍,是诱导宫颈癌发生的主要机制[3]。一般情况下,异型细胞能够被免疫系统准确识别和消灭,但肿瘤细胞可通过表达和分泌某些膜因子、可溶性细胞因子或修饰自身表明抗原,使肿瘤组织的微环境发生改变,形成免疫耐受区域,或使T 细胞不能发挥正常功能,导致肿瘤免疫逃逸[4]。免疫系统在肿瘤的形成阶段及肿瘤的持续状态上都发挥重要作用。
程序性死亡蛋白1(PD-1)属于免疫抑制受体,能够通过与其配体程序性死亡配体1(PD-L1)结合[5],负性调控T 细胞的活化、增殖并诱导其凋亡。PD-1/PD-L1信号通路的激活导致肿瘤特异性T 细胞不能被活化,机体抗肿瘤免疫应答受到抑制,从而使肿瘤细胞逃避机体的免疫监视和杀伤[6]。因此,通过药物阻断该通路则能够显著增强抗肿瘤免疫功能,促进有效和持久的宿主肿瘤免疫力的发生,从而抑制肿瘤的进一步发展。本研究在放疗的基础上联合采用抗PD-1/PD-L1 免疫疗法进行治疗,同时对其作用机制及对PD-1/PD-L1 信号通路进行探讨,现报道如下:
1 资料与方法
1.1 一般资料 收集2017 年12 月~2019 年1 月在我院进行治疗的97 例宫颈癌患者的临床病历资料进行回顾性分析,所有患者均经宫颈刮片细胞学和病理学明确证实为宫颈癌,FIGO 分期在Ⅰb~Ⅳ期,KPS 评分均在60 分以上,预计生存期均大于3 个月,入院治疗前均为接受任何放疗、化疗等治疗。同时排除了伴有心血管疾病、免疫系统疾病、全身感染、严重器质性病变者以及有免疫抑制剂、皮质类固醇激素等药物服用史者。本研究经我院伦理委员会审核批准,所有患者详细知情并签署知情同意书。
按照治疗方案的不同将其分为观察组(41 例)和对照组(56 例),观察组患者的年龄在31~64 岁之间,平均年龄为(48.46±5.19)岁,病程在2~7 年之间,平均病程为(4.67±1.13)年,病理分期:Ⅰb 期11 例、Ⅱ期14 例、Ⅲ期9 例、Ⅳ期7 例;对照组患者年龄29~65 岁,平均年龄为(48.46±5.19)岁,病程2~7 年,平均(4.67±1.13)年,病理分期:Ⅰb 期17 例、Ⅱ期20 例、Ⅲ期11 例、Ⅳ期8例。两组患者的一般资料比较无统计学意义(P>0.05)。
1.2 治疗方法 两组患者均采取放射疗法进行治疗,外照射量控制在180~200Gy,内照射剂量以A(位于穹隆上2cm,子宫中轴外2cm)、B(与A 点同一水平,再向外3cm)两点为参考。A 点剂量总值为25~36Gy,B 点总剂量为40~50Gy。根据宫颈癌患者的病理分期不同分别调整放射治疗的具体剂量和频率:Ⅰb 期:照射盆腔四野,4~4.5 周进行一次,40~50Gy/次;Ⅱ期:4.5~5 周一次,40~50Gy/次;Ⅲ、Ⅳ期:5~6 周一次,45~60Gy/次。
观察组患者在放疗治疗的基础上联合抗PD-1/PD-L1 免疫疗法进行治疗。重症病情者于1 个月后开展2 次疗程,其他患者于3 个月后开展2 次疗程。
1.3 观察指标
1.3.1 临床治疗效果 参照国际抗癌联盟的相关疗效标准[7]对宫颈癌患者的临床治疗效果进行对比性分析:(1)完全缓解(CR):经影像学检查现有病灶消失,无新病灶出现,治疗前存在的与疾病相关的症状消失和生化指标(如LDH)均恢复正常;(2)部分缓解(PR):肿瘤体积减少>50%,未见新病灶;(3)稳定(SD):肿瘤体积缩减≤50%;(4)进展(PD):肿瘤体积未见明显变化或扩散,有新病灶出现。总有效率=(CR+PR)/总例数 ×100%。
1.3.2 外周血PD-1、PD-L1 阳性表达及外周血T 淋巴细胞亚群表达 仪器及试剂:流式细胞仪,溶血剂(美国Beckman Coulter EPICS XL);荧光抗体包括PECy5 标记人CD3 单抗、PE 标记人PD-1 单抗,PE 标记人PD-L1 单抗、PE 标记人IgG Ⅰ同型对照抗体,抗体均由美国EB 公司提供。
于治疗前、治疗后1 周采集两组患者的EDTA-K2抗凝静脉血6mL,取3mL 送检制备CD3+ PD-1+ T 细胞、CD3+ PD-L1+ T 细胞,具体步骤如下:取两份50μL全血分别加入5μL CD3 抗体、5μL PD-1 抗体和5μL CD3 抗体、+5μL PD-L1 抗体,分别混合均匀后在常温避光环境下静置30min,之后再加入250μL 溶血剂混匀并静置12min,接着分别加入1mL 流式细胞仪鞘液进行离心处理(1500r/min,3min),离心后去其上清液,加入500μL 鞘液重悬细胞后于3h 内上机检测。
每次检测均设立空白对照和同型对照,以SSCFS 设门,分别取10000 个淋巴细胞计数,观察CD3+ PD-1+ T、CD3+ PD-L1+ T 细胞的表达情况,计算CD3+ PD-1+ T 细胞、CD3+ PD-L1+ T 占淋巴细胞比例,结果以阳性率(%)的形式表示。
另将治疗前、治疗后1 周采集的3mL 静脉血送检,采用流式细胞仪对血液样本中的血浆T 淋巴亚群水平(CD3+、CD4+、CD8+及CD4+/CD8+)进行测定。
1.4 统计学分析 本研究选择SPSS 22.0 统计学软件对各项数据资料分析、处理,计量资料以平均值±标准差的形式表示,计数资料采用百分数的形式表示,数据比较分别数据采用双侧t 检验和卡方检验进行,P<0.05 代表差异有统计学意义。
2 结果
2.1 两组患者的临床治疗效果 观察组患者的总有效率为65.85%,明显高于对照组(42.86%),差异比较有统计学意义(P<0.05),见表1。
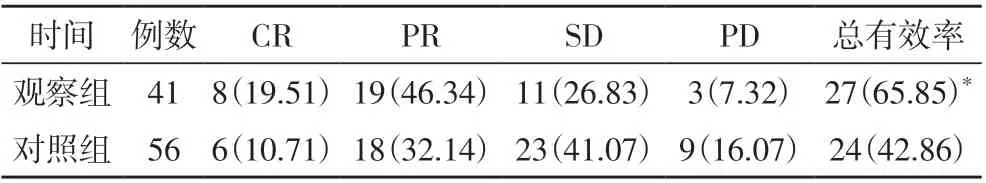
表1 两组患者的临床治疗效果比较[n(%)]
2.2 治疗前后两组患者的外周血PD-1、PD-L1 水平
治疗前,两组患者的外周血PD-1、PD-L1 水平比较无统计学意义(P>0.05),治疗后,两组患者的PD-1、PD-L1 水平均明显低于治疗前,观察组患者的PD-1、PD-L1 水平均明显低于同期对照组(P<0.05),见表2。
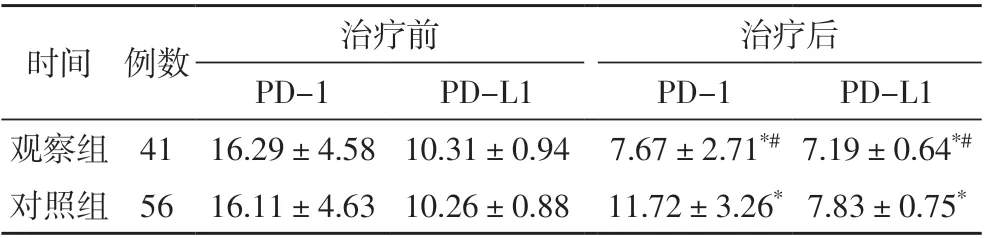
表2 治疗前后两组患者外周血的PD-1、PD-L1水平比较(%)
2.3 治疗前后两组患者的外周血T 淋巴细胞亚群变化 治疗前,两组患者的CD3+、CD4+、CD8+及CD4+/CD8+水平比较无统计学意义(P>0.05);治疗后,观察组患者的CD3+、CD4+、CD8+及CD4+/CD8+水平均明显高于治疗前,且同时明显高于高于同期对照组,差异比较统计学意义(P<0.05),见表3。
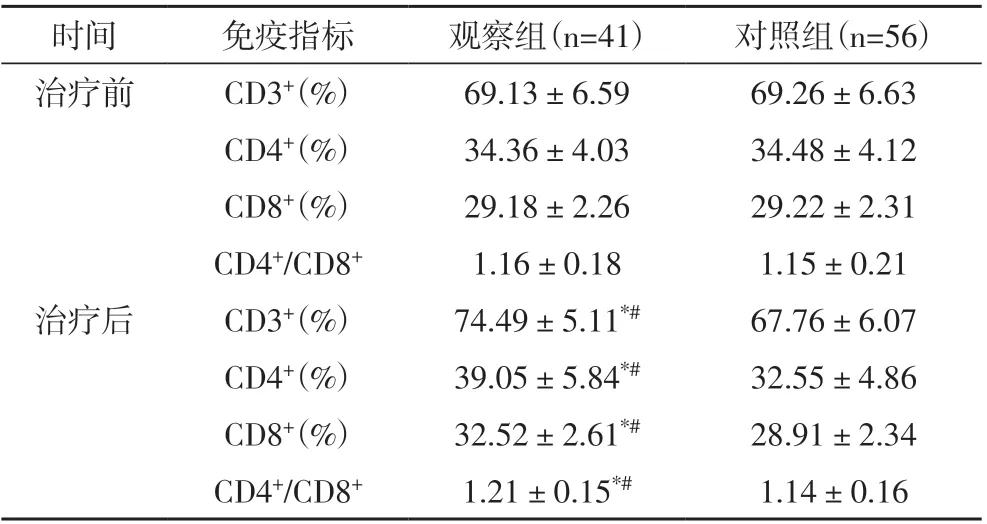
表3 治疗前后宫颈癌患者的外周血T淋巴细胞亚群水平变化
3 讨论
宫颈局部微环境中免疫功能下降以及免疫逃逸现象是促使宫颈癌发生、发展的重要因素。肿瘤抗原特异性T 细胞的诱导凋亡及无反应性是肿瘤细胞免疫逃逸现象发生的主要机制[8-9],协同刺激因子及其他相应的调节系统参与了这一过程。
PD-1 是免疫球蛋白B7-CD28 家族成员之一,在许多肿瘤组织中的淋巴细胞中,尤其是T 淋巴细胞中均可检出其表达[10]。PD-L1 是PD-1 的主要配体,通常表达于肿瘤细胞表面。一般情况下,组织细胞表面的PD-L1 和淋巴细胞表面的PD-1 结合后,PD-1/PD-L1信号通道得以激活[11-12],可抑制淋巴细胞功能,诱导活化的淋巴细胞凋亡,能够在最大程度上减少免疫反应对正常组织的损伤,避免自身免疫疾病的发生。然而,激活PD-1/PD-L1 信号通道能够使T 细胞的增殖、活化和细胞因子分泌受到抑制[13],免疫效能明显下降,负性调控机体的抗肿瘤免疫应答功能,从而介导肿瘤免疫逃逸,促使肿瘤细胞出现局部进展和远端转移。
PD-1、PD-L1 信号通路不仅能够使中路逃脱机体免疫杀伤,同时在抵抗免疫治疗过程中也发挥重要作用[14]。随着对肿瘤发生、发展及肿瘤逃逸机制的深入研究,采用单克隆抗体及相关药物阻断PD-1、PD-L1信号通路已成为一种新的肿瘤治疗手段[15],在非小细胞肺癌、鳞状细胞癌、胃癌、膀胱癌、肾细胞癌等多种类型肿瘤的治疗过程中均表现出显著疗效。而近年来较多的临床基础研究也发现,抗PD-1、抗PD-L1 抗体等免疫检查点阻滞剂在阻断PD-1/PD-L1 信号通路上效果明显[16]。在小鼠模型中,抗PD-1 抗体可阻断PD-1/PD-L1 信号通路,降低促癌细胞因子的表达,T 细胞免疫功能和机体免疫应答得到显著增强,肿瘤免疫微环境得到重塑[17]。
本研究结果显示,接受免疫治疗的患者的总有效率为65.85%,明显高于未接受免疫治疗的患者(42.86%)。另外,行免疫治疗的患者在治疗后的外周血PD-1、PD-L1 水平明显低于治疗前,且同时低于同期未接受免疫治疗者。接受免疫治疗的患者的CD3+、CD4+、CD8+及CD4+/CD8+水平均明显高于治疗前,且同时明显高于高于同期对照组。这一结果说明,宫颈癌患者体内存在PD-1/PD-L1 所介导的负性共刺激过度激活的现象。经抗PD-1/PD-L1 免疫疗法治疗后,PD-1/PD-L1 信号通道过度激活得到有效缓解,机体免疫功能得到显著提升。
可见,宫颈癌患者存在PD-1、PD-L 异常表达,PD-1/PD-L1 信号通道被激活,机体抗肿瘤免疫功能下降。抗PD-1/PD-L1 免疫疗法能够有效阻断PD-1/PD-L1 信号通路,显著增强机体的抗肿瘤免疫功能,使肿瘤细胞无法逃避机体的免疫监视和杀伤。抗PD-1/PD-L1 免疫疗法是临床治疗宫颈癌的新策略,介于本研究纳入样本较少,免疫治疗在治疗宫颈癌上的临床疗效仍需大量的研究来进一步证实。
