ACTH、CORT、IL-18、TNF-α 预测抑郁症的临床应用价值分析
2020-02-23田海华陈寿林徐国安李广学万小晗高树贵
田海华 陈寿林 徐国安 李广学 万小晗 高树贵
1.宁波市康宁医院检验科,浙江宁波 315201;2.宁波市康宁医院情感障碍科,浙江宁波 315201
抑郁症是一种以抑郁心境自我体验为中心的临床症状群类心境障碍或情感性障碍类疾病,常表现为情绪低落、思维行为异常、社会活动能力差,病情严重者可伴有罪恶感甚至自杀倾向,对患者正常生活及社会卫生环境产生严重后果[1]。目前临床上常根据患者心理与生理变化诊断抑郁症,缺乏实验室诊断数据。相关研究表明下丘脑-垂体-肾上腺轴作用与抑郁症的发生及进展有紧密联系[2-3],同时免疫系统激活引起的免疫内环境紊乱可通过身心交互作用机制促进抑郁症的发生[4-7]。本研究通过联合促肾上腺皮质激素(ACTH)、皮质醇(CORT)等激素及白细胞介素-18(IL-18)、肿瘤坏死因子-α(TNF-α)等炎性细胞因子,采用Spearman 相关性分析其与汉密尔顿抑郁量表(HAMD)各因子之间关系,探究血清ACTH、CORT、IL-18、TNF-α 水平对预测抑郁症的临床应用价值,现报道如下:
1 资料与方法
1.1 一般资料
选取2017 年6 月~2019 年6 月宁波市康宁医院(以下简称“我院”)首次确诊为抑郁症的患者60 例,纳入标准:①符合国际通用诊断标准ICD-10 对抑郁症的诊断标准;②年龄≥18 岁;③HAMD 量表评分均≥20 分。排除标准:①合并其他重大躯体疾病;②既往有其他精神障碍类疾病病史;③近期有感染病史且服用免疫相关药物;④有酒精或其他药物滥用成瘾病史。选取同期来我院进行健康检查正常人60 名。入组人员均自愿配合本研究并签署知情同意书。抑郁组仅HAMD 评分明显高于对照组(P <0.05),两组性别、年龄、受教育程度比较差异无统计学意义(P >0.05),具有可比性。见表1。

表1 两组一般资料比较
1.2 检查方法
两组人员均于上午6:00~8:00 取肘静脉血5 mL,3000 r/min 离心5 min,取上清液分别注入4 个标准冷冻试管中并置于-80℃冰箱冷藏,采用电化学发光法检测血清ATCH 及CORT 皮质醇水平,电化学发光免疫分析仪及配套试剂由西门子公司提供,另采用酶联免疫吸附法(ELISA)检测血清IL-18、TNF-α 水平,试剂盒购自江苏酶免实业有限公司。采用HAMD 量表评估入组人员病情严重程度,评定量表使用统一指导语,由两名精神科主治医师评定,量表评估一致性Kappa=0.813,一致性较好。
1.3 统计学方法
采用SPSS 18.0 统计学软件进行数据分析,计量资料用均数±标准差()表示,两组间比较采用t 检验;计数资料用率表示,组间比较采用χ2检验;采用Spearman 相关性分析血清各指标与HAMD 量表各因子之间的关系;以P <0.05 为差异有统计学意义。
2 结果
2.1 血清ACTH、CORT、IL-18、TNF-α 水平
抑郁组血清ACTH、CORT、IL-18、TNF-α 水平均明显高于对照组,差异有统计学意义(P <0.05)。见表2。
表2 两组血清ACTH、CORT、IL-18、TNF-α 水平比较()

表2 两组血清ACTH、CORT、IL-18、TNF-α 水平比较()
注:ACTH:促肾上腺皮质激素;CORT:皮质醇;IL-18:白细胞介素-18;TNF-α:肿瘤坏死因子-α
2.2 抑郁组患者HAMD 各因子与血清ACTH、CORT、IL-18、TNF-α 之间的相关性分析
血清ACTH 水平与HAMD 量表中抑郁情绪、有罪感、早睡末端失眠、精神性焦虑、躯体性焦虑、日夜变化、能力减退等因子及HAMD 总分呈正相关(P <0.05);血清CORT 水平与HAMD 量表中抑郁情绪、早睡末端失眠、工作兴趣、躯体性焦虑、体重减轻、日夜变化、偏执症状等因子及HAMD 总分呈正相关(P <0.05);血清IL-18 水平与HAMD 量表中抑郁情绪、入睡困难初段失眠、躯体性焦虑、全身症状、偏执症状、强迫症状、能力减退等因子及HAMD 总分呈正相关(P <0.05);血清TNF-α 水平与HAMD 量表中抑郁情绪、早睡末端失眠、工作兴趣、精神性焦虑、躯体性焦虑、全身症状、能力减退等因子及HAMD 总分呈正相关(P <0.05)。见表3。
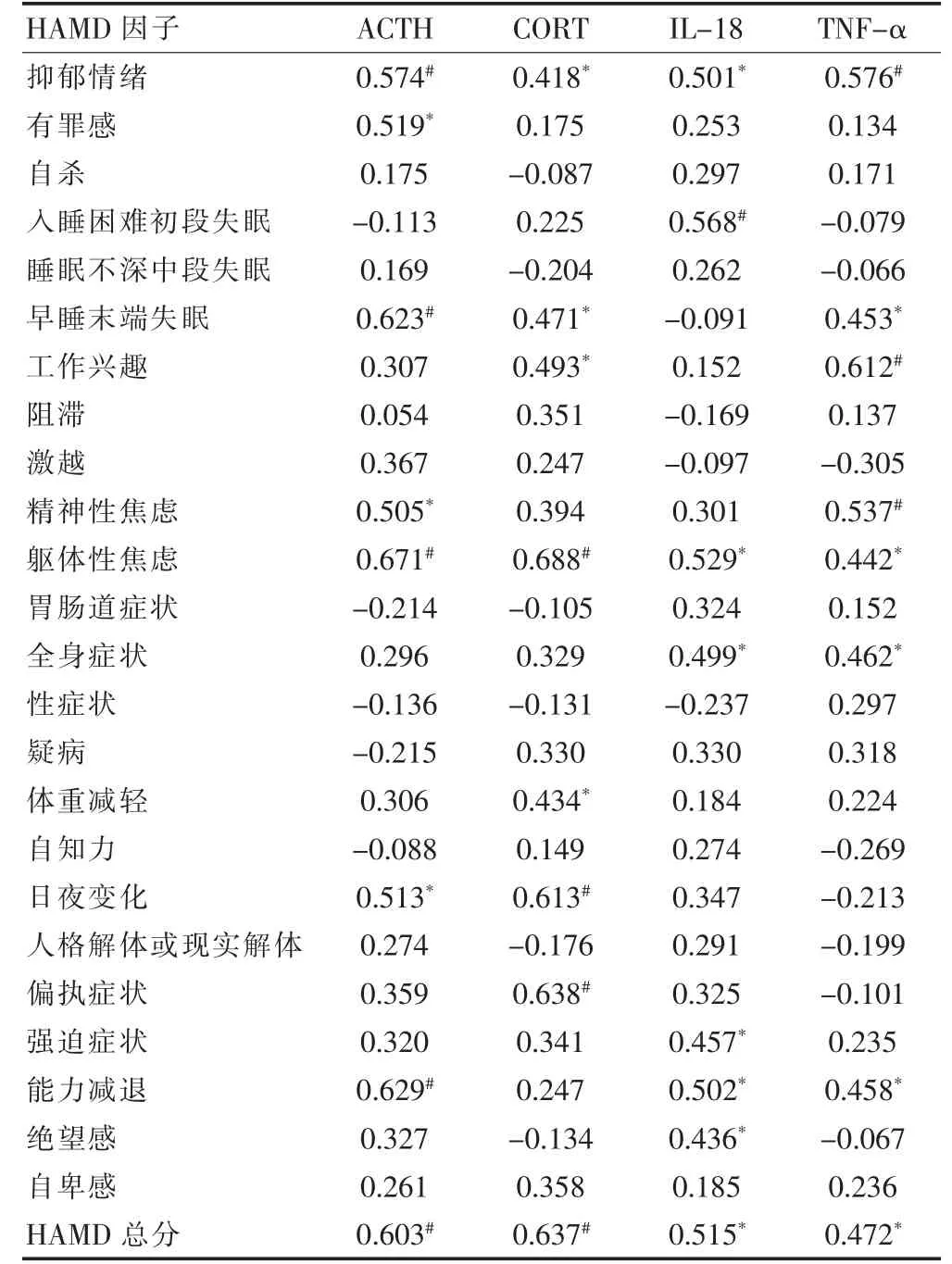
表3 抑郁组患者HAMD 各因子与血清ACTH、CORT、IL-18、TNF-α 之间的相关性分析(r 值)
3 讨论
据统计,我国抑郁症发病率达6%,居疾病负担第二位,且发病率呈逐年增长趋势,发病人群呈年轻化,同时自杀人群患有抑郁障碍类情绪者接近70%[8]。抑郁症不仅严重影响个人生理与心理健康,同时对家庭与社会和谐稳定发展造成严重影响,因此早期诊断并予以积极干预抑郁症疾病发展是目前亟待解决的医疗问题[9]。
抑郁症发病机制十分复杂,下丘脑-垂体-肾上腺素轴功能失调学说是目前公认引起抑郁症的重要机制[10]。当机体受到外界环境刺激后,大脑皮质传递信号至下丘脑引起促肾上腺皮质激素释放激素(CRH)分泌,CRH 水平增多促进垂体分泌ACTH 并作用于肾上腺诱导CORT 合成,血浆ACTH 与CORT 水平增高可引起机体抵抗或逃避应激反应以面对外界环境改变,但以上指标长期处于异常高水平状态可影响正常神经元电活动及兴奋性水平,造成机体行为及心理变化[11-12]。CORT 的分泌因负反馈调节作用受血浆ACTH 影响,而垂体分泌ACTH 同时受下丘脑CRH 影响,由此组成下丘脑-垂体-肾上腺素轴,朱海兵等[13]研究发现抑郁症患者多伴有肾上腺皮质功能亢进表现,长期慢性应激反应造成血浆ACTH、CORT 水平增高,导致ACTH、CORT 对外源性CRH 反应减退,影响患者自发性夜间分泌抑制节律。同时血浆ACTH、CORT 水平长期异常增高可破坏大脑颞叶尤其是海马CA3 区神经元结构和功能,造成锥形细胞层神经细胞萎缩且再生功能障碍,引起颞叶层组织萎缩,海马结构与功能紊乱可损害机体记忆功能,引起患者注意缺损及情感行为障碍,表现出记忆力减退、情绪沮丧、生活动力不足等抑郁症状,而应激反应使海马对CRH 的抑制作用减退,进一步造成ACTH、CORT 分泌功能破坏,加重机体抑郁状态[14]。
近年来,一些国内外学者提出激活免疫系统相关细胞因子的分泌可能是引起抑郁障碍的原因之一[15],认为IL-18、TNF-α 等炎性因子可活化下丘脑-垂体-肾上腺轴引起抑郁情绪[16-19]。相关研究设计小鼠模型并予以炎性因子发现小鼠出现厌食、社会活动减少等行为,采用敲除炎性因子基因来阻断炎症因子信号转导可产生抗抑郁效果[20]。免疫系统与机体神经系统、内分泌系统之间可形成“心理神经免疫内分泌”系统,介质作为桥梁可联系三大系统并引导神经内分泌系统激活控制免疫系统,当机体处于较大情感压力时,IL-18、TNF-α 等炎性细胞因子水平增高,外周免疫系统功能变化导致机体对环境变化出现易感性,同时诱导抑郁情绪爆发,造成抑郁症患者发病或复发[21-22]。
本研究通过比较抑郁症患者与同期健康人血清ACTH、CORT、IL-18、TNF-α 水平,结果显示,抑郁症患者血清ACTH、CORT、IL-18、TNF-α 水平均明显高于健康人。同时采用HAMD 量表进行相关性分析发现,HAMD 评分越高者,血清ACTH、CORT、IL-18、TNF-α水平越高,且在抑郁情绪、早睡末端失眠、躯体性焦虑、能力减退等因子方面关系较为紧密,因此在临床上常规采用HAMD 量表进行抑郁症病情评估诊断的同时,联合实验室血清指标检测,可进一步提高抑郁症病情预测及诊断。
综上所述,血清ACTH、CORT、IL-18、TNF-α 水平与抑郁症的发生发展紧密相关,检测血清ACTH、CORT、IL-18、TNF-α 水平对预测抑郁症的发生具有一定临床应用价值。
