系统性红斑狼疮患者血清血小板反应蛋白1 水平与病情严重程度的关系
2020-02-23何东初
伍 伟 何东初
中国人民解放军中部战区总医院中西医结合科,湖北武汉 430070
系统性红斑狼疮(SLE)是一种可累及多脏器的自身免疫性炎性结缔组织病,好发于青年女性,男女患者比例接近1∶10[1]。该病临床主要表现为蝶形红斑、发热、关节痛、体重下降等症状[2]。随着人们对SLE 的研究深入,发现其不仅可导致皮肤、黏膜病变,还可累及肌肉、骨骼、肾脏、心脏等,最终引起多系统损害,危及患者性命[3]。因此,早期检测并明确患者病情严重程度,并以此为指导制订合理的治疗方案,对改善患者预后有重要意义。SLE 的发病机制目前尚不十分明确,以往认为其与遗传、环境、雌激素以及免疫应答反应异常等因素相关,其中免疫应答反应异常在病情进展中占据主要地位[4]。血小板反应蛋白1(TSP-1)是血小板的重要组成部分,主要参与细胞凋亡、新生血管形成等病理过程[5]。此外,TSP-1 具有免疫负调节的作用。近年来研究认为[6],在SLE 的疾病进展过程中TSP-1 存在明显改变。现临床有关SLE 患者中TSP-1的水平变化与病情严重程度关系的相关报道尚不多见,本研究就此展开分析,以期为临床治疗SLE 提供数据支撑。
1 资料与方法
1.1 一般资料
选取中国人民解放军中部战区总医院(以下简称“我院”)2010 年1 月~2018 年12 月收治的SLE 患者110 例为观察组,本研究已通过我院医学伦理委员会批准进行。纳入标准:①均符合《系统性红斑狼疮诊治指南》相关诊断标准[7];②抗dsDNA 抗体阳性,临床表现为发热、蝶形红斑关节痛、体重下降等症状;③对本研究知情,且签署同意书;④临床资料完整,患者依从性高。排除标准:①合并精神疾病无法配合研究者;②合并恶性肿瘤、自身免疫性疾病、全身感染者;③入组前2 周内使用免疫抑制剂者;④妊娠或哺乳期妇女。观察组根据SLE 疾病活动指数(SLEDAI-2000)评分[8]将患者分为缓解期(49 例,SLEDAI-2000 评分<5 分)和活动期(61 例,SLEDAI-2000 评分≥5 分),其中缓解期男4 例,女45 例;年龄15~77 岁,平均(41.38±4.62)岁;病程2~19 个月,平均(11.29±2.37)个月;体重指数21.6~25.9 kg/m2,平均(23.17±0.82)kg/m2。活动期男3 例,女58 例;年龄15~75 岁,平均(41.06±5.21)岁;病程3~20 个月,平均(11.38±1.95)个月;体重指数21.9~26.4 kg/m2,平均(23.29±0.76)kg/m2。另选取同期于我院行健康体检的志愿者50 名作为对照组,对照组男6 名,女44 名;年龄16~76 岁,平均(41.09±5.62)岁;体重指数21.1~26.4 kg/m2,平均(23.25±0.83)kg/m2。三组性别、年龄、体重指数比较差异无统计学意义(P >0.05),具有可比性。
1.2 检测方法
抽取患者清晨空腹静脉血3 mL,抽血时间:观察组于入院次日、对照组于体检当天。将静脉血置于未涂有肝素钠的采血管中,室温下静置20 min,经4200 r/min 离心15 min,离心半径8 cm,分离血清,置于-30℃冰箱中保存待检。血清TSP-1 水平采用酶联免疫吸附测定法检测,严格遵守南京建成生物科技有限公司生产的试剂盒说明书进行操作(生产批号:20100106)。采用美国库尔特公司生产的STKS 全自动五分类血液分析仪检测血红蛋白、血小板;采用免疫透射比浊法检测补体C3 和补体C4 水平;采用意大利SEAC 公司生产的Alisei 全自动分析仪检测尿素氮、血肌酐、24 h 尿蛋白。记录两组患者SLE 并发症发生情况,包括口腔溃疡、皮疹、脱发、关节炎、狼疮性肾炎、溶血性贫血。
1.3 统计学方法
所有数据采用SPSS 19.0 进行统计分析,计量资料用均数±标准差()表示,采用t 检验,计数资料采用χ2检验,采用Pearson 相关性分析血清TSP-1 水平与其他临床指标的相关性。以P <0.05 为差异有统计学意义。
2 结果
2.1 对照组和观察组血清TSP-1 水平及其他临床指标比较
对照组和观察组的肌酐、尿素氮、24 h 尿蛋白比较差异无统计学意义(P >0.05);观察组血清TSP-1水平高于对照组,血红蛋白、血小板、补体C3、补体C4 低于对照组(P <0.05)。见表1。
2.2 缓解期和活动期血清TSP-1 水平及其他临床指标比较
活动期患者的血清TSP-1 水平高于缓解期,血红蛋白、血小板、补体C3、补体C4 低于缓解期(P <0.05);缓解期和活动期患者的肌酐、尿素氮、24 h 尿蛋白比较差异无统计学意义(P >0.05)。见表2。
表1 对照组和观察组血清TSP-1 水平及其他临床指标比较()

表1 对照组和观察组血清TSP-1 水平及其他临床指标比较()
注:TSP-1:血小板反应蛋白1
表2 缓解期和活动期血清TSP-1 水平及其他临床指标比较()
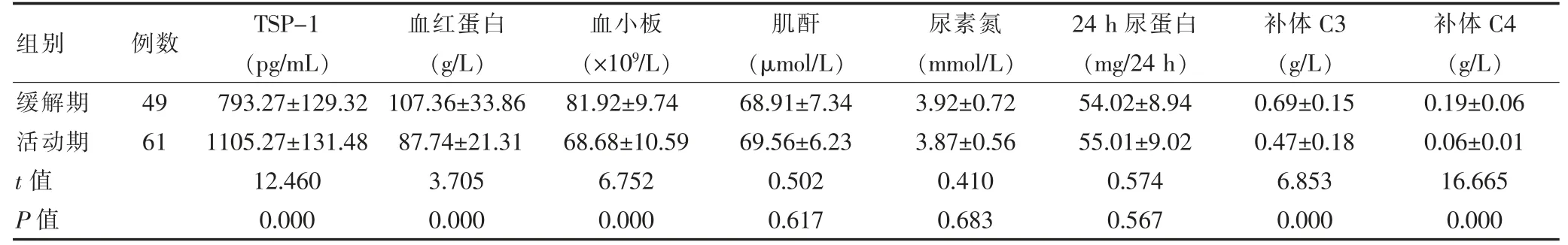
表2 缓解期和活动期血清TSP-1 水平及其他临床指标比较()
注:TSP-1:血小板反应蛋白1
2.3 血清TSP-1 水平与SLE 并发症的关系
合并口腔溃疡、皮疹、脱发、关节炎、狼疮性肾炎、溶血性贫血的SLE 患者血清TSP-1 水平均高于未合并者(P <0.05)。见表3。
表3 血清TSP-1 水平与SLE 并发症的关系(pg/mL,)
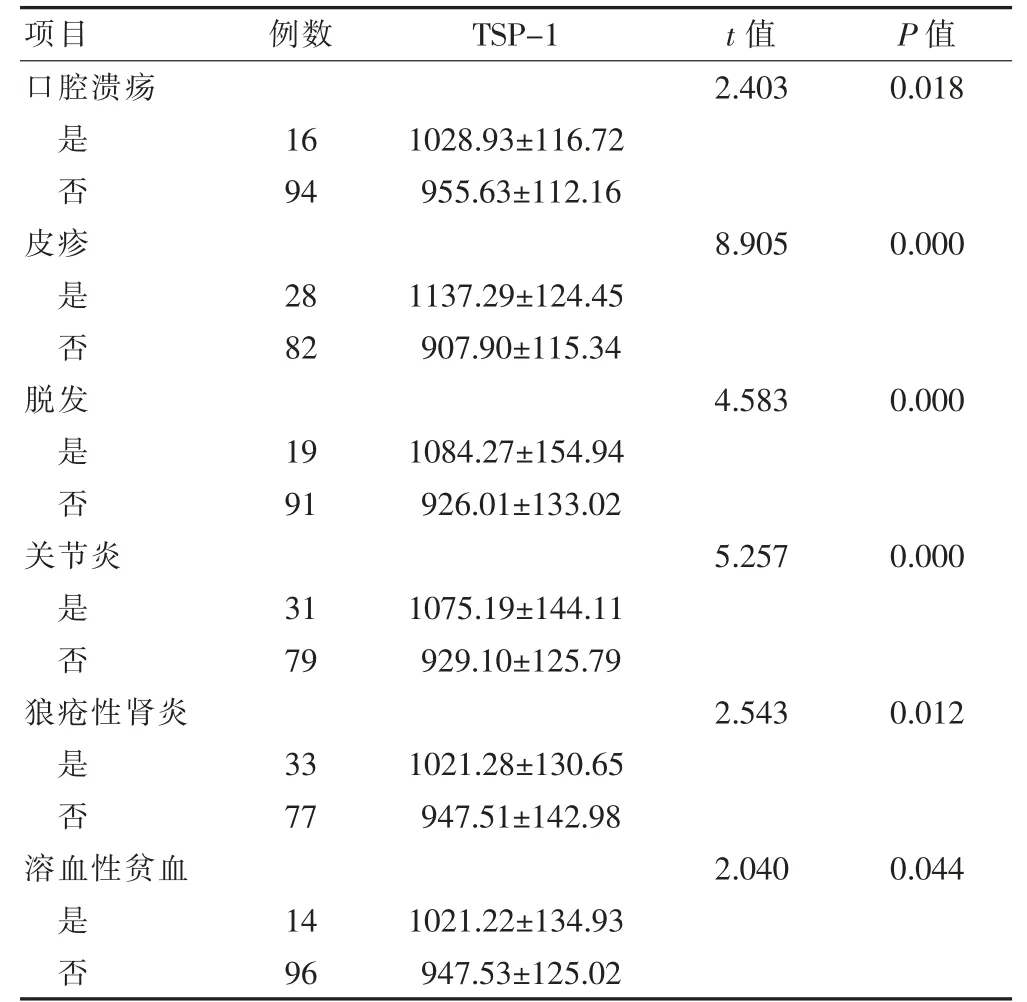
表3 血清TSP-1 水平与SLE 并发症的关系(pg/mL,)
注:TSP-1:血小板反应蛋白1;SLE:系统性红斑狼疮
2.4 观察组患者血清TSP-1 水平与其他临床指标的相关性
Pearson 相关性分析结果显示,TSP-1 与血红蛋白、血小板、补体C3、补体C4 呈负相关(P <0.05),而与肌酐、尿素氮、24 h 尿蛋白无相关性(P >0.05)。见表4。
3 讨论
SLE 是一种致病机制仍不十分明确的疾病,主要表现为B 细胞功能亢进和T 细胞调节免疫异常,患者体液中出现多种攻击多个器官、系统的自身抗体和免疫复合物,是一种慢性不可根治的自身免疫性疾病。据统计[9],在全球范围内,每10 万人中就有20~150 人患有此病。由于SLE 治疗困难,且无法根治,需要长期的治疗以及随访,且治疗期间易合并感染,感染后又可诱发或加重狼疮活动,并成为导致患者死亡的主要原因之一。目前临床针对SLE 的诊断多需结合患者临床症状、体质检查和实验室检查进行综合诊断。SLE 的多项指标检测不但对其诊断具有重要的参考价值,而且可用于监测SLE 的活动性、复发以及药物治疗效果等[10]。传统观点认为补体C3、C4 降低是SLE 活动的主要标志,有助于尽早发现病情活动[11]。但有部分研究[12-13]显示,当SLE 临床治疗中病情已得到缓解时,其补体水平仍低于正常水平。同时又有研究[14-16]显示,SLE 患者存在血液系统、肾功能方面的异常,且血液系统异常、肾功能损害又是导致患者死亡的主要原因之一。故临床通常也将血红蛋白、血小板、血肌酐、尿素氮、24 h 尿蛋白列为常规检测指标。本研究中观察组补体C3、补体C4、血液系统指标低于对照组,活动期则低于缓解期(P <0.05);但观察组与对照组以及活动期与缓解期的肾功能指标比较差异无统计学意义(P >0.05),可见上述指标并不一定能如实反映SLE 患者病情的严重程度。
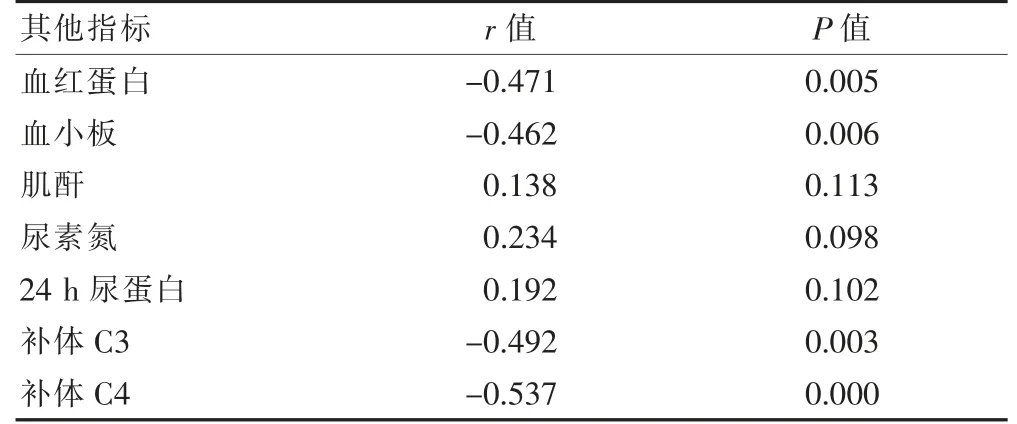
表4 观察组患者血清TSP-1 水平与其他临床指标的相关性
TSP-1 最初从血小板细胞膜中分离提取,又被称为凝血酶敏感蛋白1,是一种由凝血酶刺激血小板α颗粒而释放出的蛋白质[17]。以往研究证实[18]其生物学功能极其广泛,包括促进细胞凋亡、调节新生血管形成以及激活转化生长因子等,同时还参与肿瘤细胞的生长及转移、组织损伤修复、炎性反应等。林静等[19]研究证实,TSP-1 可通过作用于抗原提呈细胞和T 细胞,进而发挥免疫调节作用。本研究结果显示,观察组血清TSP-1 水平高于对照组,活动期患者血清TSP-1 水平高于缓解期,且合并并发症的SLE 患者血清TSP-1 水平高于未合并并发症者(P <0.05),可见TSP-1 参与SLE 病情的发生、发展过程,可反映SLE患者的并发症。血清TSP-1 通过调节机体的免疫反应及自身抗体等因素,参与SLE 的发生、发展。进一步的Pearson 相关性分析结果显示,TSP-1 与血红蛋白、血小板、补体C3、补体C4 呈负相关,而与肌酐、尿素氮、24 h 尿蛋白无相关性。提示TSP-1 的升高程度与患者病情严重程度密切相关,可能通过抑制血红蛋白、血小板、补体C3、补体C4,参与病情进展。这可能与TSP-1 多种多样的生物学作用密切相关。SLE 患者补体C3、补体C4 水平降低与自身免疫炎症有关,而TSP-1 对这种自身免疫炎症可发挥负性调节作用[20]。TSP-1 还可通过抑制Th1 细胞和Th17 细胞分泌细胞因子,进而降低血红蛋白、血小板水平[21]。本研究中,TSP-1 与肌酐、尿素氮、24 h 尿蛋白无相关性,其具体原因仍需进一步深入研究。
综上所述,SLE 患者中存在血清TSP-1 水平的异常升高,且其升高程度与患者病情严重程度密切相关,同时其异常释放可能对SLE 并发症产生一定影响。
