一贯煎对H2O2 诱导L02细胞DNA 氧化损伤的修复作用机制研究
2020-02-23王阿美刘文兰
王阿美 张 睿 刘文兰
首都医科大学中医药学院,北京 100069
乙型肝炎病毒(HBV)感染可导致多种肝病,包括慢性肝炎、肝硬化和肝细胞癌(HCC)[1]。研究显示[2-4],各种肝病的发生、发展与氧化损伤密切相关,DNA 氧化损伤可能是肝病的共同发病机制。DNA 发生氧化损伤后,为了维持基因组的完整性和稳定性,机体会启动一系列DNA 损伤修复反应,通过阻滞细胞周期对DNA 进行修复[5]。而一贯煎具有抗氧化能力,可保护细胞和组织免受活性氧的危害[6-8]。前期研究结果提示,一贯煎治疗慢性肝损伤的药理机制与抑制活性氧(ROS)从而减轻DNA 损伤有关,肝细胞氧化损伤产生大量ROS,与DNA 损伤也有密切关系,但具体机制尚不清楚。因此,探讨一贯煎修复DNA 氧化损伤是否能够提高人正常肝细胞抵御氧化损伤的能力,具有重要的科研意义和临床价值。
1 材料与方法
1.1 细胞与动物
人正常肝细胞(L02),第15 代,购自北京普京康利科技有限公司,品牌为keygen 凯基生物,批号为:KG063。雄性Sprague-Dawlay 大鼠40 只。体重180~220 g,购自北京维通利华实验动物技术有限公司,动物许可证号SCXK(京)2016-0011,合格证号:114007 00375946。饲养于首都医科大学实验动物科学部20~25℃室温、湿度50% SPF 级动物室。普食喂养,自由饮食。本研究经首都医科大学动物实验及实验动物福利委员会审批同意。伦理编号:AEEI-2018-036。
1.2 药物及试剂
原方出自清代魏之绣著的《柳州医话》,功用滋阴疏肝,主治肝肾阴虚,肝郁气滞证[9-10]。于北京同仁堂药店选购标准中药材,北沙参9 g、麦冬9 g、当归9 g、生地黄20 g、枸杞子12 g、川楝子4.5 g,将饮片置煎煮容器内,加药材量约6 倍的冷水浸泡1 h,煮沸30 min,过滤并收集滤液。药渣加3 倍量水继续煎煮,煮沸20 min,过滤并收集滤液,将2 次滤液合并为一贯煎浓缩液,待冷却后装入灭菌药瓶中,于4℃冰箱中保存备用。
DMEM 培养基(Corning,10-013-crv),PBS(Corning,21-040-cvr),胎牛血清(Gibco,1932597),H2O2(北京中杉金桥生物技术有限公司,ZLI-9311),Vc(Sigma,SLBN3833V),CCK-8 试剂盒(DOJINDO,LB622),细胞周期试剂盒(江苏凯基生物技术股份有限公司,20180712),活性氧检测试剂盒(北京普利莱基因技术有限公司,C1300),酶联免疫吸附试验(ELISA)试剂盒(武汉云克隆科技股份有限公司,L190603569),培养细胞/细菌总RNA 提取试剂盒[天根生化科技(北京)有限公司,RT411],PrimeScript 1 st Strand cDNA Synthesis Kit [天根生化科技(北京)有限公司,KR116],PrimeScript RT MasterMix Perfect Real Time Kit [天根生化科技(北京)有限公司,FP205]。
1.3 仪器
正置荧光显微镜(Lecia,Qwin)、高速离心机(Sigma,4-16KS 离心机,离心半径10 cm)、低温离心机(Heraeus,Biofuge15R,离心半径10 cm)、酶标仪(Molecular Devices,SpectraMax iD3)、流式细胞仪(BD Biosciences,BD LSRFortessa 定制型流式仪)、实时荧光定量聚合酶链反应(PCR)仪(Applied Biosystems,Veriti96)等。
1.4 方法
1.4.1 含药血清的制备 大鼠随机分为正常对照组、模型对照组、一贯煎小剂量组、一贯煎中剂量组、一贯煎大剂量组及阳性对照组,每组5 只。正常对照组和模型对照组、阳性对照组,每只大鼠每次灌服蒸馏水1 mL/100 g,一贯煎小剂量组、一贯煎中剂量组、一贯煎大剂量组分别给予成人生药用量的2.5、5、10 倍熬制浓煎液1 mL/100 g,以上各组分别灌服2 次/d,间隔6 h,连续3 d。第3 天完成2 次给药后,等待2 h,再次给药1 h 后,对大鼠进行1%戊巴比妥钠(0.6 mL/100 g)腹腔注射。麻醉后腹主动脉取血,室温静置2 h,以3000 r/min 速度,4℃下,离心20 min。吸取上清液,0.22 μm 微孔滤膜过滤除菌,56℃水浴灭活30 min,分装后-80℃保存备用。
1.4.2 细胞培养与分组 将复苏后的L02 细胞接种于含10%胎牛血清的DMEM 培养基中,于37℃、5% CO2的培养箱内培养。待细胞生长至指数期,按照1∶3 比例传代,观察细胞生长状况,1~2 d 更换培养基。待细胞生长至状态良好,将细胞随机分为6 组,分别为正常对照组、模型对照组、一贯煎小剂量组、一贯煎中剂量组、一贯煎大剂量组、阳性对照组,用不含血清的培养基饥饿培养24 h,使细胞周期同步。正常对照组及模型对照组加入含有20%正常大鼠血清的培养基,一贯煎小剂量组、一贯煎中剂量组、一贯煎大剂量组、阳性对照组分别加入20%一贯煎小剂量含药血清,20%一贯煎中剂量含药血清、20%一贯煎大剂量含药血清以及含有20%正常大鼠血清且Vc 终浓度为0.1 mmol/L的培养基,孵育24 h,PBS 洗2 遍,除正常对照组外,其余各组加入H2O2(0.6 mmol/L)。
1.4.3 H2O2诱导L02 细胞氧化损伤模型的建立 取对数期生长的L02 细胞,以5×103/孔密度接种于96 孔板内,置于37℃、5% CO2培养箱培养24 h 后,随机分为5 组,分别为正常对照组及4 个模型对照组,另设空白孔,每组3 个复孔。空白孔及正常对照组每孔加入100 μL 无血清培养基,模型对照组分别加入H2O2浓度梯度为0.2、0.4、0.6、0.8 mmol/L 的无血清培养液100 μL,分别孵育1、3 h 后,采用CCK-8 法,于1、3 h 时检测OD 值,计算细胞存活率。细胞存活率=(OD模型对照组-OD空白孔)/(OD正常对照组-OD空白孔)。实验重复3 次。
1.4.4 一贯煎对L02 细胞存活率的影响 取对数期生长的L02 细胞,以5×103/孔密度接种于96 孔板内,置于37℃、5% CO2培养箱培养24 h 后,随机分为6 组,分别为正常对照组、模型对照组、一贯煎小剂量组、一贯煎中剂量组、一贯煎大剂量组、阳性对照组。接种到96 孔板中,设置3 个复孔,每孔加入100 μL 细胞悬液,待细胞贴壁融合至50%~60%,更换无血清培养基饥饿培养24 h。对各组细胞分别处理后,采用CCK-8法于酶标仪450 nm 处检测OD 值,计算细胞存活率,实验重复3 次,细胞存活率越高氧化损伤修复水平越高。
1.4.5 ELISA 检测一贯煎对L02 细胞8-羟基脱氧鸟苷含量的影响 取对数期生长的L02 细胞,以1×105/孔密度接种于12 孔板内,置于37℃、5% CO2培养箱培养24 h 后,随机分组并对各组细胞分别进行处理后,按照ELISA 试剂盒说明书操作,每组分别加入50 μL细胞培养液上清后,立即加入50 μL 检测溶液A,37℃孵育1 h;甩干,用PBS 洗板3 次;之后加100 μL检测溶液B,37℃孵育30 min;用PBS 洗板5 次;加90 μL TMB 底物,37℃孵育15 min;加50 μL 终止液,立即于酶标仪下450 nm 读数。实验重复3 次。
1.4.6 流式细胞仪检测一贯煎对L02 细胞内ROS 含量的影响 取对数期生长的L02 细胞,以1×105/孔密度接种于12 孔板内,置于37℃、5%CO2培养箱培养24 h后,随机分组并对各组细胞分别处理后,加入浓度为10 uM 的DCFH-DA 探针,37℃避光孵育30 min,PBS冲洗2 次,后消化并收集,1000 r/min 离心5 min,去上清。加入500 μL PBS 立即上机进行ROS 检测并统计平均荧光强度。实验重复3 次。
1.4.7 流式细胞仪检测一贯煎对L02 细胞周期影响取指数期生长良好的L02 细胞,以2×105/孔密度接种于6 孔板内,置于37℃、5% CO2培养箱培养24 h 后,随机分组并对各组细胞分别处理后,消化并收集。1200 r/min 离心6 min,去上清,用预冷的80 %乙醇将细胞悬浮处理,4℃固定过夜。PBS 冲洗2 次,离心去上清,加入500 μL 样品染色液(450 μL PI+50 μL RNA 酶),37℃避光孵育30 min。进行细胞周期检测并计算各期细胞百分率。实验重复3 次。
1.4.8 实时荧光定量PCR 检测一贯煎对L02 细胞中ATM、CHK2、Cdc25A、Cdc25C mRNA 表达的影响 取对数期生长的L02 细胞,以2×105/孔密度接种于6 孔板内,置于37℃、5% CO2培养箱培养24 h 后,随机分组并对各组细胞分别处理后,后消化并收集,1000 r/min 离心5 min,去上清。先提取L02 细胞的总RNA,逆转录得到cDNA 模板后,进行Real Time PCR。实验重复3 次。引物序列分别为β-actin 上游:3′-TCCTTCCGCAGCTATTTATGAT-5′,β-actin 下游:3′-CACAGTATAGGATGGTCTGGAC-5′;ATM 上 游:3′-ATCTGCTGCCGTCAACTAGAA-5′,ATM 下游:3′-GATCTCGAATCAGGCGCTTAAA-5′;CHK2 上 游:3′-TTATCTGCCTTAGTGGGTATCCA-5′,CHK2 下游:3′-CTGTCGTAAAACGTGCCTTTG-5′;Cdc25A 上 游:3′-TTCCTCTTTTTACACCCCAGTCA-5′,Cdc25A 下游:3′-TCGGTTGTCAAGGTTTGTAGTTC-5′;Cdc25C 上游:3′-ATGACAATGGAAACTTGGTGGAC-5′,Cdc25C 下游:3′-GGAGCGATATAGGCCACTTCTG-5′。
1.5 统计学方法
采用SPSS 22.0 统计学软件对所得数据进行统计分析,计量资料以均数±标准差()表示,组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验,方差不齐采用Dunnett-T3 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 不同浓度H2O2对L02 细胞细胞活力的影响
0.2、0.4、0.6、0.8 mmol/L H2O2对L02 细胞生长增殖均有抑制作用,H2O2浓度越高,作用时间越长,OD 值越低,细胞存活率越低。其中,当H2O2浓度为0.6 mmol/L,作用时间为1 h 时,存活率约为61%。相同浓度下,3 h 存活率低于1 h。H2O2易分解,将H2O2浓度为0.6 mmol/L,培养细胞时间为1 h 作为建立稳定有效的人正常肝细胞氧化应激损伤模型的的处理方式。见表1。
表1 不同浓度H2O2对L02 细胞细胞活力影响(,n=9)

表1 不同浓度H2O2对L02 细胞细胞活力影响(,n=9)
注:与同时间点正常对照组比较,*P <0.01
2.2 一贯煎对L02 细胞存活率的影响
与正常对照组比较,模型对照组OD 值及细胞存活率显著降低(P <0.05)。与模型对照组比较,一贯煎小剂量组、一贯煎中剂量组、一贯煎大剂量组及阳性对照组OD 值及细胞存活率均显著升高(P <0.05),其中一贯煎中剂量组OD 值及细胞存活率升高最明显,细胞存活率约为90.19%。见表2。
表2 一贯煎对L02 细胞存活率的影响(,n=9)

表2 一贯煎对L02 细胞存活率的影响(,n=9)
注:与正常对照组比较,aP <0.05;与模型对照组比较,bP <0.05
2.3 一贯煎对L02 细胞8-OHDG 含量的影响
与正常对照组比较,模型对照组8-OHDG 含量显著升高(P <0.05)。与模型对照组比较,一贯煎小剂量组、一贯煎中剂量组、一贯煎大剂量组及阳性对照组8-OHDG 含量均显著降低(P <0.05),其中一贯煎中剂量组8-OHDG 含量降低最明显。见图1。
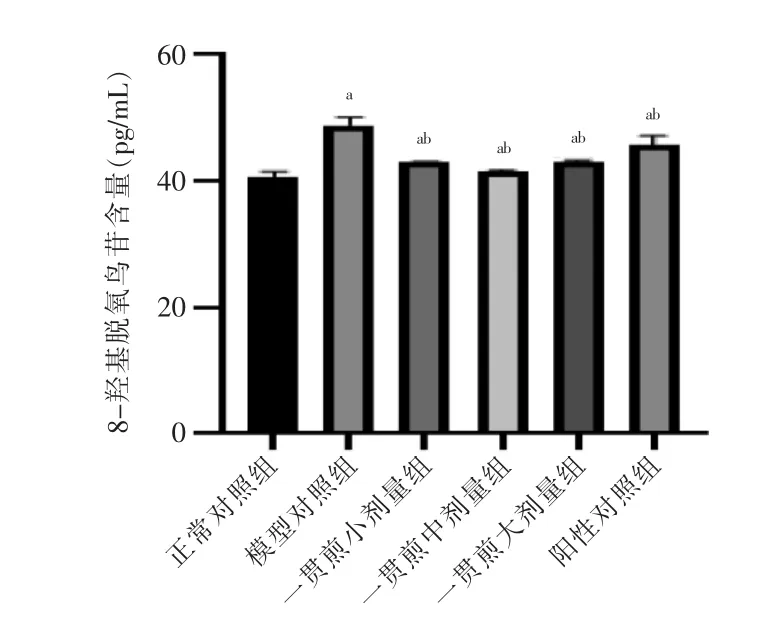
图1 一贯煎对L02 细胞8-OHDG 含量的影响
2.4 一贯煎对L02 细胞ROS 含量的影响
与正常对照组比较,模型对照组ROS 平均荧光强度显著增高(P <0.05)。与模型对照组比较,一贯煎小剂量组、一贯煎中剂量组、一贯煎大剂量组及阳性对照组ROS 平均荧光强度显著下降(P <0.05),其中一贯煎中剂量组ROS 平均荧光强度下降最明显。见图2。
2.5 一贯煎对L02 细胞周期的影响
与正常对照组比较,模型对照组G1期细胞百分率显著减少(P <0.05),S 期及G2/M 期细胞百分率均显著增加(P <0.05)。与模型对照组比较,一贯煎小剂量组、一贯煎中剂量组、一贯煎大剂量组及阳性对照组在G1期细胞百分率均显著增加(P <0.05),而S 期和G2/M 期细胞百分率均显著减少(P <0.05)。见图3、表3。
2.6 一贯煎对L02 细胞ATM、CHK2、Cdc25A、Cdc25C的mRNA 表达影响
与正常对照组比较,模型对照组ATM、CHK2 的mRNA 表达显著上调(P <0.05),Cdc25A、Cdc25C 的mRNA 表达显著下调(P <0.05)。与模型对照组比较,一贯煎小剂量组、一贯煎中剂量组、一贯煎大剂量组及阳性对照组ATM、CHK2 的mRNA 表达显著下调(P <0.05),Cdc25A、Cdc25C 的mRNA 表达显著上调(P <0.05)。见图4。
3 讨论

图2 一贯煎对L02 细胞内ROS 含量影响
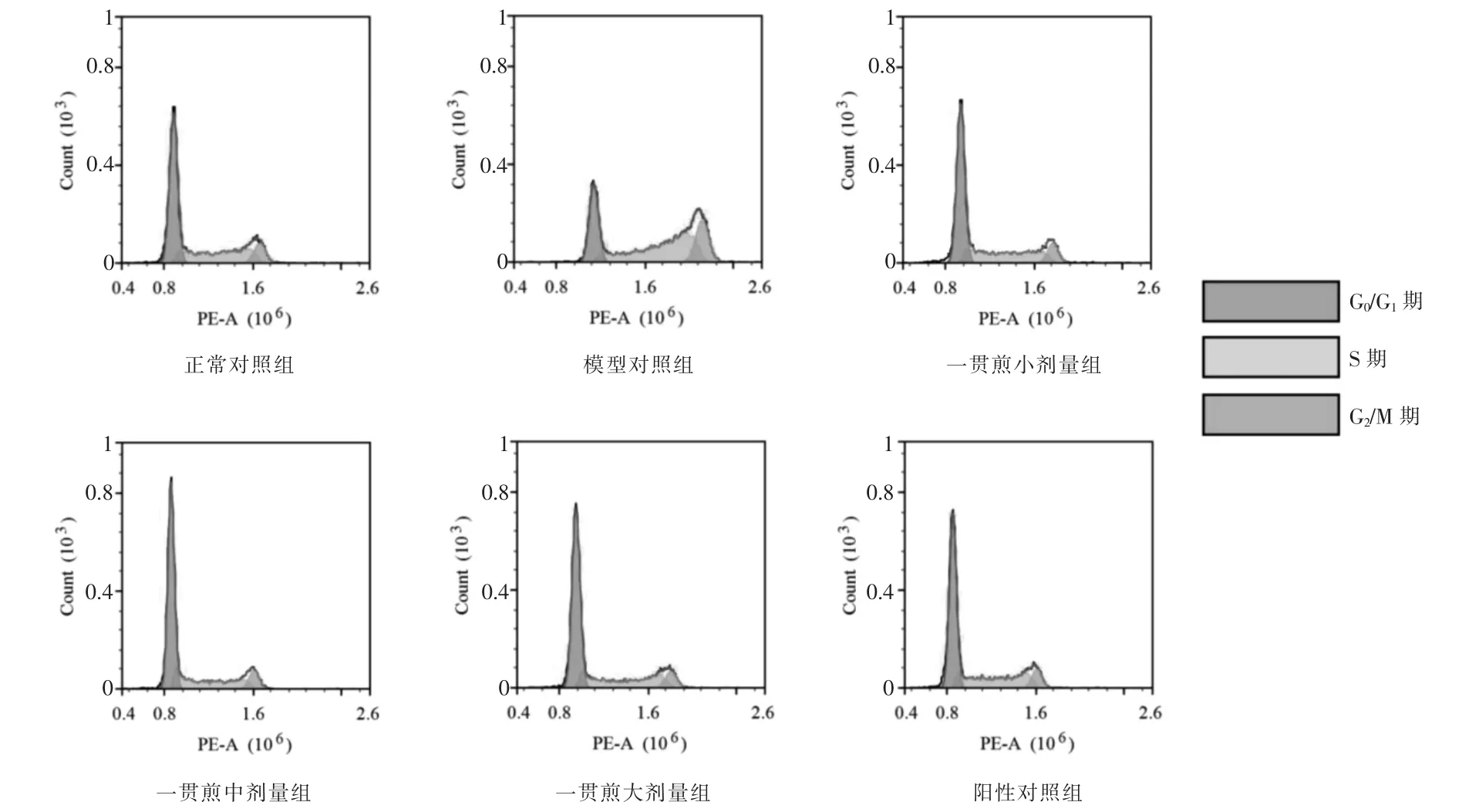
图3 一贯煎对L02 细胞周期的影响
表3 一贯煎对L02 细胞周期百分比影响(,n=3)
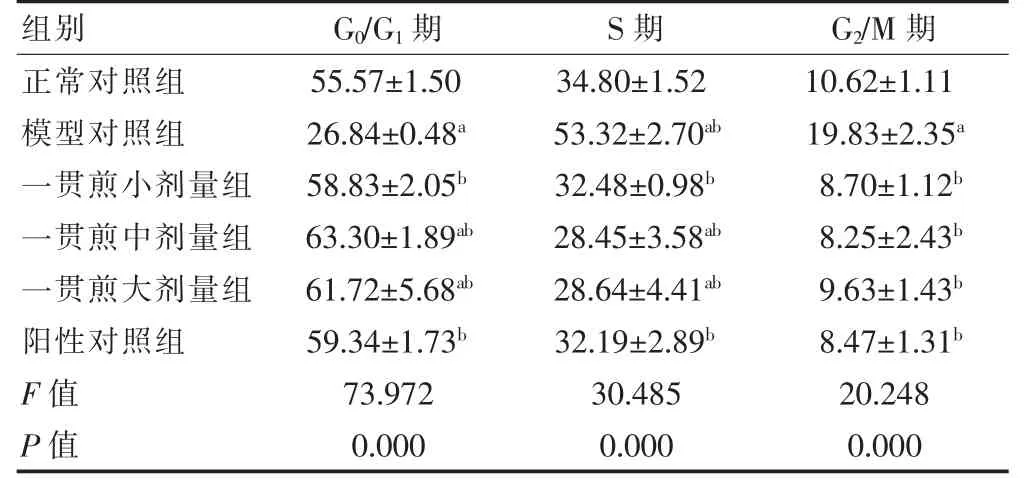
表3 一贯煎对L02 细胞周期百分比影响(,n=3)
注:与正常对照组比较,aP <0.05;与模型对照组比较,bP <0.05
ROS 包括自由基(如羟基自由基)和非自由基(如过氧化氢),是正常细胞代谢特别是线粒体代谢产生的高度反应性副产物。一般来说,适当的ROS 生成可能对许多细胞功能至关重要,但在生产过剩的情况下对生物体有害[11]。大量研究显示,随着ROS 的过度累积,进一步引起包括DNA 链断裂、DNA 位点突变等多种形式的DNA 损伤[12]。其中,8-OHdG 是氧自由基诱导的DNA 突变产物,一般用来反映DNA 损伤程度[13-15]。有研究发现[16],CHB 患者肝细胞内8-OHdG 数量与肝脏病理损伤呈正相关。一旦发生DNA 氧化损伤,机体会立即启动一系列DNA 损伤修复(DDR)通路。当细胞累计DNA 氧化损伤超过一定程度,超出自身负荷时,DNA 修复速度下降,一方面,出现DNA 复制突变的基因,使细胞分裂失控,最终引起癌变;另一方面,可能引起细胞自噬或凋亡[17-19]。
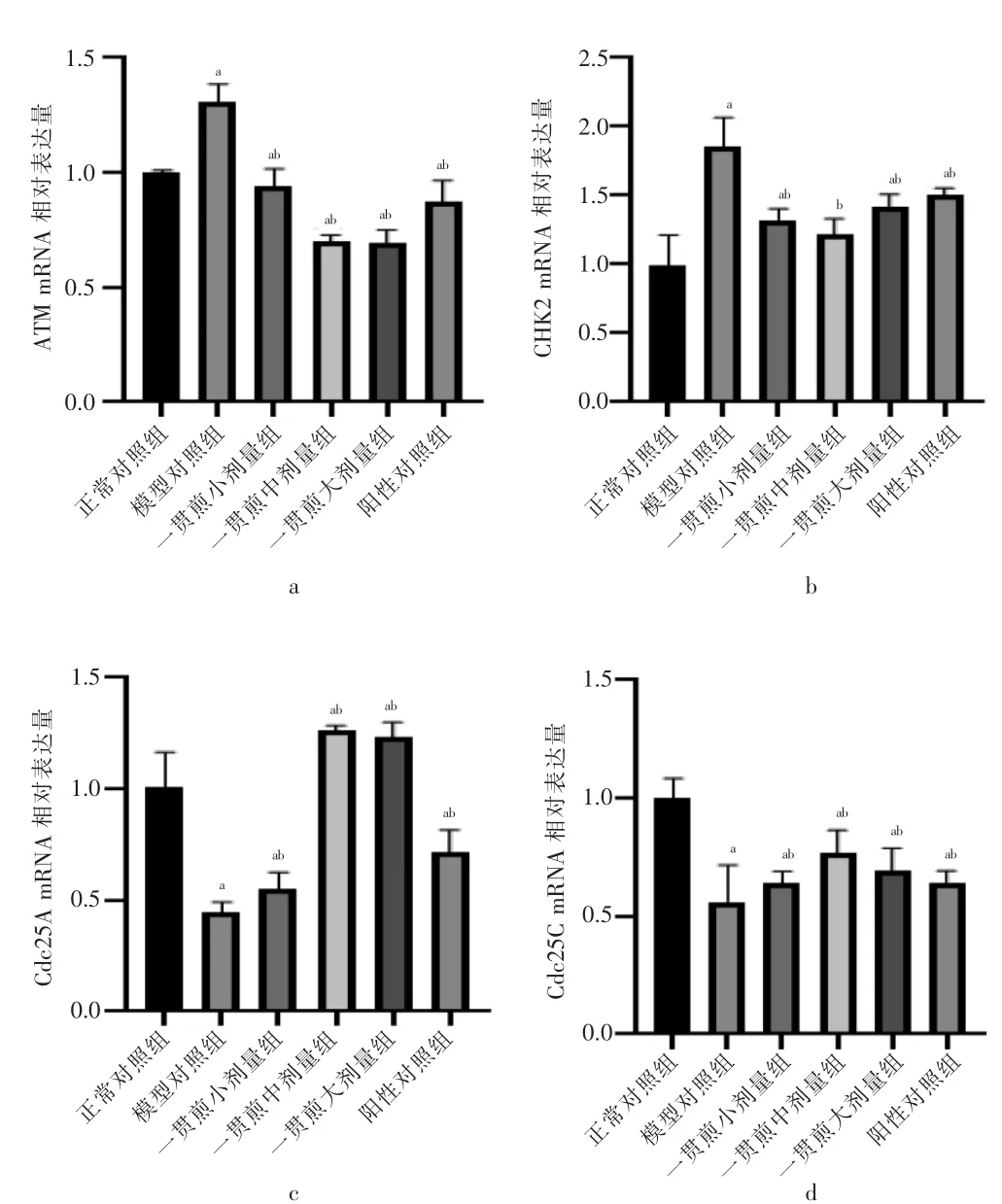
图4 一贯煎对L02 细胞ATM、CHK2、Cdc25A、Cdc25C 的mRNA 表达影响
一般情况下DNA 损伤的修复有赖于细胞周期检测点信号通路。ATM 蛋白激酶依赖性信号转导通路参与细胞周期多个检测点的调控[20]。其中,CHK2 是生物进化过程中非常保守的蛋白激酶,ATM 被激活后,进一步活化CHK2,引起Cdc25 磷酸化并失活,从而导致细胞周期阻滞。当细胞内ROS 过度累积时,细胞发生DNA 氧化损伤,ATM 被激活,机体立即对DNA进行修复。其中,ATM 可通过激活下游细胞周期检查点蛋白CHK2 等,CHK2 磷酸化,多聚泛素化介导的蛋白降解途径导致Cdc25A/Cdc25C 降解,使细胞周期无法继续,暂时性地引起S 期及G2/M 期阻滞,以便为DNA 修复提供足够的时间[21]。
目前,H2O2是细胞DNA 氧化损伤较常选用的造模药物。H2O2作用时间越久越有可能造成不可逆性损伤,导致药物不能起到修复作用。本实验为避免造成L02 细胞不可逆性损伤,以IC50(半数抑制率)作为造模药物毒性浓度的筛选标准。同时既往研究显示[22],以细胞活性下降后达到或接近60%作为判断L02 细胞氧化损伤模型建立成功的标准。综上所述,最终选择H2O2浓度为0.6 mmol/L,作用1 h 为造模浓度。与正常对照组比较,模型对照组L02 细胞8-OHDG 含量显著增加(P <0.05),ROS 平均荧光强度显著增加(P <0.05),提示H2O2诱导L02 细胞DNA 氧化损伤模型成功。与模型对照组比较,一贯煎小剂量组、一贯煎中剂量组、一贯煎大剂量组干预后,细胞存活率显著升高(P <0.05);L02 细胞ROS 平均荧光强度显著减少(P <0.05),且8-OHDG 含量显著下降(P <0.05),提示一贯煎含药血清对L02 细胞DNA 氧化损伤减轻明显,从而起到修复DNA 氧化损伤的作用。一贯煎小剂量组、一贯煎中剂量组、一贯煎大剂量组G1期细胞比例增加,S 期细胞减少,G2/M 期细胞比例减少(P <0.05),提示一贯煎含药血清使L02 细胞DNA 氧化损伤减轻,使L02 细胞阻滞在G1期,抑制H2O2对L02细胞S 期及G2/M 期的阻滞,减缓细胞DNA合成、分裂,为细胞DNA 损伤修复延长时间。一贯煎小剂量组、一贯煎中剂量组、一贯煎大剂量组ATM、CHK2 的mRNA 表达下调,Cdc25A、Cdc25C mRNA 表达上调(P <0.05),提示一贯煎含药血清通过抑制ATM/CHK2/Cdc25A/Cdc25C 信号通路修复L02 细胞DNA 氧化损伤。本研究一贯煎中剂量组较一贯煎小剂量组和一贯煎大剂量组作用明显,考虑一贯煎中剂量组已经达到最佳药效,再加大剂量,副作用增加,总疗效则下降。因此,开发出干预ATM/CHK2/Cdc25A/Cdc25C 信号通路的的新药物,对于临床慢性乙型病毒型肝炎患者,阻止向肝硬化及肝癌进展,具有积极意义。
