哺乳仔猪自然感染猪流行性腹泻病毒病例的病理形态学观察
2020-02-22王金坡崔亮亮孙秀秀王璐梦刘晓丽胡薛英谷长勤张万坡程国富
王金坡,崔亮亮,孙秀秀,王璐梦,刘晓丽,胡薛英,谷长勤,张万坡,程国富
(华中农业大学 动物医学院,湖北 武汉 430070)
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(porcine epidemie diarrhea virus,PEDV)感染引起的一种急性、高度传染性、高致死性病毒性肠道传染病[1]。该病多发生在冬季,PEDV可感染各年龄段及不同品种的猪,但其临床症状根据猪日龄大小而不同[2],成年母猪发病率20%~85%,架子猪、哺乳仔猪以及育肥猪发病率不等,对2周龄以内哺乳仔猪的危害尤为严重,其发病率和病死率甚至高达90%~100%[3]。该病于20世纪70年代首次在英格兰地区猪场被发现,随后在欧洲各国散发存在[4]。直到2010年PED在我国及亚洲其他国家出现大规模暴发,2013年PED在美国大面积肆虐,引起全球养猪业巨大经济损失后,才引起相关研究人员的密切关注[5]。至今,PED在发展中国家的传播仍未得到有效控制。在我国,PED的流行趋势依然严峻[6]。目前,对该病在自然感染状态下病理形态学的细致研究甚少,因考虑到在自然感染情况下的研究较人工感染更接近于普遍临床变化,所以本试验通过详细、系统地观察哺乳仔猪自然感染PEDV后的各种病理学变化,旨在为进一步探究PED的致病机理及发病规律提供可靠的理论依据,以便更有效地指导临床。
1 材料与方法
1.1 病料来源临床体征疑似PEDV感染的7头3~5日龄哺乳仔猪均来自广西贵港市某猪场,了解猪群发病症状和饲养管理等情况后,对仔猪进行病理剖检,经湖北省动物疫病预防控制中心检测,确定为PEDV抗原阳性,猪传染性胃肠炎病毒(TGEV)、猪轮状病毒(PRoV)、猪德尔塔冠状病毒(PDCoV)、伪狂犬病病毒(PRV)、猪瘟病毒(CSFV)、猪圆环病毒2型(PCV2)、猪繁殖与呼吸综合征病毒(PRRSV)和猪库布病毒(PKV)等常见猪传染病抗原均为阴性。
1.2 主要试剂及仪器dNTP、Taq DNA聚合酶:MBI Fermentas,加拿大;Easy Pure Viral DNA/RNA Kit试剂盒:北京全式金生物技术有限公司;M-MLV反转录试剂:TaKaRa宝生物工程(大连)有限公司;HRP标记山羊抗兔/鼠IgG:基因科技(上海)股份有限公司;AEC显色剂:北京索莱宝科技有限公司;RM2235切片机:莱卡,德国;Nikon 80i生物光学显微镜:Nikon,日本;SU8100型扫描电镜和HT7700型透射电镜:HITACHI,日本。
1.3 组织病理学观察将所取组织经福尔马林固定后制成石蜡切片,HE染色,通过NIS-Elements高清晰度彩色图文分析系统配合Nikon 80i生物光学显微镜对典型病变进行显微采图并详细记录。
1.4 亚细胞结构观察
1.4.1场发射扫描电镜观察 取新鲜的空肠组织,放入戊二醛溶液中固定过夜,再经锇酸固定,乙醇脱水,临界点干燥,粘样,喷金,SU8100型扫描电镜观察,采集图像分析。
1.4.2透射电镜观察 取新鲜的空肠组织,放入戊二醛溶液中固定过夜,再经锇酸固定,丙酮脱水,包埋,聚合,制成超薄切片,铀铅双重染色,HT7700型透射电镜观察,采集图像分析。
1.5 免疫组织化学检测利用常规免疫组化方法对所取组织中的PEDV进行原位检测。分别设立空白对照、阴性对照与阳性对照。鼠抗PEDV单克隆抗体(华中农业大学肖少波教授课题组馈赠)稀释度为1∶400,二抗为HRP标记的山羊抗鼠抗体,用AEC显色,通过NIS-Elements高清晰度彩色图文分析系统配合Nikon 80i生物光学显微镜进行采图分析。
2 结果
2.1 临床症状及剖检变化临床症状:发病仔猪主要表现身体消瘦、被毛粗乱、眼窝下陷、精神沉郁、扎堆、厌食、呕吐、水样腹泻,粪便呈黄色,有腥臭味。腹泻脱水严重者,无力站立,甚至出现死亡。
剖检变化:小肠鼓气,肠腔内充满黄色或黄绿色内容物,肠壁变薄,呈半透明状,缺乏弹性(图1B);胃内有未消化的乳凝块(图1C);肠系膜淋巴结充血肿胀(图1D);其他器官未见明显的眼观病变。
2.2 组织病理学观察胃肠道:肠道组织内广泛出现毛细血管淤血情况。小肠有卡他性或浆液性炎症出现。十二指肠肠绒毛萎缩,黏膜上皮细胞坏死、脱落,固有层裸露,伴有少量淋巴细胞浸润,部分肠腺上皮细胞坏死(图2A)。空肠肠绒毛萎缩严重,上皮细胞边缘不规则缺损,细胞质空泡化严重,固有层可见少量细胞坏死(图2B)。回肠可见肠绒毛上皮细胞部分空泡化,坏死,肠淋巴结处可见细胞核碎片,肠腔内充满脱落的上皮细胞(图2C)。大肠内有出血性或浆液性炎症出现。盲肠黏膜被覆一层不完整的扁平上皮,固有层水肿、疏松,伴有少量淋巴细胞浸润(图2D)。结肠部分黏膜上皮细胞脱落,固有层毛细血管淤血、结构疏松,黏膜上皮与固有层分离(图2E)。肠系膜淋巴结局部组织出现毛细血管充血或轻微出血,细胞肿大,皮质和髓质界线不清,局部出现淋巴细胞减少(图2F)。直肠和胃未见明显组织病理学变化。
脾内红髓和白髓界线不清,局部淋巴细胞减少,并伴有大量嗜酸粒细胞浸润(图2G)。肺内局部支气管周围出现肺泡壁增厚,肺泡破裂、融合(图2H)。心肌局灶性坏死,心肌纤维变性,有少量的淋巴细胞和嗜酸粒细胞浸润(图2I)。肝和肾未见明显组织病理学变化。

图1 腹泻仔猪(3日龄)剖检结果 A.肠腔内充满黄色或黄绿色内容物,肠壁变薄;B.胃内有未消化的乳凝块;C.肠系膜淋巴结,充血肿胀;D.剖检整体变化
2.3 亚细胞结构观察
2.3.1场发射扫描电镜观察 空肠黏膜上皮细胞破裂,微绒毛普遍杂乱无章,出现不同程度的短缩、稀疏(图3A),甚至有些肠绒毛上的微绒毛几乎消失,裸露上皮(图3B)。
2.3.2透射电镜观察 空肠胞质内出现网格样变化,形成大小不等,形态不同的空泡(图3C);内质网破裂、缢断,胞质内出现散在的内质网片段(图3D);线粒体肿胀变圆,嵴减少、排列紊乱,有些甚至空泡化(图3D);胞质内可见散在的冠状病毒颗粒(图3D)。
2.4 免疫组织化学检测在十二指肠(图4A)、空肠(图4B)、回肠(图4C)、盲肠(图4D)、结肠(图4E)中均检测到阳性信号,其中空肠和回肠肠段病毒载量最高,病毒仅局限于胞质当中,在细胞核中未检测到,并且其主要分布在黏膜绒毛上皮细胞中,偶尔在肠腺细胞内也见有分布,而在其他组织器官中未见到阳性信号。
3 讨论
目前国内,对猪流行性腹泻在自然感染情况下病理形态学的研究较少,考虑到人工攻毒条件下,包括病毒的传播及感染方式在内的诸多因素与自然条件下的感染会有一定程度的差别,因此,本研究在排除了其他病原后,以自然条件下PEDV单独感染的哺乳仔猪为研究对象,探究其致病机理及发病规律,以便更有助于指导临床。
在本研究中,感染PEDV的仔猪出现了小肠鼓气、肠壁变薄、胃内有未消化的乳凝块和肠系膜淋巴结肿胀的症状。据卓秀萍等[7]报道,在人工感染下的研究中发现,心、肝、脾和肾等器官也出现了不同程度的病变,而在本研究中以上器官均未见眼观病理损伤。

图2 腹泻仔猪(3日龄)组织病理学变化(HE) A.十二指肠肠绒毛上皮脱落,固有层裸露,伴有少量淋巴细胞浸润;B.空肠绒毛上皮细胞胞质空泡化严重;C.回肠绒毛上皮细胞坏死、脱落,肠腔内充满脱落的上皮细胞;D.盲肠肠黏膜被覆一层不完整的扁平上皮,固有层水肿、疏松;E.结肠固有层毛细血管淤血,黏膜上皮与固有层分离;F.肠系膜淋巴结,皮质和髓质界线不清,局部出现淋巴细胞减少;G.脾红髓和白髓界线不清,伴有大量嗜酸粒细胞浸润;H.肺脏局部出现肺泡壁增厚;I.心肌局灶性坏死,伴有少量淋巴细胞和嗜酸粒细胞浸润。图中右上角图片为箭头处放大后的高倍镜视野(400×)
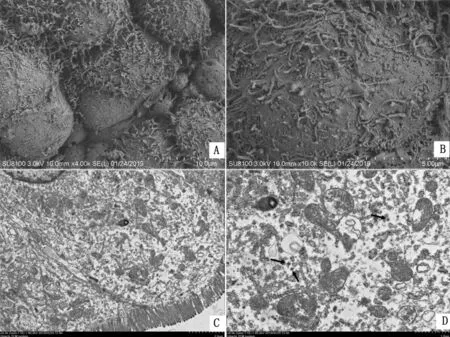
图3 腹泻仔猪(3日龄)空肠亚细胞结构变化 A.黏膜上皮微绒毛杂乱无章、短缩、稀疏;B.黏膜上皮微绒毛几乎消失、裸露上皮;C.胞质内形成大小不等,形态不同的空泡;D.内质网缢断,线粒体肿胀变圆,胞质内可见散在的冠状病毒颗粒(箭头处)
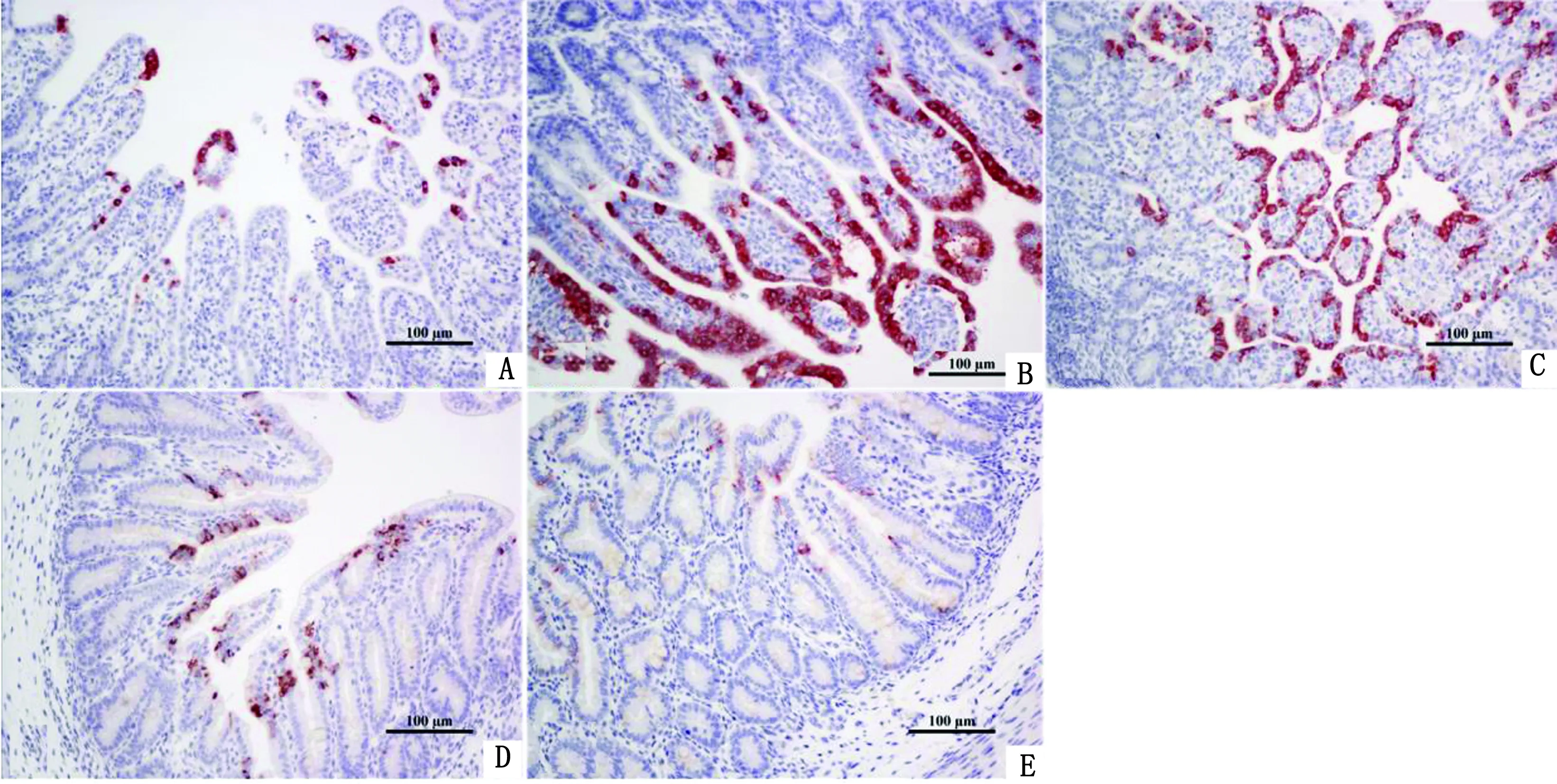
图4 腹泻仔猪(3日龄)肠道免疫组化结果 A.十二指肠;B.空肠;C.回肠;D.盲肠;E.结肠
小肠是猪消化吸收的主要器官,肠绒毛在消化吸收中具有重要的作用,环形皱襞和微绒毛大大增加了小肠的总面积[8]。在本研究中,仔猪感染PEDV后,小肠绒毛萎缩、变短,上皮细胞崩结、脱落,上皮细胞的微绒毛脱落、稀疏,这些病变都会造成小肠总面积的减少,影响小肠的消化吸收功能,导致仔猪对营养物质吸收不良、消瘦等症状,以上结果与JUNG 等[9]的研究一致。脾和肠系膜淋巴结均是机体的免疫器官,病毒入侵后,会刺激机体产生免疫反应。本研究中发现,脾和肠系膜淋巴结均出现了淋巴细胞减少的现象,说明PEDV感染对机体的免疫器官造成了一定程度的损伤。免疫器官的严重病变将使得机体更易受到其他机会致病菌以及病毒的感染,这可能也是在临床上多见猪流行性腹泻与其他病毒混合感染、病死率较高的原因之一[7]。另外,本研究还发现,感染仔猪肺局部出现肺泡壁增厚和心肌局灶性坏死的现象,这也预示着猪流行性腹泻可能会继发心肺疾病,因此我们认为,在治疗腹泻的同时,也要加强对心肺疾病的预防。而在卓秀萍等[7]和闫清源[10]的研究中还发现肝和肾中也出现了较明显的病理变化。
PEDV的致病性与其组织嗜性具有密切的关系。薄清如[11]、潘耀谦[12]的研究发现,猪呼吸道黏膜或猪小肠细胞刷状缘含有大量的猪氨肽酶(pAPN),这是PEDV感染所必需的细胞受体,它决定了病毒的组织嗜性并奠定了病毒感染、增殖的必要基础。在本研究中发现,病毒分布在除直肠外的所有肠段,以小肠中病毒载量最高,但肺中未见有病毒分布。并且我们发现病毒仅局限于上皮细胞或肠腺细胞的胞质当中,而细胞核中未检测到病毒,此结果与遇秀玲等[13]和杨臣等[14]在人工感染下的研究结果一致,两种不同方式感染的研究都说明了PEDV侵害的是肠上皮细胞和肠腺细胞并且寄居在胞质当中。
据DUCATELLE等[15]报道,PEDV经过口感染后进入消化道,识别小肠绒毛上皮细胞直接侵入细胞,利用宿主细胞的多种蛋白进行生物合成,完成整个病毒复制过程。本研究通过透射电镜观察发现,经PEDV感染的肠上皮细胞中线粒体肿胀,内质网缢断,胞质空泡化,且胞质内可见散在的病毒颗粒,推测病毒感染进程可能是在内质网中完成复制,然后突破内质网进入到胞质当中,破坏了线粒体结构,使细胞能量产出功能受损,代谢功能紊乱,继而出现胞质内空泡化现象。而在遇秀玲等[13]和闫清源[10]的研究中还发现胞核和溶酶体等结构也出现了不同程度的病理损伤。
综上所述,我们发现,哺乳仔猪在自然感染PEDV条件下,出现的病理损伤主要集中在肠道系统,而其他器官出现的病理损伤较轻微,涉及器官较少,而在人工感染PEDV条件下,不但肠道系统出现了明显的病理变化,而且其他组织器官均出现了不同程度的病理损伤,涉及范围更广。我们推测,出现以上现象的原因可能是两种不同感染方式条件下,毒株类型,病毒的传播、感染方式和感染计量存在一定的差别。因为人工感染普遍采取口服的方式,而PEDV的传播除粪口途径之外,近年来报道还可以通过空气进行传播[16],而后者恰恰是人工感染忽略的地方,在临床上,两种传染方式应该都存在,所以我们建议在人工进行PEDV感染试验时,可以在口服病毒的同时,也考虑滴鼻的方式,这样建立的感染模型更加接近于临床状态,从而对PED进行的研究更具信服力。
