长链非编码RNA HULC对胶质母细胞瘤原位移植瘤模型肿瘤生长的促进作用
2020-02-22胡宇辰尹恬恬
胡宇辰,尹恬恬,李 倩,叶 珊,吴 景,何 杰,
(1.安徽医科大学附属省立医院//中国科学技术大学附属第一医院,安徽 合肥 230001;2.安徽医科大学第二附属医院,安徽 合肥 230601;3.中国科学技术大学附属第一医院临床病理中心,安徽 合肥 230001)
胶质母细胞瘤(glioblastoma,GBM)是最常见的颅内原发性恶性肿瘤,约占所有脑肿瘤的80%[1],WHO分级为Ⅳ级[2]。目前手术、放疗和化疗等常规治疗手段疗效不佳,大多数患者预后差、生存期短,中位生存期仅12~14个月[3],侵袭性生长是恶性的主要特征。ENCODE项目联合会目前估算了有超过28 000种不同的LncRNA[4],广泛参与各种恶性肿瘤的生物进程,包括肿瘤细胞增殖、侵袭、迁移、凋亡及EMT等功能的调节,在肿瘤的发生发展中发挥着重要作用[5]。通过研究GBM与LncRNA之间的关系,有可能为其提供一种新的治疗策略。肝癌高表达转录本(the highly upregulated in 1iver cancer,HULC)是LncRNA的一种,最早发现于肝细胞癌[6],并在肺癌、胃癌、结直肠癌等恶性肿瘤中出现异常的表达上调[7-9],但其与GBM之间的研究尚少,本实验通过体外细胞实验及构建小鼠异种移植模型,初步探究了LncRNAHULC对GBM生长的作用机制,并将为后续更深入的研究及临床分子靶向治疗提供理论依据。
1 材料与方法
1.1 细胞系与细胞培养
人脑胶质母细胞瘤U87细胞系(中国典型培养物保藏中心,中国),用含100 mL/L胎牛血清(FBS,Biological Industries,以色列)的DMEM高糖培养基(Biological Industries,以色列)及10 mL/L青霉素/链霉素(碧云天生物科技有限公司,中国)培养,通过载体构建、病毒包装侵染将HULC模拟物及抑制剂和对应的空白载体分别转染至U87细胞中,再通过致死浓度检测和稳筛株构建获得过表达组(HULC-over组)及其对照组(VEC组)和沉默表达组(HULC-siRNA组)及其对照组(NC组)稳定转染细胞。并置于37 ℃、体积分数5%CO2恒温培养箱中培养。构建载体过程中,过表达组HULC基因序列号为:NR_004855.2。针对该基因设计shRNA基因序列为:HULC-homo-140-s:GATCCGAACTCTGATCGTGGACATTTCAA⁃GAGAATGTCCACGATCAGAGTTCTTTTTTG,HULChomo-140-as:AATTCAAAAAAGAACTCTGATCGT⁃GGACATTCTCTTGAAATGTCCACGATCAGAGTTC⁃G;shNC-s:GATCCGTTCTCCGAACGTGTCACGTT⁃TCAAGAGAACGTGACACGTTCGGAGAACTTTTTT⁃G,shNC-as:AATTCAAAAAAGTTCTCCGAACGT⁃GTCACGTTCTCTTGAAACGTGACACGTTCGGAGA⁃ACG。
1.2 qRT-PCR
消化收集U87 HULC-over组及VEC组和HULC-siRNA组及NC组细胞,使用总RNA提取试剂盒(QIAGEN,德国)提取总RNA。使用cDNA逆转录试剂盒(Thermo Fisher Scientific,美国),根据说明书进行互补DNA(cDNA)合成。使用Power SYBR Green Master Mix(Applied Biosystems,美国)和ABI 7500 Fast Real-Time PCR System(Applied Biosystems,美国)定量HULC信使RNA(mRNA)水平,并用2-△△Ct表示HULC mRNA的相对表达量。GAPDH作为HULC的内参,实验重复3次。
1.3 增殖实验
分别收集HULC-over组及VEC组和HULCsiRNA组及NC组细胞,重悬计数并调整细胞浓度。准备4块96孔板,每组细胞设3个复孔,向每孔加入100 μL细胞悬液(含2 000个细胞),在细胞周围一圈每孔加入200 μL PBS溶液,置于恒温培养箱中培养。待细胞贴壁后,取出一块96孔板,弃去原培养基,每孔加入100 μL 100 mL/L CCK8混合液,置培养箱中孵育2 h后用酶标仪检测450nm处的吸光度值(OD值),此为24 h OD值,余下的96孔板每孔补加完全培养基100 μL,并依次在48、72和96 h以同样的方法检测相应的OD值。实验重复3次。
1.4 克隆形成实验
分别收集HULC-over组及VEC组和HULCsiRNA组及NC组细胞。在6孔板中以低密度(300个细胞/孔)接种,每组设3个复孔。4 d后更换培养基,并于10~12 d后终止培养。用40 g/L多聚甲醛固定细胞,并用结晶紫染色。在显微镜下计数大于50个细胞的克隆细胞数量,克隆形成率(%)=克隆数/实际接种细胞数×100%。实验重复3次。
1.5 凋亡实验
用不含EDTA的胰酶消化并收集细胞,用预冷PBS洗涤两遍,然后按照Annexin V-488/PI Apoptosis试剂盒(Invitrogen,美国)进行实验。最后,通过流式细胞仪检测。实验重复3次。
1.6 体内实验
1.6.1 建立小鼠原位异种移植模型 动物实验设计经中国科学技术大学动物实验伦理审查委员会批准,符合动物实验伦理(伦理号:USTCA⁃CUC1801033),所有的操作和实验流程均遵守《实验动物管理条例》,实验动物由专人饲养于中国科学技术大学实验动物中心SPF级动物实验室。随机将重约17~20 g的40只健康雌性5~7周无胸腺裸鼠(BALB/c-Foxn1nu/Nju,购自南京大学模式动物研究所,SPF级,许可证号:SCXK(苏)2018-0008)按照注射U87细胞对应分为HULC-over组(n=10)和VEC组(n=10)及HULC-siRNA组(n=10)和NC组(n=10),麻醉后置于单臂数显立体定位仪中,于前囟前1 mm,中线右侧2~3 mm处以颅骨钻钻孔,将悬浮于5 μL PBS的1×106各组细胞分别注射入颅内。以后每3 d观察小鼠运动能力及神经系统体征,并每周称重1次。当裸鼠出现明显消瘦,蜷缩不动,对外界刺激无反应等恶病质或神经运动功能明显下降的体征时,对其处以安乐死,并立即剥离脑组织及肿瘤组织,用PBS冲洗后,肉眼查看鼠脑组织表面情况,分辨肿瘤结构以及与周围脑组织的浸润程度,并将其固定于40 g/L多聚甲醛中24 h,待进行后续实验。
1.6.2 组织切片及免疫组织化学染色 固定后组织经取材、脱水、浸蜡,石蜡包埋、切片(厚4 μm),进行HE染色和免疫组化染色。光学显微镜诊断鼠脑移植瘤的组织学形态,并观察浸润、血管生长、坏死等特征。全自动免疫组化仪(Roche Ventana,美国)进行Ki67的免疫组织化学染色。抗体稀释为1∶200(购自北京中山生物技术有限公司)。PBS替代抗体作为阴性对照。Ki67蛋白定位于细胞核中。阳性染色为浅黄色,黄色或棕色。在显微镜下的每个切片上观察到10个随机选择的视野,进行免疫组织化学方法的半定量分析。计算阳性染色细胞的百分比:0分小于5%;1分为6%~25%;2分为26%~50%;3分为51%~75%;4分为>75%。染色强度等级为0分为阴性,浅黄色为1分;黄色或深黄色2分,棕色或深棕色3分。两次得分相乘均为免疫组织化学的最终得分。
1.7 统计学分析
使用SPSS 22.0和GraphPad Prism 7软件分析该研究中的数据。呈正态分布的测量数据用平均值±标准差(mean± SD)。两组独立样本间的比较,符合正态分布及方差齐性的数据采用独立样本t检验(CCK8增殖曲线采用组内RM one-way ANOVA分析,组间独立样本t检验)。生存期分析采用log-rank(Mantel-Cox)检验。P<0.05时认为差异具有统计学意义。
2 结果
2.1 HULC表达水平检测
qRT-PCR检 测HULC表 达,与VEC组相比,HULC-over组中HULC表达显著升高(图1A),差异具有统计学意义(t=31.82,P<0.0001);与NC组 相比,HULC-siRNA组的HULC表 达水平显著减少(图1B),差异具有统计学意义(t=4.84,P=0.008)。
2.2 HULC促进胶质母细胞瘤U87细胞体外增殖
CCK8增殖实验和克隆形成实验结果显示,HULC-over组细胞增殖率高于VEC组,HULCsiRNA组细胞增殖率低于NC组(图2A,B)。细胞克隆实验显示VEC组和HULC-over组克隆形成率分别为(34.47±1.56)%和(95.4±2.74)%;NC组和HULC-siRNA组克隆形成率分别为(23.83±0.92)%和(10.23±0.61)%,HULC-over组克隆形成率高于VEC组,HULC-siRNA组克隆形成率低于NC组(图2C,D)。实验证明HULC促进U87细胞体外增殖。上述实验差异均具有统计学意义(图2A:HULC-over:F=276.7,P<0.0001;VEC:F=276.7,P=0.0001;第2天:t=10.6,P<0.0001,第3天:t=11.48,P<0.0001,第4天:t=9.91,P<0.0001;图2B:HULC-siRNA:F=38.9,P=0.0004;NC:F=1439,P<0.0001;第2天:t=8.89,P=0.0001,第3天:t=11.51,P<0.0001,第4天:t=20.77,P<0.0001;图2C:t=21.29,P<0.0001;图2D:t=18.64,P<0.0001)。
2.3 HULC抑制胶质母细胞瘤U87细胞凋亡
流式细胞分析显示,VEC组和HULC-over组早期凋亡率分别为(3.55±0.56)%,(0.09±0.01)%,HULC-over组细胞凋亡率低于VEC组(图3A),实验差异具有统计学意义(t=6.21,P=0.0034);NC组和HULC-siRNA组早期凋亡率分别为(2.89±0.67)%,(7.13±0.14)%,HULC-siRNA组细胞凋亡率高于NC组(图3B),实验差异具有统计学意义(t=6.22,P=0.0034)。说明HULC可以抑制细胞凋亡,从而促进细胞增殖。
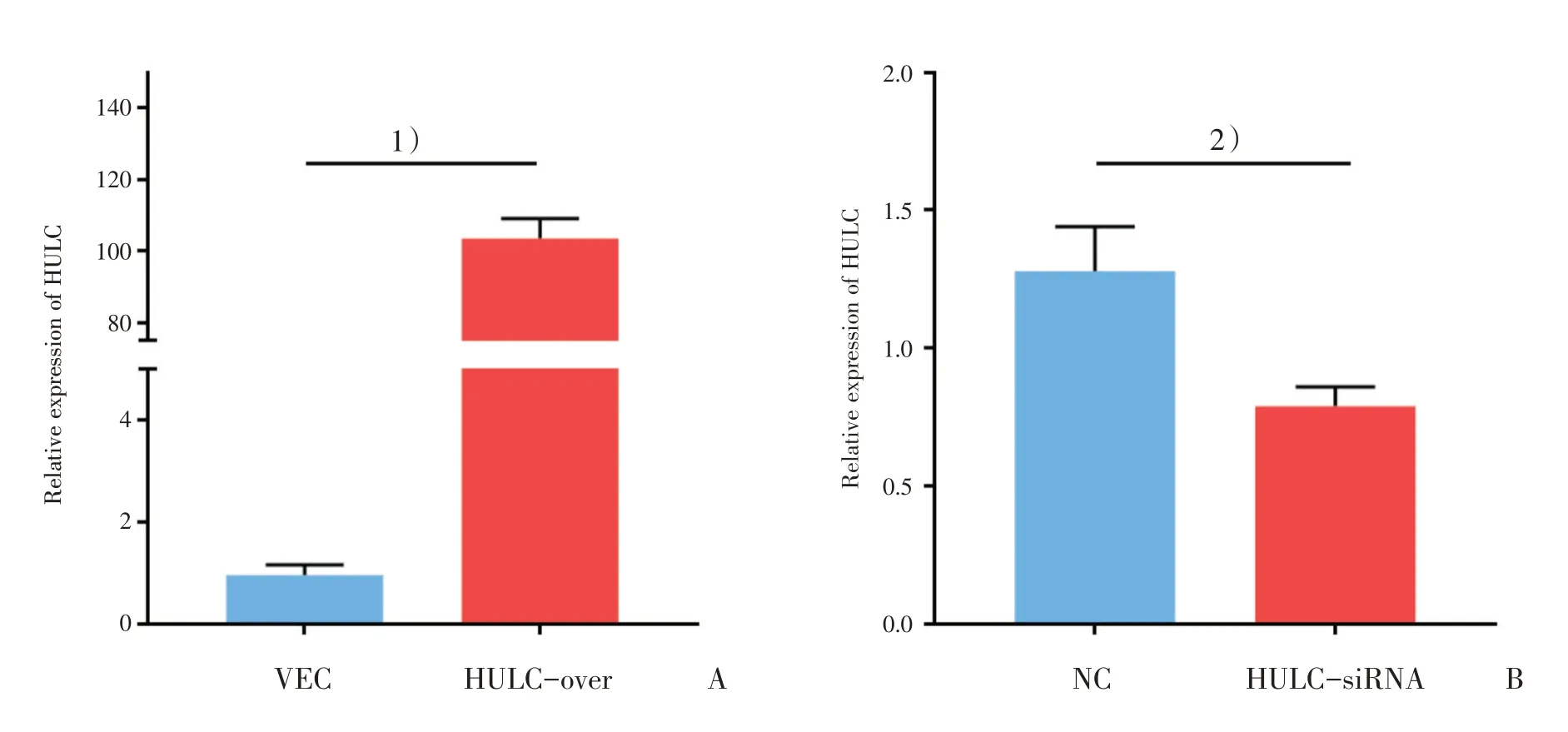
图1 U87稳转细胞株中HULC表达水平验证Fig.1 Verification of HULC expression levels in U87 stably transfected cell lines
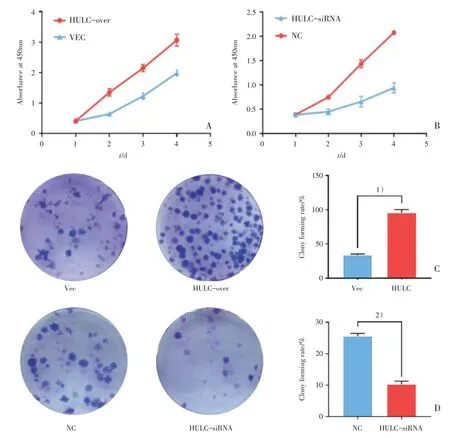
图2 HULC促进U87细胞体外增殖Fig.2 HULC promotes proliferation of U87 cells in vitro
2.4 HULC促进体内胶质母细胞瘤的生长
HULC-over组比HULC-siRNA组小鼠生存期明显缩短,对照组生存期则在两者之间(图4A),实验差异具有统计学意义(χ2=20.31,P=0.0001)。鼠脑肿瘤组织中,与VEC组相比,HULC-over组中HULC表达显著升高,差异具有统计学意义(t=5.57,P<0.000 1);与NC组相比,HULC-siRNA组的HULC表达水平显著减少,差异具有统计学意义(t=10.72,P<0.000 1)。显微镜观察HE切片,低倍镜下(×40)可见宿主脑组织中肿瘤组织境界不清,呈浸润性生长(图4C);高倍镜下(×200)可见GBM细胞异型性、核分裂象,肿瘤组织黏液样变性,地图状坏死及血管形成(图4D)。说明成功构建GBM原位移植瘤模型,并且GBM在鼠脑中呈恶性生长。观察免疫组化结果(×200),与VEC组相比,Ki67在HULC-over组中蛋白表达水平更高,实验差异具有统计学意义(t=3.64,P=0.022);与NC组相比,Ki67在HULC-siRNA组中蛋白表达水平更低(图4E),实验差异具有统计学意义(t=4.03,P=0.016)。说明HULC促进GBM体内生长并缩短小鼠生存期。
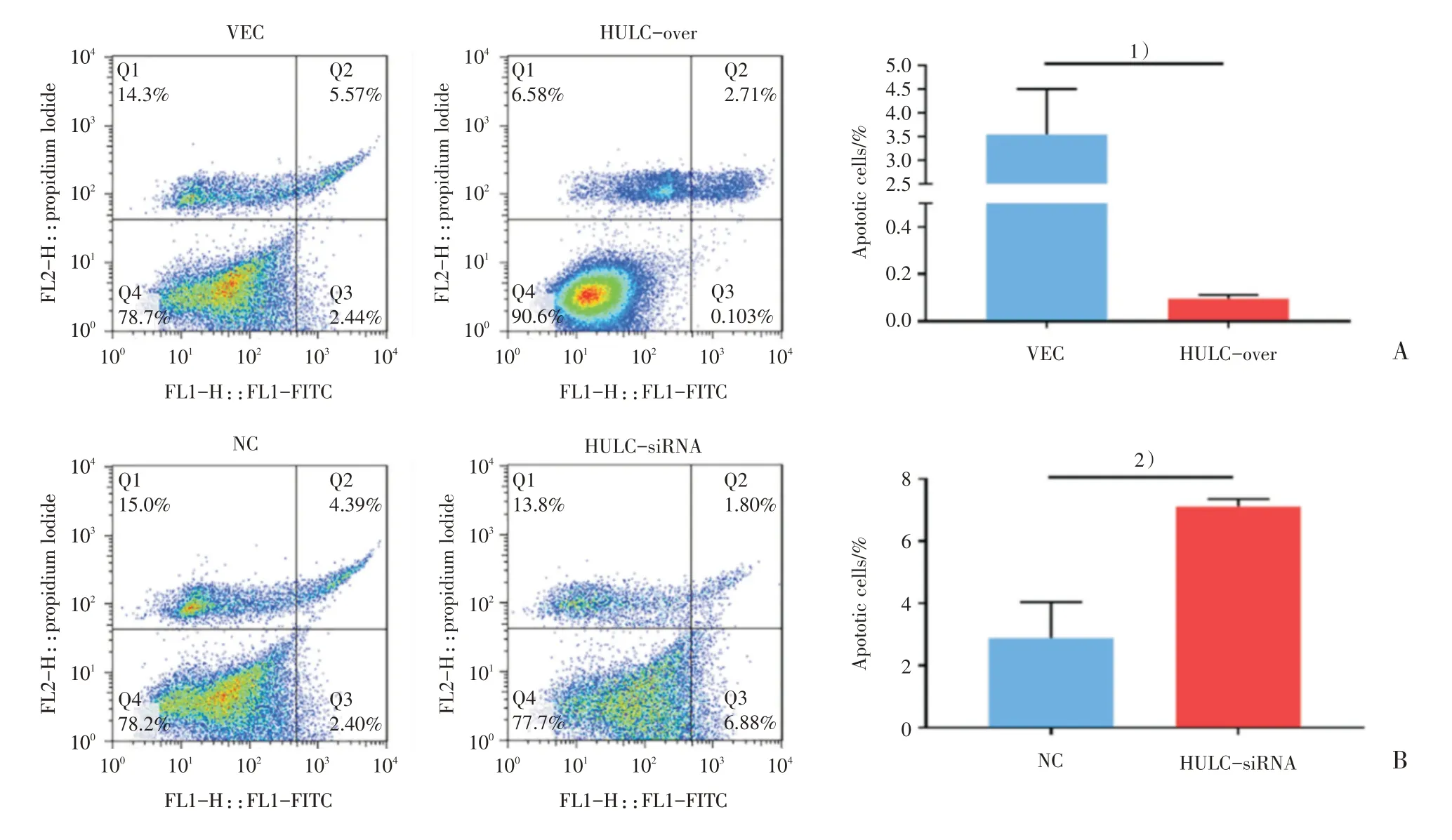
图3 HULC抑制U87细胞凋亡Fig.3 HULC inhibits apoptosis of U87 cells
3 讨论
胶质母细胞瘤是脑肿瘤中最常见和最具侵袭性的病理类型,其死亡率居高不下,严重危害了人类健康。因此,早期诊断对GBM至关重要,而生物标志物更是诊治的重中之重[10]。早期研究认为LncRNA是一段长度超过200nt的没有蛋白质编码功能的“垃圾基因”[11]。但近年来,越来越多的报道表明,LncRNA在转录、翻译调控及表观遗传修饰的过程中发挥关键作用,它们通过与DNA、RNA、蛋白质等分子结合来发挥生物学功能,包括增殖、凋亡、侵袭及迁移等,在肿瘤的形成及生长过程中发挥重要作用[12-13],这为发现新的生物标志物起到推动作用。
HULC是位于人类基因组6p24.3,长度为500 bp的LncRNA[6],它已被证实在多种恶性肿瘤中发挥促癌基因的作用[14-15]。Li等[14]发现HULC在骨肉瘤中表达上调并促进骨肉瘤的发生。Xu[15]等发现HULC通过调节PTPRO/NF-κB信号通路促进肺鳞状细胞癌的发展。本课题组Yan等[16]前期研究发现,LncRNA HULC在患者GBM组织和细胞系中的表达水平较正常脑组织明显上调,提示其可能在GBM中可能发挥促癌作用。本研究在此基础上初步分析了LncRNA HULC在GBM发病机制中的作用。在细胞水平,LncRNA HULC过表达可显著增强GBM U87细胞增殖能力,并且抑制细胞早期凋亡;在动物水平,LncRNA HULC过表达可促进肿瘤组织生长并减少小鼠生存期。这些研究结果表明,LncRNA HULC在GBM中起癌基因的作用,并可能作为潜在的预后指标。

图4 上调HULC促进胶质母细胞瘤体内进程,反之则抑制Fig.4 Up-regulation of HULC promote GBM progression in vivo,suppress Conversely
增殖与凋亡之间的不平衡是癌细胞最重要的特征之一。因此,抑制癌细胞增殖或诱导其凋亡都被认为是癌症的有效治疗手段[17]。Wang[18]等研究认为Bcl-2和Bax之间的相互作用在细胞凋亡中起决定性作用,Bcl-2通过抑制细胞色素C的释放来抑制细胞凋亡,Bax通过促进细胞色素C的释放和多种caspase依赖性信号通路来诱导细胞凋亡。本研究表明下调LncRNA HULC表达可导致U87细胞凋亡率明显升高,增殖能力明显下降。体内实验表明,下调LncRNA HULC表达可明显降低肿瘤侵袭性,减少组织坏死,从而延长小鼠生存期,并且Ki67的表达水平明显降低说明下调LncRNA HULC会抑制肿瘤细胞增殖。故下调LncRNA HULC表达能够抑制肿瘤生长,促进肿瘤细胞凋亡。大量文献报道指出PI3K/AKT信号通路是细胞中重要的信号通路,它广泛参与细胞增殖、凋亡及侵袭等细胞功能的调节[19]。PI3K/AKT信号通路的异常激活已在多种癌细胞中被证实,其中包括GBM细胞。Rui等[20]指出LncRNA HULC下调可抑制大鼠垂体腺瘤GH3细胞的增殖、迁移及激素分泌,并促进其凋亡,其机制是HULC与miR-130b相互作用,下调FOXM1的表达,从而抑制了PI3K/AKT信号通路。Miao等[21]研究认为PI3K/AKT信号通路是驱动肿瘤细胞异常增殖,分化和侵袭的关键,EMP1可通过激活PI3K/AKT信号通路促进GBM细胞增殖[21]。据报道AKT的激活可以磷酸化多种下游靶分子,例如Bcl-2家族,糖原合酶激酶3(GSK3)和细胞周期蛋白G1,它们对细胞存活,细胞增殖和凋亡具有重要影响[18]。因此可以推测,LncRNA HULC可能通过PI3K/AKT信号通路调节Bcl-2/Bax蛋白及细胞周期蛋白G1的表达来影响GBM细胞的增殖及凋亡,相关通路及蛋白水平的研究有待进一步的验证。
综上所述,LncRNA HULC在体内、体外均有促进GBM生长的作用,后期我们将进一步探究该LncRNA与靶基因之间的分子机制,这将为发现新的生物标志物及GBM治疗靶点提供理论依据。
