响应面优化浊点萃取联合HILIC测定大鼠血清中四种抗艾滋病药
2020-02-22杨建霞赵秀丽王贞香
安 琼,杨建霞,赵秀丽,王贞香
(河西学院中西医结合研究所//甘肃省河西走廊特色资源利用省级重点实验室,甘肃张掖 734000)
更昔洛韦、司他夫定、拉米夫定和齐多夫定作为抗艾滋病常用药,是艾滋病“鸡尾酒”疗法[1-3]的主要组成药物,“鸡尾酒”疗法是由美籍华裔科学家何大一于1996年提出,是通过两种或两种以上的抗病毒药物联合使用来治疗艾滋病的方法。该疗法的应用可以减少药物单独使用而产生抗药性,最大限度地抑制病毒的复制,延长患者生命,提高患者生活质量。但由于鸡尾酒疗法是多种药物混合服用,多数对宿主细胞有一定的毒性,副作用的大小与患者具体服用的药物有关。因此,有必要监测抗艾滋病药的血药浓度,对降低毒副作用,制定个体化用药方案具有重要意义。目前文献报道,对于单个抗艾滋病药血药浓度的测定方法较多[4-5],但同时测定多个艾滋病药物的报道较少。在已报道的单个抗艾滋病药的血药浓度检测方法中,血样样品前处理(蛋白沉淀法[6]、氮气吹干法[7]、固相萃取[8]和液液萃取[9]等方法)步骤较复杂,分析时间较长,样品富集效果不理想。液相色谱—质谱法[10-13],虽然有较高的灵敏度,但仪器的价格较贵,不易普及。浊点萃取技术(cloud point extraction,CPE)是利用表面活性剂的浊点现象与增溶性达到富集待分离物质的一种新型液—液萃取技术[14]。它的原理是以表面活性剂胶束水溶液的溶解性和浊点现象为基础,通过改变实验参数(如:溶液的pH值、离子强度、温度、表面活性剂浓度等)引发相分离,从而达到疏水性物质与亲水性物质分离的目的,该法有机溶剂使用量少,萃取率较高、富集因子大、操作简便。本研究基于CPE,以Triton X-114作为萃取介质,以单因素法考察了Triton X-114浓度、平衡温度、平衡时间、PH、盐浓度等对更昔洛韦、齐多夫定、司他夫定、拉米夫定等四种抗艾滋病药萃取效率的影响。用响应面法进一步优化Triton X-114浓度、盐浓度与PH等浊点萃取相关参数。建立了以阿昔洛韦作为内标,同时测定对大鼠血清中更昔洛韦、齐多夫定、司他夫定和拉米夫定抗艾滋病药的亲水作用色谱法(hydrophilic interaction chromatography,HILIC)。
1 材料与方法
1.1 材 料
1.1.1 仪器 Agilent 1260高效液相色谱仪(美国安捷伦科技有限公司),紫外检测器,Ze month CN(250 mm×4.6 mm,5 μm)色谱柱,一个20 μL的手动进样阀,KH-3000DB数控型超声波清洗器(昆山禾创超声仪器有限公司),十万分之一天平(上海奥豪斯Discovery专业性分析天平),HH-4数显恒温水浴锅,(常州国华电器有限公司),80-2B低速台式离心机,(无锡市瑞江分析仪器有限公司),PH计(METLER TOLEDO),MIX-28漩涡混合器。
1.1.2 试剂乙腈(色谱纯,山东禹王试剂厂),甲醇(色谱纯,山东禹王试剂厂),醋酸铵(分析纯,莱阳市双双化工有限公司)、Triton X-114(Re⁃agent Grade,纯度98%),NaCl(分析纯,深圳市恒迪源润达实业有限公司),HCl(成都联禾化工医药有限责任公司),水为重蒸水。
对照品:阿昔洛韦(纯度HPLC ≥98%,批号Y31A6C2934),拉米夫定(纯度≥98%,批号J11M6F1)均购自上海源叶生物科技有限公司,更昔洛韦(纯度≥97.7%,批号100380-201103),齐多夫定(纯度≥97.7%,批号100672-200401)均购自中国食品药品检定研究院,司他夫定(纯度≥98%,批号100693-200601)。
司他夫定片(北京双鹭药业股份有限公司,批准文号:国药准字H20041993),更昔洛韦分散片(湖北东信药业有限公司,批准文号:国药准字H20110082),拉米夫定片(安徽贝克生物制药有限公司,批准文号:国药准字H20103618),齐多夫定片(东北制药集团沈阳第一制药有限公司,批准文号:国药准字H20020323)。
1.1.3 实验动物 SPF级Wistar雄性大鼠(200±20)g,来自甘肃省兽研所,动物编号SCXK(甘)2015-0001。饲养于甘肃中医药大学科研实验动物中心SPF级环境,实验动物所有操作取得了甘肃中医药大学实验动物伦理委员会批准(伦理审批号:2019-198)
1.2 方 法
1.2.1 溶液的制备 对照品溶液:精密称取更昔洛韦、司他夫定、齐多夫定、拉米夫定的对照品适量,配置成约500 μg/mL的溶液,作为标准溶液储备液,4 ℃的储存备用。内标溶液:精密称取内标物阿昔洛韦适量,配置成约500 μg/mL的溶液,作为内标溶液储备液,4 ℃的储存备用。标准样品的的制备:将特定浓度的标准品溶液溶解在200 μL大鼠血清中制备标准溶液,使标准样品中更昔洛韦、司他夫定、齐多夫定、拉米夫定的最终浓度分为0.01、0.1、1.0、2.5、5.0和10.0 μg/mL的标准血清样品,冷藏备用。质控样品的制备:通过溶解适当浓度的标准溶液到250 μL的大鼠血清中,获得质控样品。质控样品中更昔洛韦、司他夫定、齐多夫定、拉米夫定的浓度分别为0.025、2.5、8.0 μg/mL,将此样品均匀分成5份,储存在-20 ℃备用。
1.2.2 给药方案与样品采集 参照用药说明,按大鼠体质量(200±20)g换算剂量,对A组每只大鼠给予司他夫定片0.22 mg/d和拉米夫定片0.37 mg/d,B组大鼠给予齐多夫定片0.72 mg/4 h、拉米夫定片0.37 mg/d和更昔洛韦分散片3.67 mg/8 h,C组大鼠给予齐多夫定片0.72 mg/4 h和更昔洛韦分散片3.67 mg/8 h,D组给予司他夫定0.22 mg/d、拉米夫定片0.37 mg/d和齐多夫定片0.72 mg/4 h;每组动物连续给药3 d待血药浓度达到稳定时采样进行实验分析。参考文献报道[15-16]在半衰期附近取5个时间点(30 min、1、2、3、4 h)对大鼠进行眼眶采血,2 500 r/min(r=5 cm)离心获得血清样品,-25 ℃冷藏备用。
1.2.3 浊点萃取处理条件 取各实验组大鼠血清各200 μL,分别放入1.5 mL的离心管内,加入2 μL阿昔洛韦(内标溶液100 μg/mL)和400 μL浓度为5.0%的Triton X-114及20 μL氯化钠溶液(1 mol/L),调节pH为5.0,旋涡振荡混合5 min,40 ℃恒温水浴平衡20 min,3 500 r/min(r=5 cm)离心5 min,快速分离弃去上层水相。在下层胶束相,加入200 μL乙腈,涡旋混合3 min,3 000 r/min(r=5 cm)离心,取上清液经0.22 μm微孔滤膜滤过后,取20 μL续滤液作为待测样品注入HPLC仪进行测定。
1.2.4 HILIC法色谱条件 以Ze month CN(250 mm×4.6 mm,5 μm)为固定相,流动相组成:A为甲醇,B为乙腈,C为0.1%的乙酸铵水溶液;流动相比例为A:B:C=(5:5:90),流速0.5 mL/min,柱温35 ℃,检测波长275 nm。
1.2.5 数据分析 用orgin8.0绘图,用Design-Ex⁃pert8.05进行响应面分析。
2 结果
2.1 浊点萃取条件优化
2.1.1 TritonX-114浓度对浊点萃取的影响TritonX-114的浓度决定了萃取分离的效果、胶束相体积和富集倍率(富集倍率=浊点萃取前溶液体积/胶束相体积),在实验中考察了TritonX-114浓度(质量分数在1%~7%)对萃取率的影响,结果如图1所示,当浓度为5%时萃取效果最佳,浓度低于3%不能达到很好的分层,浓度高于6%胶束相体积较大,粘度高不利于测定。

图1 TritonX-114浓度对浊点萃取的影响Fig.1 Influence of tritonx-114 concentration on turbidity point extraction
2.1.2 离子强度对浊点萃取的影响 CPE体系中离子强度增加,可使浊点温度降低,表面活性剂的疏水性增强,从而加速CPE相的分离,提高萃取效率。实验中以NaCl作为盐,考察了不同浓度的(0.1、0.2、0.3、0.4和0.5 mol/L)NaCl对分析物萃取效率的影响,结果如图2所示,当体系中NaCl溶液浓度为0.3 mol/L时,体系分层最快,且萃取结果稳定,当浓度高于0.3 mol/L时表面活性剂的疏水性增加,胶束相体积减小,粘度增大,较难分层和分离。
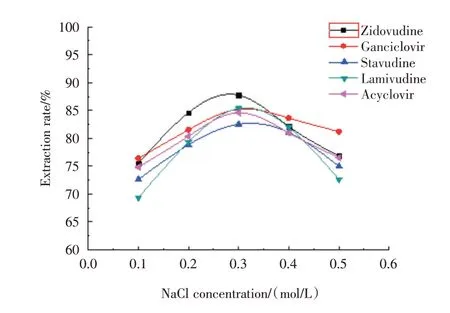
图2 NaCl浓度对浊点萃取的影响Fig.2 Influence of NaCl concentration on turbidity point extraction
2.1.3 pH对浊点萃取的影响 pH值可以改变药物的存在状态,药物以分子状态存在时,较容易分配到胶束相中,获得较好的萃取效率。在本研究中考察了不同的pH(3.0、4.0、5.0、6.0、7.0)对分析物萃取效果的影响,结果如图3所示,当体系PH为5.0时分层明、体系比较稳定、萃取效果较好,当pH大于5.0时,胶束处于溶液上层,样品出现浑浊,不利相的分离。

图3 PH对浊点萃取的影响Fig.3 Influence of PH on turbidity point extraction
2.1.4 平衡温度对浊点萃取的影响 对于非离子表面活性剂,温度对增溶量的影响与增溶质紧密相关;当温度升高时会使疏水基团疏水性增强,促进胶束的形成,尤其当温度升高至浊点温度时,胶束数量明显增多,体积增大,增溶量显著提高。此外,温度升高会使疏水基团脱水,导致胶束外壳变的紧密,极性增溶物的增溶能力下降。实验中考察了温度在20 ℃~50 ℃范围内对浊点萃取的影响,结果如图4,当温度在40 ℃时分析物萃取效果最佳;当平衡温度较表面活性剂浊点低时,两相系统难以形成;当温度过高时,胶束粘度过大,不利于分离。
2.1.5 平衡时间对浊点萃取的影响 平衡时间影响胶束集团形成的稳定性,平衡时间过短胶束结合不紧密,在后续操作中易遭到破坏,平衡时间过长则胶束分子结合紧密不利于目标萃取物的分离。实验中考察不同水浴平衡时间(10、15、20、25、30、35、40 min)对分析物浊点萃取效果的影响,结果显示在10~20 min时随着时间的增加浊点萃取效率增加,20 min时达到最好,当时间高于20 min则胶束相体积变小,萃取效率会随着平衡时间的延长而下降(图5)。

图4 平衡温度对浊点萃取的影响Fig.4 Influence of equilibrium temperature on turbidity point extraction

图5 平衡时间对浊点萃取的影响Fig.5 Influence of equilibrium time on turbidity point extraction
2.2 响应面分析
2.2.1 响应面因素选取 根据单因素实验的结果,采用响应面法进一步对萃取效率影响较大的因素,进一步优化。根据Box-Behnken的中心组合设计原理,以TritonX-114浓度(X1)、NaCl浓度(X2)和pH(X3)为自变量,以4种抗艾滋病药物总萃取率(T)为响应值设计了3因素3水平共17个实验点的响应面分析实验,水浴平衡温度为40 ℃,平衡时间为20 min;实验因素和水平的选取见表1。
2.2.2 响应面模型拟合与显著性分析 以TX-114浓度,NaCl浓度,PH为自变量,萃取率为因变量,进行Box-Behnken中心复合设计优化实验,实验共设计进行17组,设计结果见表2,其中实验序号由Design-Expert 8.05自动产生。
根据表2实验结果,应用SPSS 22统计分析软件,以评价指标为因变量分别将各因素作为自变量进行多项式回归拟合,建立响应曲面二次多元回归方程,对二项式方程中的各项系数进行t检验,删除P>0.1的项,以达到简化模型的目的,拟合模型如下:

表1 因素考察水平表Table 1 The factor evaluation level table

表2 Box-Behnken中心组合实验设计及结果Table 2 The design and results of Box-Behnken center combinatorial experiment
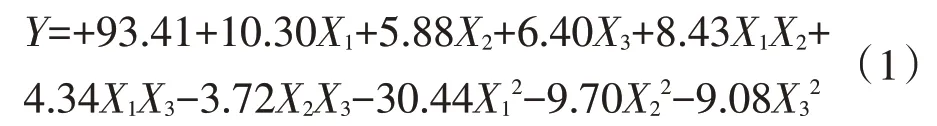
式中Y为预测萃取率(R2=0.9960,P>0.001),对结果进行显著性分析,分析结果见表3。
响应面模型分析结果中显示:该模型的F=191.97,P<0.0001,说明获得的回归方程极显著,即该模型在整个的回归区域内拟合的很好;模型的多元相关系数模型的多元相关系数R2=0.9960,说明模型的相关性较好,预测模型拟合程度高,能很好地预测实际的处理效果;模型校正决定系数=0.990 8,说明该模型可以解释99.08% 的响应值变化,实验误差小,数据合理;失拟项P=0.062 7 >0.05,失拟项不显著,说明方程拟合充分,回归方程高度显著,可以较好地描述各因素与响应值之间的真实关系[17]。
运用Origin 8.0软件根据上述回归方程模型绘制曲面响应效应图,得到对应的等高线图(图6,8,10)与曲面响应效应三维图形(图7,9,11)并根据响应结果进行分析。从三维曲面效应图可知,响应曲面为向内高度卷曲的凸面,曲面较陡峭,等高线图趋向于椭圆形且密集,说明TrionX-114,NaCl与pH对浊点萃取存在明显的交互影响作用,与方差分析结果保的预测保持一致。pH与TrionX-114的最适值均正,pH与NaCl抑制,在回归方程中AB和AC项系数为正,BC项系数为负号,TrionX-114、NaCl与pH对4种抗艾滋病药的萃取,做主要的贡献。根据模型分析预测,获得浊点萃取最佳条件为:TX-114浓度为5.23%,NaCl为0.32 mol/L,pH值为5.25。
2.3 HILIC色谱条件的优化
2.3.1 选择流动相的组成 在等度洗脱程序下,分别以甲醇-水,甲醇-水(0.01 mol/L乙酸铵),甲醇-水(0.05 mol/L乙酸铵),甲醇-水(0.10 mol/L乙酸铵),乙腈-水,甲醇-乙腈-水,分别作为流动相,实验结果表明用甲醇-乙腈-水做为流动进行洗脱时血清中4种药物可达到较好的分离,且不受血清成分的干扰。然后考察不同浓度乙酸铵对色谱峰的影响,实验结果如图12所示,用0.01 mol/L的乙酸铵时,色谱峰获得的峰形较好,再升高浓度对峰形影响不大,而高浓度的盐离子对色谱损害较大,因此选用低浓度的盐溶液进行洗脱。
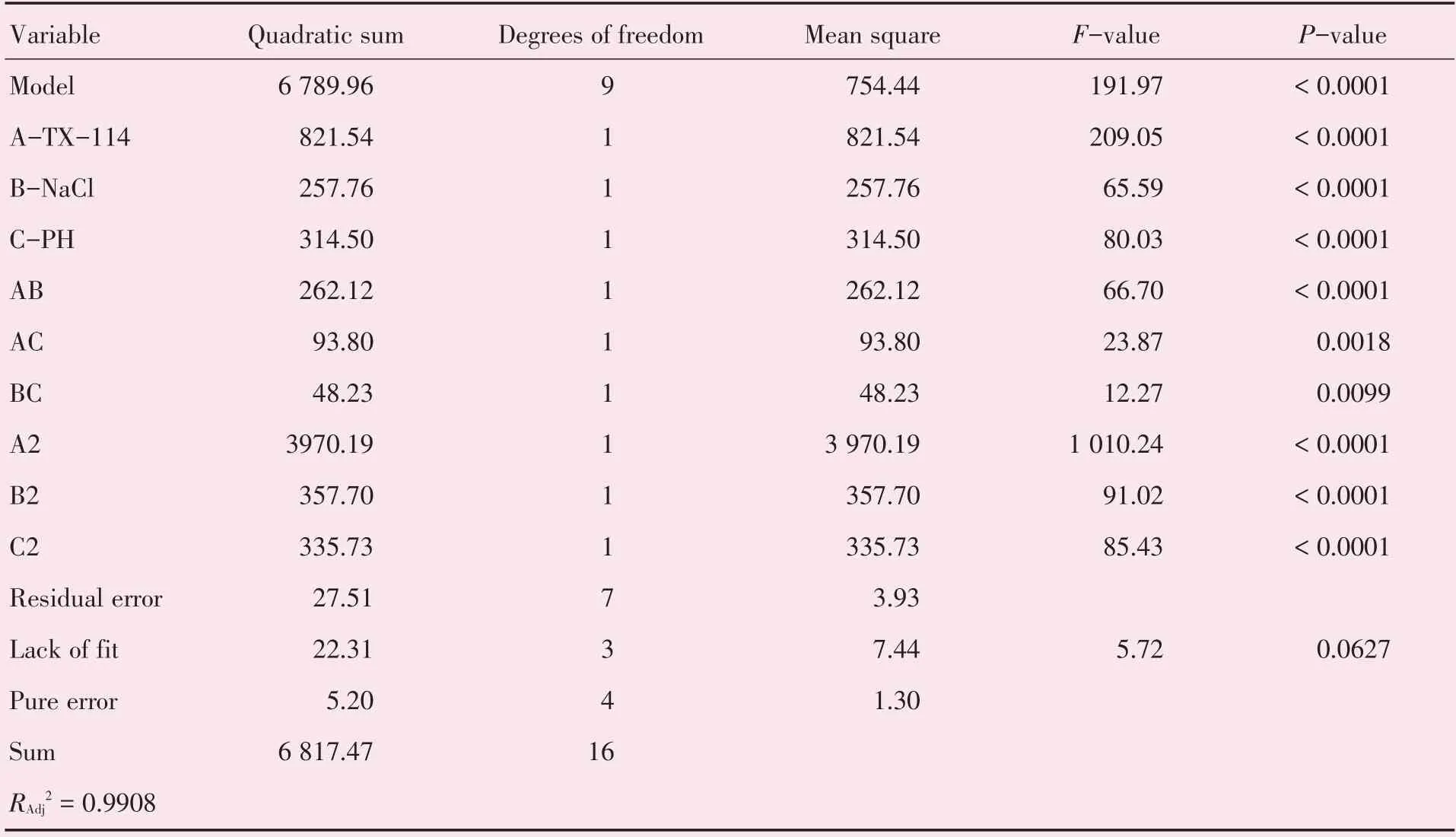
表3 显著性分析表Table 3 The significance analysis

图6 TX-114与NaCl浓度影响等高线效应图Fig.6 Contour effect diagram of TX-114 and NaCl concentration
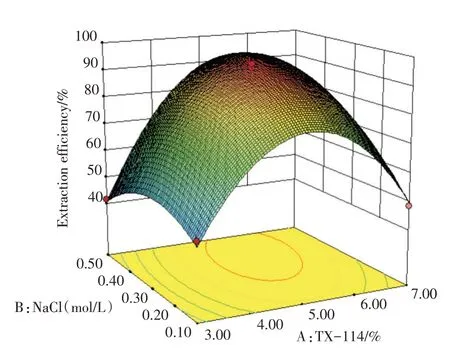
图7 TX-114与NaCl浓度影响三维曲面效应图Fig.7 Effects of TX-114 and NaCl concentration on 3d surface
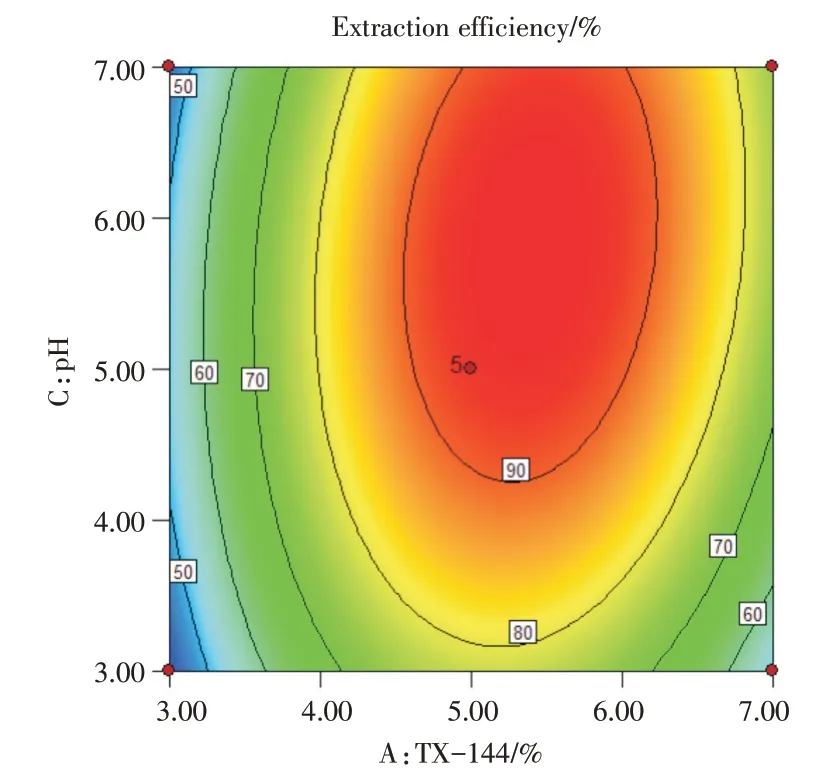
图8 pH与TX-114浓度影响等高线效应图Fig.8 Contour effect diagram of pH and TX-114 concentration

图9 pH与TX-114浓度影响三维曲面效应图Fig.9 Effect of pH and TX-114 concentration on 3d surface
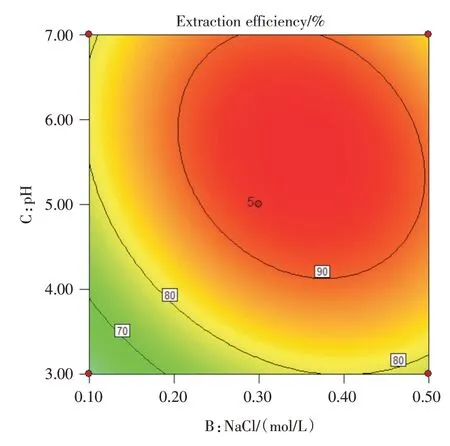
图10 pH与NaCl浓度影响等高线效应图Fig.10 Contour effect diagram of pH and NaCl concentration

图11 pH与NaCl浓度影响三维曲面效应图Fig.11 Influence of pH and NaCl concentration on 3d surface effect diagram
2.3.2 选择流动相比例 设置流动相甲醇-乙腈-水(0.01 mol/L乙酸铵)比例分别为:3∶3∶94;5∶3∶92;5∶5∶90;7∶7∶86;10∶10∶80,随着有机溶剂的增加化合物的保留时间缩短,当甲醇和乙腈浓度高于5%时,由于化合物保留时间缩短,性质相近的化合物色谱峰重叠,实验选择甲醇-乙腈-水(0.01 mol/L乙酸铵)比例为5∶5∶90为流动相洗脱条件(图13)。
2.3.3 流速对流速的选择,随着流速的增加(0.4、0.5、0.6、0.8和1.0 mL/min)分析时间缩短。但是,流速大于0.5 mL/min时血清对药物分析干扰较大保留时间相近的药物色谱峰会重叠;流速低于0.5 mL/min分析时间延长,因此,在本实验的过程中,以0.5 mL/min作为最佳流速。
2.3.4 柱温实验设置柱温在20 ℃、25 ℃、30 ℃、35 ℃、40 ℃的条件下分别进行实验,根据实验结果显示,随着温度的增加化合物的分离度增加,当温度达到30 ℃时,分离度最好,温度高于30 ℃,则血清干扰增加,不利于药物分离,且温度过高会造成化合物分解变性,不利于分析。
2.4 HILIC方法的验证
2.4.1 专属性 取空白血清样品和标准加入样品,按2.3项下萃取条件萃取,然后按2.4项下的色谱条件分析样品,结果如图14(空白血清和加标血清)所示,血清样品的基质不干扰分析物的测定。

图12 流动相组成优化结果Fig.12 The results of optimized mobile phase composition
2.4.2 线性关系及定量下限(LLOQ)精密量取更昔洛韦、司他夫定、拉米夫定、齐多夫定、阿昔洛韦对照品系列溶液10 μL,于1.5 mL离心管中加入血清至90 μL分别稀释成约0.01、0.1、1.0、2.5、5.0、10.0 μg/mL的溶液,按2.3项下样品萃取方法进行处理,在优化的色谱条件下分别测定分析物的色谱峰的峰面积,然后以标准对照品溶液的浓度X为自变量,标准品的峰面积和内标色谱峰的峰面积Y为因变量,拟合线性回归方程。将标准曲线项下的溶液稀释,当N/S≥5时,计算LLOQ。4种分析物的定量下限为0.01 μg/mL,表明4种分析物在浓度0.01~10.0 μg/mL线性良好(表4)。
2.4.3 稳定性 取储存在-20 ℃下的高、中、低浓度的质控样品,分别在0、5、10 d进样分析,记录分析物各自的的峰面积,计算RSD。结果分析物在高、中、低浓度下的峰面积的RSD分别为3.8%、1.6%、2.2%,结果显示样品在-20 ℃冷藏10 d是稳定的。
2.4.4 精密度 取质控样品的溶液(浓度为0.025、2.5、8.0 μg/mL),每个浓度的溶液5份。在优化的色谱条件下,1 d内对该样品连续进样5次,每次进样10 μL,测定4种分析物色谱峰的峰面积,计算日内精密度(RSD)小于3.5%;在连续5 d内每天进样分析,测定4种分析物色谱峰的峰面积,测定日间精密度,计算RSD小于5.0%,该方法精密度良好(表5)。

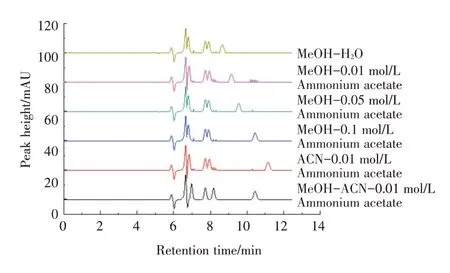
图13 流动相比例优化结果Fig.13 The results of mobile phase proportional optimization
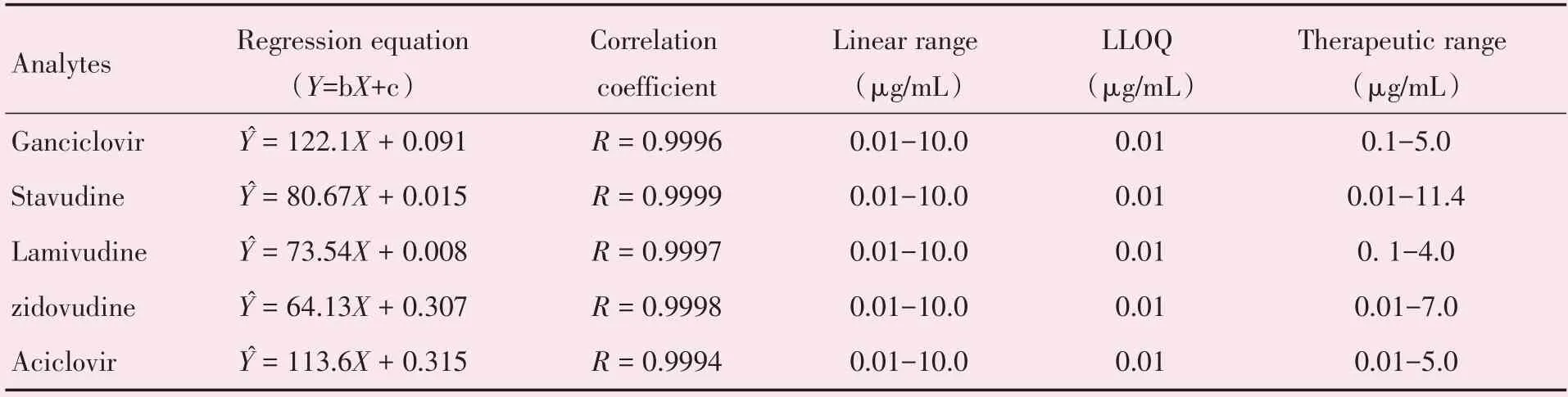
表4 分析物的标准曲线、线性范围、检出限、治疗范围Table 4 The results of linearity,LLOQ and therapeutic range of drugs in human serum

表5 日间精密度、日内精密度和平均回收率Table 5 Intra-day precision,inter-day precision and extraction recovery
2.4.5 提取回收率 使用内标加入法考察目标分析物的提取回收率,计算方程为:R为提取回收率,RS血清样品处理之前分析物色谱峰的峰面积,Ri血清样品处理之前内标物色谱峰的峰面积,ri血清样品处理之后内标物色谱峰的峰面积,rs血清样品处理之后加入待测物色谱峰的峰面积。通过测定3个不同浓度(0.025、2.5、8.0 μg/mL)的血清样品的水平评价浊点萃取萃取法的提取回收率,每个浓度重复进样5次。结果见表5,4种分析物的提取回收率大于75%。
2.5 大鼠血清样品的分析
根据给药方案,对大鼠给药,取血清200 μL加入内标,按2.3项下萃取条件萃取,然后按2.4项下的色谱条件分析样品,测得血药浓度见表6,色谱图见图15。
3 讨论
本文首次将浊点萃取技术与亲水作用色谱法联用,用于抗艾滋病药物血清样品的分离分析,浊点萃取技术的优点在于可以对目标物质进行富集应用于血清样品的前处理,可以大大降低血样中微量物质的监测分析难度;应用响应面法对浊点萃取条件进行优化,在最佳的萃取条件下,对大鼠血清中的目标化合物更昔洛韦、司他夫定、拉米夫定和齐多夫定等药物有较好的富集作用。构建的亲水作用色谱法可同时分析测定大鼠血清中的4种抗艾滋病药。该方法简化了血液样本的前处理过程,萃取效率高,能够达到较好的分离效果,操作简单,可为抗艾滋病药物的血药浓度监测与分析提供新的技术支持。
表6 不同时间大鼠血清分析物的含量Table 6 Contents of serμm analytes in rats at different time

表6 不同时间大鼠血清分析物的含量Table 6 Contents of serμm analytes in rats at different time
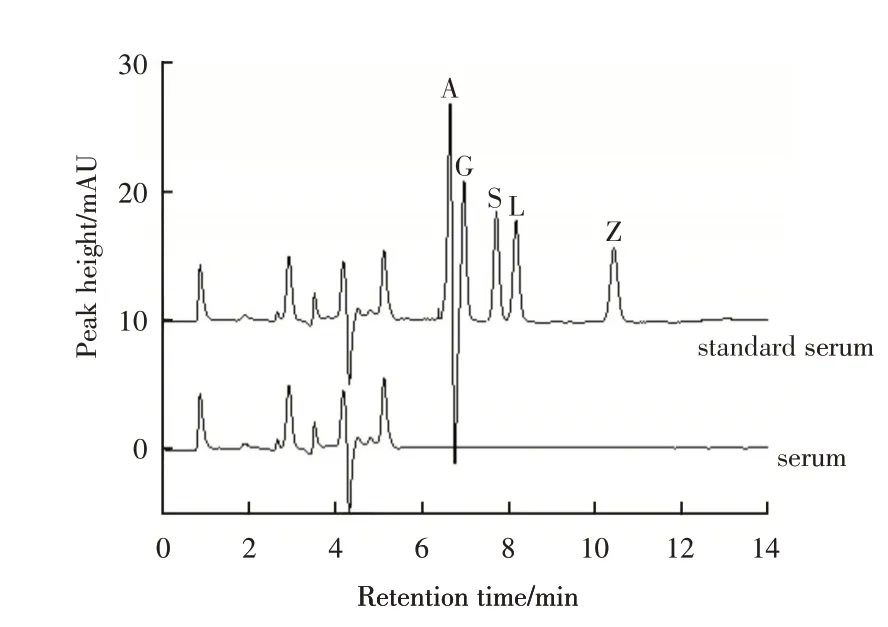
图14 血清和加标血清亲水作用色谱图Fig.14 HILIC Chromatogram of blank serum and standard serum

图15 四种给药方案下血清样品亲水作用色谱图Fig.15 The chromatograms of real serum samples
