MiR-127-3p靶向MAPK4对葡萄膜黑色素瘤细胞增殖、凋亡、迁移和侵袭的影响
2020-02-22连红梅刘兴华吴书一刘萌萌
魏 丽,连红梅,刘 鹏,刘兴华,吴书一,刘萌萌
(1.郑州市第三人民医院病理科,2.郑州大学第三附属医院麻醉科室,3.郑州市第三人民医院中心实验室,河南 郑州 450000)
葡萄膜黑色素瘤(uveal melanoma,UM)是在眼睛的葡萄膜中产生的黑色素瘤,是成人中最常见的原发性眼内癌。多达50%的葡萄膜黑色素瘤通过血液流动扩散到内脏器官并导致患者死亡[1]。葡萄膜黑色素瘤经手术切除后,仍然有50%的患者在15年内死亡,预后较差[2]。进一步探讨葡萄膜黑色素瘤新的预后因素和临床治疗目标,有助于该病的诊治。葡萄膜黑色素瘤生长和转移受特异性调节剂miRNA的动态相互作用调控,其异常表达与葡萄膜黑色素瘤发生和抑制有关[3]。如,miR-155通过调节NDFIP1表达促进葡萄膜黑色素瘤细胞增殖和侵袭[4],miR-224-5p通过靶向PIK3R3/AKT3抑制葡萄膜黑色素瘤细胞增殖、迁移和侵袭[5]。越来越多的证据表明,miRNA的表达可以潜在地用作诊断和预后不同肿瘤的生物标志物。已有研究报道miR-127在人葡萄膜黑色素瘤细胞中低表达,可通过抑制细胞周期而抑制人葡萄膜黑色素瘤细胞的增殖[6-7],但是尚未确定miR-127对人葡萄膜黑色素瘤细胞的迁移和侵袭的作用。本文主要探讨miR-127-3p对葡萄膜黑色素瘤细胞增殖、凋亡、迁移和侵袭的影响,以期为葡萄膜黑色素瘤的诊断治疗提供参考数据。
1 材料与方法
1.1 主要试剂
DMEM培养基(上海善然生物科技有限公司,货号:SH3002.01B),胎牛血清、青霉素和链霉素双抗溶液(上海素尔生物科技有限公司,货号:16000-044、15140122),SYBR-Green PCR试剂盒(赛默飞世尔科技公司,货号:4309155),cDNA逆转录试剂盒(上海捷瑞生物工程有限公司,货号:GK8030-20),Lipofectamine 2000转染试剂(上海恪敏生物科技有限公司,货号:11668-027),NCmimic、miR-127-3p mimic、pc-MAPK4质粒及各种引物由上海生工生物工程股份有限公司设计并合成,双荧光素酶报告基因检测试剂盒(北京原平皓生物技术有限公司,货号:GN201-01),CCK-8试剂盒(上海炎熙生物科技有限公司,货号:CT-K-5),Transwell小室(北京明阳科华科技有限公司,货号:3413),RIPA裂解缓冲液(南京海克尔生物科技有限公司,货号:SBJ-0999),BCA试剂盒(上海易色医疗科技有限公司,货号:BC201),GAPDH抗体、辣根过氧化物酶标记的二抗(上海艾博抗生物科技有限公司,货号:ab18602、ab6728),p-AKT抗体、AKT抗体、p-mTOR抗体、mTOR抗体(万类生物科技有限公司,货号:WLP001a、WLP003b、WL02476、WL02477)。
1.2 组织样品
从我院行葡萄膜黑色素瘤切除术的患者中获取组织。所有志愿者均签署了有关临床数据的书面知情同意书。该研究得到我院研究伦理委员会和临床医学学院的批准,并根据《赫尔辛基宣言》的道德准则进行。
1.3 细胞及培养
人葡萄膜黑色素瘤细胞系SP6.5、M23、OM431、MUM-2B、C918和OCM-1A和正常葡萄膜上皮细胞系ARPE-19均购自ATCC,于含100 ml/L胎牛血清、100 U/mL的青霉素和100 μg/mL的链霉素的DMEM培养基中,在37 ℃,体积分数5%CO2下培养。
1.4 RT-qPCR检 测miR-127-3p与MAPK4 mRNA的表达
将所有组织样品剪碎并研磨,采用QIAzol裂解试剂提取总RNA,采用cDNA逆转录试剂盒合成cDNA。对于细胞培养,将葡萄膜黑色素瘤细胞系SP6.5、M23、OM431、MUM-2B、C918和OCM-1A和正常葡萄膜上皮细胞系ARPE-19接种在6孔板中,当细胞达到近90%融合时,采用QIAzol裂解试剂提取总RNA,采用cDNA逆转录试剂盒合成cDNA。RT-qPCR采用SYBR-Green PCR试剂盒说明书操作进行。miR-127-3p的循环条件为:94 ℃20 s和60 ℃34 s的40个循环,用U6标准化。MAPK4的循环条件:95 ℃15 s和60 ℃1 min的40个循环,用GAPDH标准化。每个样品进行3次重复分析。使用2-ΔΔct方法计算。引物序列如下:miR-127-3p的上游引物序列:5′-TCCGTCT⁃GAG⁃CTTGGCTAAA-3′:miR-127-3p的下游引物序 列:5′-TCGGATCCGTCTGAGCTTGGCT-3′ ;MAPK4的上游引物序列:5′-CCGCTCGAGGA⁃CAACAAGCCGCACCACTACTC-3′,MAPK4的 下游引物序 列:5′-GGGTTTAAACGGTGCTGTGAT⁃GTGAGGGTGA⁃C-3′;GAPDH的上游引物序列:5′-GAGTCAACGGATTTGGTCGT-3′,GAPDH的下游引物序列:5′TTGATTTTGGAGG GATCTCG-3′。
1.5 细胞转染
取对数期细胞,接种于6孔板(1×106/孔)。当达到80% 融合,根据Lipofectamine 2000说明书将100 nmol/L的mimic-NC、miR-127-3p mimic、pc-MAPK4质粒分别或联合转染进入SP6.5或OM431细胞。
1.6 双荧光素酶报告检测靶向关系
收集生长至对数期的SP6.5或OM431细胞接种在24孔板中,并孵育24 h。将1 μg萤火虫荧光素酶报告基因构建体PGL3-MAPK4-WT(MAPK4野生型)或PGL3-MAPK4-MUT(MAPK4突变型)以及miR-127-3p mimic或mimic-NC和PRL-CMV海藻荧光素酶报告质粒转染细胞,转染48 h后,SP6.5或OM431细胞裂解15 min,双荧光素酶检测系统测量荧光素酶的相对活性,用萤火虫荧光素酶活性和肾荧光素酶活性比值表示荧光素酶的相对活性。
1.7 CCK-8法检测细胞增殖
将各组细胞消化成单细胞悬液,每孔200 μL接种96孔板(2000/孔)。经培养0、24、48、72、96 h后,每孔加入20 μL CCK-8溶液,用酶标仪检测隔空在450 nm处的吸光值(OD450),绘制细胞增殖曲线。
1.8 流式细胞术检测细胞凋亡
培养48 h后,胰酶消化转染细胞,离心,按1×106个细胞/mL的浓度重悬。细胞悬液中加入5 μL Annexin-V-FITC和5 μLPI,在黑暗的房间里孵化15 min,然后用流式细胞仪分析细胞凋亡情况。
1.9 划痕实验检测细胞迁移能力
转染后,将SP6.5或OM431细胞以1×106细胞/孔的密度接种在6孔板中,铺满单层后,用小号枪头垂直在孔中间划痕。在体积分数5%CO2、37 ℃恒温的培养箱培养24 h后。在划痕0 h和24 h拍摄的图像,使用ImageJ评估细胞迁移能力。划痕闭合率(%)=(0 h时的划痕面积-24 h时的划痕面积)/0 h的划痕面积×100%。
1.10 Transwell法检测细胞侵袭能力
转染后,将200 μL无血清DMEM中的SP6.5或OM431细胞接种到Matrigel包被的Transwell小室上室中。在Transwell小室下室加入含血清和丝裂霉素C的培养基,培养48 h后,取出Transwell小室下室。用40 g/L多聚甲醛固定,并用结晶紫染色,在显微镜下观察分析,并在5个随机视野中对细胞进行计数,侵入细胞数表示为每视野的平均细胞数。
1.11 蛋白印迹法检测AKT/mTOR通路蛋白相对表达水平
收集各组SP6.5或OM431细胞,用RIPA裂解液提取总蛋白,并用BCA试剂盒检测蛋白浓度,然后经SDS-PAGE分离蛋白后,用半干转膜仪转移蛋白质至PVDF膜,并用脱脂牛奶室温封闭蛋白2 h,再加入兔来源的单克隆一抗(p-AKT 1∶1 000、AKT 1∶1 000、p-mTOR 1∶500、Mtor 1∶500、GAP⁃DH 1∶1 000)在4 ℃封闭过夜,接着加入对应山羊抗兔二抗(1∶2 000)室温封闭1 h,最后滴ECL曝光,以GAPDH为内参,使用Quantity One软件进行分析目标蛋白质的相对表达水平。
1.12 统计学分析
所有统计数据采用SPSS 21.0处理,图形使用GraphPad Prism 6.0构建的。呈正态分布的计量资料以均数±标准差表示,各组数据均呈正态分布,方差齐性时,多组计量资料均数的比较采用单因素方差分析(one-way ANOVA),方差分析有统计学意义时,采用LSD-t法进行两两比较。检验水准α=0.05(双侧),P<0.05为差异有统计学意义。
2 结果
2.1 MiR-127-3p在葡萄膜黑色素瘤组织和细胞系中下调,而MAPK4上调
通过RT-qPCR评估miR-127-3p和MAPK4在人葡萄膜黑色素瘤组织及细胞系SP6.5、M23、OM431、MUM-2B、C918和OCM-1A和正常葡萄膜上皮组织及细胞系ARPE-19中的表达表明:与邻近的正常组织相比,miR-127-3p在人葡萄膜黑色素瘤组织中明显下调(P<0.01;图1A),而MAPK4明显上调(P<0.01;图1B);miR-127-3p的表达与MAPK4的表达在人葡萄膜黑色素瘤组织中呈负相关(图1C);与正常葡萄膜上皮细胞系ARPE-19相比,在人葡萄膜黑色素瘤组织及细胞系SP6.5、M23、OM431、MUM-2B、C918和OCM-1A中miR-127-3p明显下调(P<0.01;图1D),而MAPK4明显上调(P<0.01;图1E);并选择下调效果比较明显的SP6.5和OM431细胞系进行后续实验。

图1 葡萄膜黑色素瘤中miR-127-3p和MAPK4 mRNA表达情况Fig.1 The expression of miR-127-3p and MAPK4 mRNA in uveal melanoma
2.2 MiR-127-3p靶向下调MAPK4
通过TargetScan数据库的预测,miR-127-3p与MAPK4 3′UTR区存在结合位点(图2A)。并通过双荧光素酶报告基因实验验证靶向关系,结果表明:miR-127-3p高表达明显抑制了含有野生型MAPK4质粒的荧光素酶活性(P<0.01;图2B),但对突变型MAPK4质粒的荧光素酶活性无影响。通过蛋白印迹法检测各组SP6.5细胞和OM431细胞中MAPK4蛋白的表达:与Control组相比,miR-127-3p mimic组SP6.5细胞和OM431细胞中MAPK4蛋白表达均明显下调(P<0.01;图2C,D),pc-MAPK4组SP6.5细胞和OM431细胞中MAPK4蛋白表达均明显上调(P<0.01;图2C,D);与miR-127-3p mimic组相比,miR-127-3p +pc-MAPK4组SP6.5细 胞和OM431细胞中MAPK4蛋白的表达均明显上调(P<0.01;图2C,D),表明转染成功,且miR-127-3p靶向下调MAPK4。

图2 MiR-127-3p靶向下调MAPK4Fig.2 MiR-127-3p targeted down-regulation of MAPK4
2.3 MiR-127-3p靶向MAPK4抑制葡萄膜黑色素瘤细胞增殖、诱导凋亡
通 过CCK-8检测各组SP6.5细胞和OM431细胞增殖情况表明:随着时间的增长,各组之间的差异逐渐增大;与Control组相比,miR-127-3p mimic组SP6.5细胞和OM431细胞增殖均明显下降(P<0.01;图3A,B),pc-MAPK4组SP6.5细胞和OM431细胞增殖均明显升高(P<0.01;图3A,B);与miR-127-3p mimic组相比,miR-127-3p+pc-MAPK4组SP6.5细胞和OM431细胞增殖均明显升高(P<0.01;图3A,B),表明miR-127-3p靶向MAPK4抑制葡萄膜黑色素瘤细胞增殖。通过流式检测各组SP6.5细胞和OM431细胞凋亡情况显示:与Control组相比,miR-127-3p mimic组SP6.5细胞和OM431细胞凋亡率均明显增加(P<0.01;图3C,D),pc-MAPK4组SP6.5细胞和OM431细胞凋亡率均明显减少(P<0.01;图3C,D);与miR-127-3p mimic组相比,miR-127-3p+pc-MAPK4组SP6.5细胞和OM431细胞凋亡率均明显减少(P<0.01;图3C,D),表明miR-127-3p靶向MAPK4诱导葡萄膜黑色素瘤细胞凋亡。

图3 miR-127-3p靶向MAPK4抑制葡萄膜黑色素瘤细胞增殖、诱导凋亡Fig.3 miR-127-3p inhibits proliferation and induces apoptosis of uveal melanoma cells by targeting MAPK4
2.4 MiR-127-3p靶向MAPK4抑制葡萄膜黑色素瘤细胞迁移和侵袭
通过划痕实验检测各组SP6.5细胞和OM431细胞迁移能力发现:与Control组相比,miR-127-3p mimic组SP6.5细胞和OM431细胞划痕闭合率均明显降低(P<0.01;图4A,B),pc-MAPK4组SP6.5细胞和OM431细胞划痕闭合率均明显升高(P<0.01;图4A,B);与miR-127-3p mimic组相比,miR-127-3p+pc-MAPK4组SP6.5细胞和OM431细胞划痕闭合率均明显升高(P<0.01;图4A,B),表明miR-127-3p靶向MAPK4抑制葡萄膜黑色素瘤细胞迁移。通过Transwell法检测各组SP6.5细胞和OM431细胞侵袭能力显示:与Control组相比,miR-127-3p mimic组SP6.5细胞和OM431细胞每视野侵袭细胞数目均明显减少(P<0.01;图4C,D),pc-MAPK4组SP6.5细胞和OM431细胞每视野侵袭细胞数目均明显增加(P<0.01;图4C,D);与miR-127-3p mimic组相比,miR-127-3p +pc-MAPK4组SP6.5细胞和OM431细胞每视野侵袭细胞数目均明显增加(P<0.01;图4C,D),表明miR-127-3p靶向MAPK4抑制葡萄膜黑色素瘤细胞侵袭。
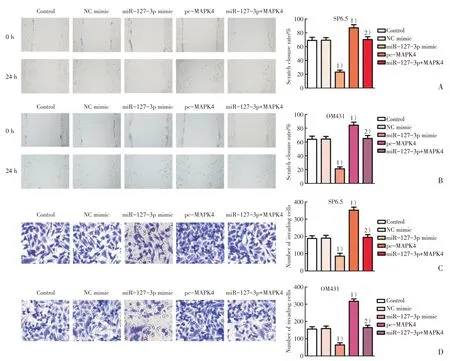
图4 miR-127-3p靶向MAPK4抑制葡萄膜黑色素瘤细胞迁移和侵袭Fig.4 miR-127-3p inhibits migration and invasion of uveal melanoma cells by targeting MAPK4
2.5 MiR-127-3p靶向MAPK4可能抑制葡萄膜黑色素瘤细胞AKT/mTOR通路激活
已知MAPK4过表达通过AKT/mTOR信号的激活促进肿瘤进展[8],本文对AKT/mTOR信号通路进行研究。通过蛋白印迹法检测各组SP6.5细胞和OM431细胞中AKT/mTOR通路蛋白的表达发现:与Control组相比,miR-127-3p mimic组SP6.5细胞和OM431细胞中p-AKT(T308)/AKT、p-mTORr(S473)/mTOR蛋白表达均明显下调(P<0.01;图5A,B),pc-MAPK4组SP6.5细胞和OM431细胞中p-AKT(T308)/AKT、p-mTOR(S473)/mTOR蛋白表达均明显上调(P<0.01;图5A,B);与miR-127-3p mimic组相比,miR-127-3p+pc-MAPK4组SP6.5细胞和OM431细胞中p-AKT(T308)/AKT、p-mTOR(S473)/mTOR蛋白的表达均明显上调(P<0.01;图5A,B),表明miR-127-3p靶向MAPK4可能抑制葡萄膜黑色素瘤细胞AKT/mTOR通路激活。
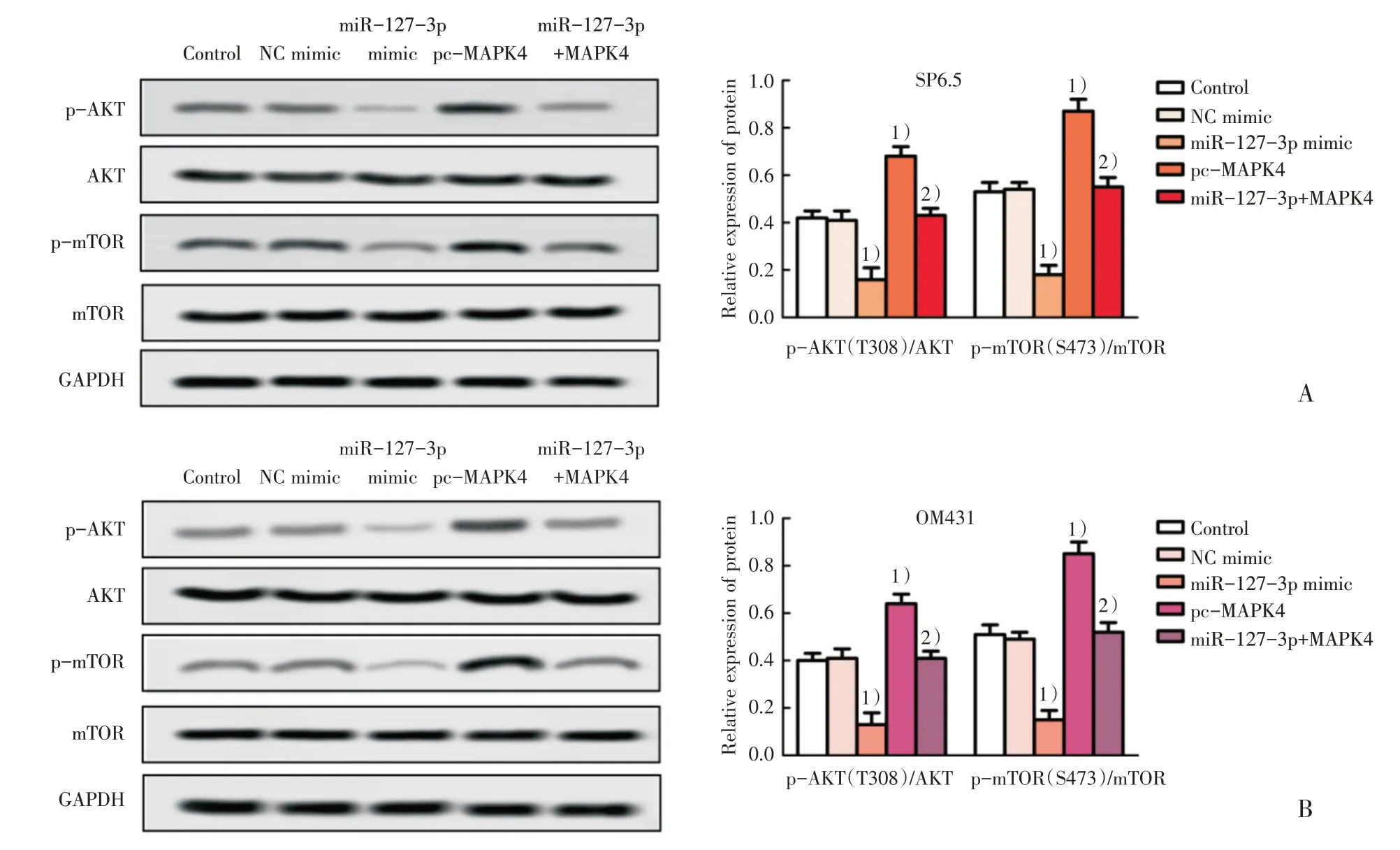
图5 通过蛋白印迹法检测各组SP6.5细胞和OM431细胞中AKT/mTOR通路蛋白的表达水平Fig.5 The expression levels of AKT/mTOR pathway proteins in SP6.5 cells and OM431 cells were detected by Western blotting
3 讨论
葡萄膜黑色素瘤是成年人眼内最常见的恶性肿瘤,多发生于40~50岁中年人,一般为单眼发病,肿瘤呈单灶性,无遗传性[9]。一般起源于葡萄膜基质内的黑色素细胞,瘤体呈深黑色,可向表面轻度隆起[10]。瘤细胞体积较大,呈梭形或多边形,其内含有大量粗大的黑色素颗粒,核为圆形、较小,有些瘤体周边部可见少量小梭形黑色素性瘤细胞[11]。葡萄膜黑色素瘤主要经血行转移至眼外器官或组织,再转移至肝脏最常见,其次为肺、胃肠道、皮肤及中枢神经系统或骨骼等部位,发生全身转移的患者平均存活时间小于7个月[12]。因此,急需探讨新的葡萄膜黑色素瘤治疗方法。
MiRNA通过调节参与细胞增殖,迁移和侵袭的基因,在癌症的发病机制中起着至关重要的作用[13-14]。MiRNA的失调在癌症中很常见,其中miRNA可能充当癌基因或肿瘤抑制基因。已有研究报道miR-127在人葡萄膜黑色素瘤细胞表达下调,其过表达可抑制人葡萄膜黑色素瘤细胞的增殖[6-7],但是尚未确定miR-127对人葡萄膜黑色素瘤细胞的迁移和侵袭的作用。但迁移和侵袭是葡萄膜黑色素瘤致死的主要原因。即使在诊断时98%的葡萄膜黑色素瘤患者并没有转移扩散的迹象,但仍有大约50%的患者会发展成转移性疾病,且这是迄今为止无法治愈的。本研究发现,miR-127-3p抑制葡萄膜黑色素瘤细胞增殖、迁移和侵袭,并诱导细胞凋亡,miR-127-3p在抑制葡萄膜黑色素瘤的发生和发展中具有重要作用。
同颜洋等[15]的研究miR-127-3p通过下调靶基因MAPK4抑制神经胶质瘤增殖的机制研究相类似,本文研究还发现miR-127-3p对葡萄膜黑色素瘤细胞增殖、凋亡、迁移和侵袭的作用是通过靶向调控MAPK4来实现的。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)是一组可被细胞因子、神经递质、激素、细胞应激及细胞黏附等激活的丝氨酸-苏氨酸蛋白激酶,对细胞的生长、发育和分化等生物学功能发挥重要调控作用[16]。MAPK4作为MAPK家族成员之一,在包括低度神经胶质瘤、胶质母细胞瘤、皮肤黑色素瘤、肾上腺皮质癌、肺腺癌、肺鳞状细胞癌、乳腺浸润癌、甲状腺癌、和膀胱尿路上皮癌等不同类型的癌症中均观察到MAPK4的过度表达,表明MAPK4是一种致癌基因,能够促进肿瘤的生长[17]。本文发现,miR-127-3p过表达可靶向下调MAPK4,从而抑制葡萄膜黑色素瘤细胞增殖、迁移和侵袭,并诱导细胞凋亡。
AKT/mTOR信号通路对于调节细胞存活、增殖和代谢至关重要,其在癌症的发展过程中也起着非常重要的作用。如,肿瘤微环境通过Akt/mTOR通路促进前列腺癌细胞扩散[18],五味子乙素通过抑制PI3K/Akt/mTOR通路诱导鼻咽癌细胞凋亡[19]。本研究发现,miR-127-3p靶向MAPK4可能抑制葡萄膜黑色素瘤细胞AKT/mTOR通路激活。在AKT激活的经典途径中,磷脂酰肌醇-3-羟激酶(phosphatidylinositol 3-hydroxykinase,PI3K)催化磷脂酰肌醇-3,4,5-三磷酸的产生,该蛋白与AKT的同源性结构域结合,从而将AKT募集到质膜上并激活[20]。AKT的完全激活需要在重组人丙酮酸脱氢酶激酶同工酶激活环的Thr308(T308)处进行AKT的磷酸化和在疏水环中进行Ser473(S473)的磷酸化[21]。mTOR有2个不同的复合物(mTORC1和mTORC2)中,它们与AKT协同作用[22]。AKT激活mTORC1,这是整合细胞外刺激和营养信号调节细胞生长和代谢的重要枢纽,而mTORC2是主要的AKT S473激酶[23]。但MAPK4通过不依赖于PI3K/PDK1的替代途径直接特异性激活AKT/mTOR。由于MAPK4上含有D254的片段和AKT1上含有K386的片段提供了配对的静电相互作用,所以MAPK4在T308处直接结合并磷酸化AKT,并在S473处激活mTORC2磷酸化AKT来进行完全激活[17]。因次,miR-127-3p靶向MAPK4可能通过不依赖于PI3K/PDK1的替代途径直接特异性抑制AKT/mTOR通路激活。
综上所述,miR-127-3p在人葡萄膜黑色素瘤中低表达,并可通过靶向下调MAPK4来抑制葡萄膜黑色素瘤细胞增殖、迁移和侵袭,诱导细胞凋亡,这可能与抑制AKT/mTOR通路激活有关。miR-127-3p和MAPK4均有望成为葡萄膜黑色素瘤诊断的潜在生物靶标。本文仅进行了细胞实验,动物体内实验还有待进一步研究。
