大山楂颗粒的质量标准研究
2020-02-22杜成兴刘明旭潘年琼冯发进霍昕杨迺嘉
杜成兴 刘明旭 潘年琼 冯发进 霍昕 杨迺嘉
(1.贵州省生物技术研究开发基地,贵州贵阳 550002;2.贵州省科晖制药厂,贵州清镇 551400)
大山楂颗粒由山楂、六神曲、炒麦芽三味中药组成,是根据2020年版《中国药典》中的大山楂丸[1]处方改剂而成。大山楂颗粒的制剂方法与大山楂丸不同,大山楂丸是直接将药材粉碎成细粉加入辅料制得的,大山楂颗粒是将药材通过水煮后浓缩成浸膏再加入辅料制得的。丸剂释药缓慢,可延长药效、降低毒性和刺激性,减少不良反应,适用于慢性病治疗或病后调和气血,但对于老人小孩及吞咽困难的人群来说不易服用;颗粒剂具有易溶解、易吸收、口感好的优点,更适合老人小孩及吞咽困难的人群服用[2-3]。处方中,山楂有降血压、调血脂的作用,同时可保护肝脏,具有强心、抗氧化、提高免疫力的作用[4-5]。六神曲能够消食化积、健脾和胃[6-8]。炒麦芽能行气消食回乳,具有助消化、降血糖、抗真菌、抑制催乳素释入等作用[9-10]。
在2020年版《中国药典》中,大山楂丸是采用薄层色谱法检测熊果酸的含量来测定的,但薄层色谱法存在一些缺陷,如受铺板质量、点样技术、展开条件、显色效果等因素的影响,使测定结果误差较大。高效液相色谱法比薄层色谱法更灵敏、简单、快速、准确,且精密度好,能更好地控制药物的质量。熊果酸是脂溶性成分,大山楂颗粒是山楂、六神曲、炒麦芽的水煎煮液浓缩成浸膏制备而成,经HPLC含量测定发现浸膏中熊果酸含量较低,而原儿茶酸的含量较高,且金丝桃苷、芦丁、牡荆素等均不能鉴别出来,故选择原儿茶酸作为指标成分进行检测[11-14]。本研究采用高效液相色谱法对原儿茶酸进行含量测定,以期建立大山楂颗粒的质量标准[15],为大山楂颗粒的进一步开发利用提供参考。
1.仪器和材料
1.1 仪器
JJ20000B型电子天平(常熟市双杰测试仪器厂),AUW120D型电子天平(岛津仪器苏州有限公司),AL204型电子天平(梅特勒—托利多仪器有限公司),ZF-90型多功能暗箱式紫外投射仪(上海山顾村电光仪器厂),Ultimate 3000高效液相色谱仪(美国赛默飞公司),SPD-16C 高效液相色谱仪(岛津仪器苏州有限公司),GZX-9140MBE电热鼓风干燥箱(上海博讯实业有限公司医疗设备厂)。其他仪器均由贵州省生物技术研究开发基地提供。
1.2 材料
熊果酸对照品(批号:110742-200314)、原儿茶酸对照品(批号:110809-201205)、金丝桃苷对照品(批号:111521-201809)、芦丁对照品(批号:100080-201610)、牡荆素对照品(批号:11687-201704)、山楂对照药材(批号:121138-201606)均采购于中国食品药品检定研究院。大山楂颗粒样品、药材及试剂由贵州省生物技术研究开发基地提供。
2.方法和结果
2.1 大山楂颗粒的TLC定性鉴别
取大山楂颗粒研细,称取3g,加入50%乙醇2ml润湿,再加入乙酸乙酯10ml,超声30min,过滤,滤液挥干,加入乙酸乙酯1ml溶解,得供试品溶液;取山楂对照药材3g,同法制得山楂对照药材溶液;取缺山楂阴性样品研细,称取3g,同法制得缺山楂阴性样品溶液。吸取上述三种溶液各5μL,分别点于同一聚酰胺薄膜板上,以乙酸乙酯—环己烷—甲酸(10:3:1)为展开剂,展开,取出晾干,喷以0.1%溴甲酚绿(溴甲酚绿0.1g,溶于100ml乙醇中,加1%NaOH溶液至蓝色即可),吹至斑点清晰,结果见图1。TLC图谱显示,大山楂颗粒在与山楂对照药材相应位置上显相同颜色的斑点,且显色斑点清晰,阴性无干扰。
取15批大山楂颗粒研细,各称取3g,同法测定,结果见图2。结果表明,十五批大山楂颗粒供试品在与山楂对照药材相应的位置上,显相同的黄色斑点,且斑点清晰,阴性无干扰。

图1 山楂TLC色谱图
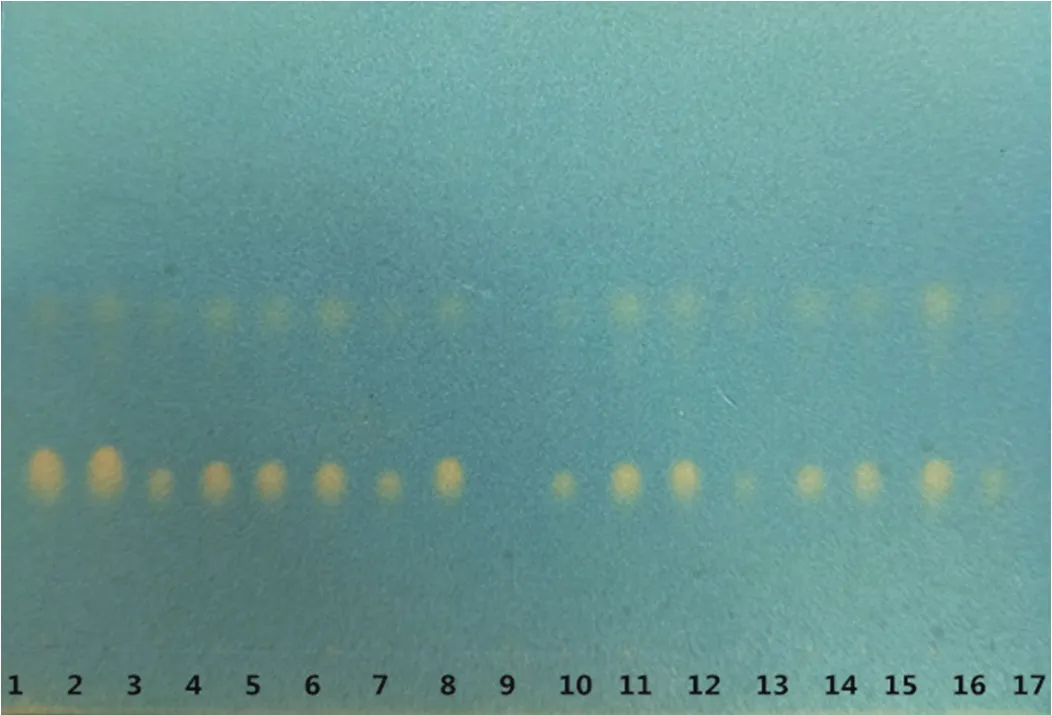
图2 十五批大山楂颗粒的TLC色谱图
2.2 高效液相色谱法
2.2.1 色谱适应性条件
依利特C18色谱柱(250mm×4.6mm,5μm);流动相为乙腈-1%醋酸水(5:95);流速0.9ml/min;检测波长260nm;柱温30℃;进样量10μL。结果表明,在此色谱条件下,原儿茶酸峰形较好,约9min左右出峰,理论塔板数高于3000。
2.2.2 样品制备方法
取大山楂颗粒磨成细粉,称取样品1.0g,置于具塞锥形瓶中,加入0.1mol/L盐酸2ml润湿,再加入20ml甲醇-1%醋酸水(7:3),超声提取30min,过滤,加甲醇-1%醋酸水(7:3)定容到25ml,得样品溶液。
2.2.3 对照品制备方法
精密称取原儿茶酸对照品9.82mg,置于10ml容量瓶中,加入甲醇-1%醋酸水(7:3)溶液定容至刻度线;再从中精密量取1ml于50ml容量瓶中,加入甲醇-1%醋酸水(7:3)溶液定容至刻度线,得到原儿茶酸对照品溶液(19.64μg/ml)。
2.2.4 指标性成分筛选实验
按上述色谱条件对大山楂颗粒中原儿茶酸进行检测,结果见图3。结果表明在大山楂颗粒中检出原儿茶酸,但在炒麦芽药材中没有检测出,故选择原儿茶酸作为指标性成分。
2.2.5 方法学考察
(1)线性关系。精密配制6种浓度的原儿茶酸对照品溶液:2.455μg/ml、4.91μg/ml、9.82μg/ml、19.64μg/ml、39.28μg/ml、78.56μg/ml,分别进样 10μL,以原儿茶酸浓度为X轴,峰面积为Y轴,得线性回归方程。结果表明,线性回归方程为y=42756x+16583(r=0.9999),原儿茶酸在2.455μg/mL~78.56μg/mL范围内呈现良好的线性关系。
(2)精密度实验。按2.2.1项下色谱条件,取同一浓度的原儿茶酸对照品溶液(19.64μg/ml),进样6次,每次10μL,以原儿茶酸对照品溶液(19.64μg/ml)为参照,计算样品中原儿茶酸的含量。结果显示,RSD=0.78%,符合中国药典要求(RSD<2%),表明HPLC仪器精密性良好。
(3)中间精密度实。按2.2.1项下色谱条件,取同一浓度的原儿茶酸对照品溶液(19.64μg/ml),进样6次,每次10μL,以原儿茶酸对照品溶液(19.64μg/ml)为参照,计算样品中原儿茶酸的含量。结果显示RSD=1.06%,符合《中国药典》要求(RSD<2%),表明中间精密度良好。
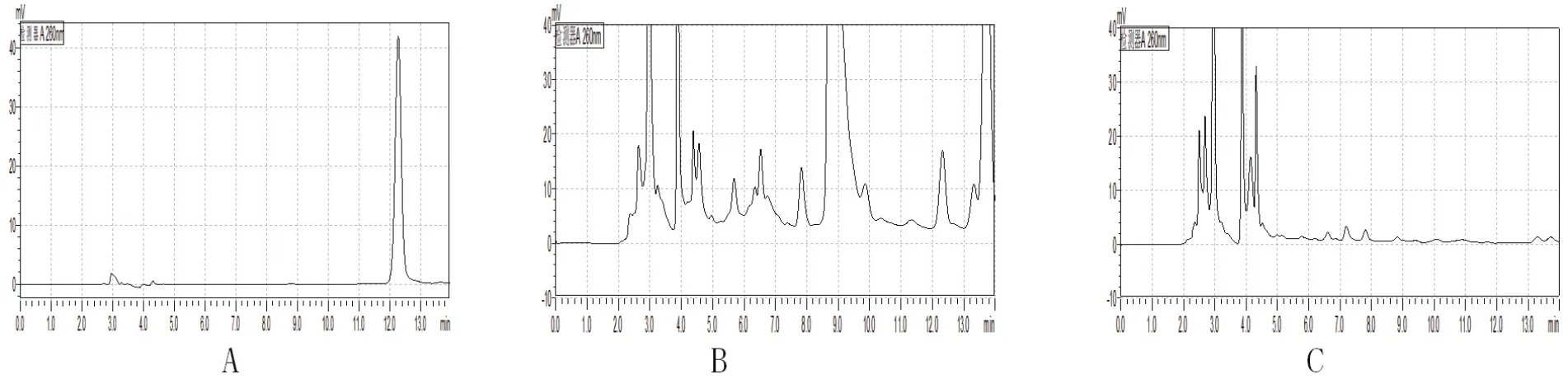
图3 原儿茶酸HPLC色谱图
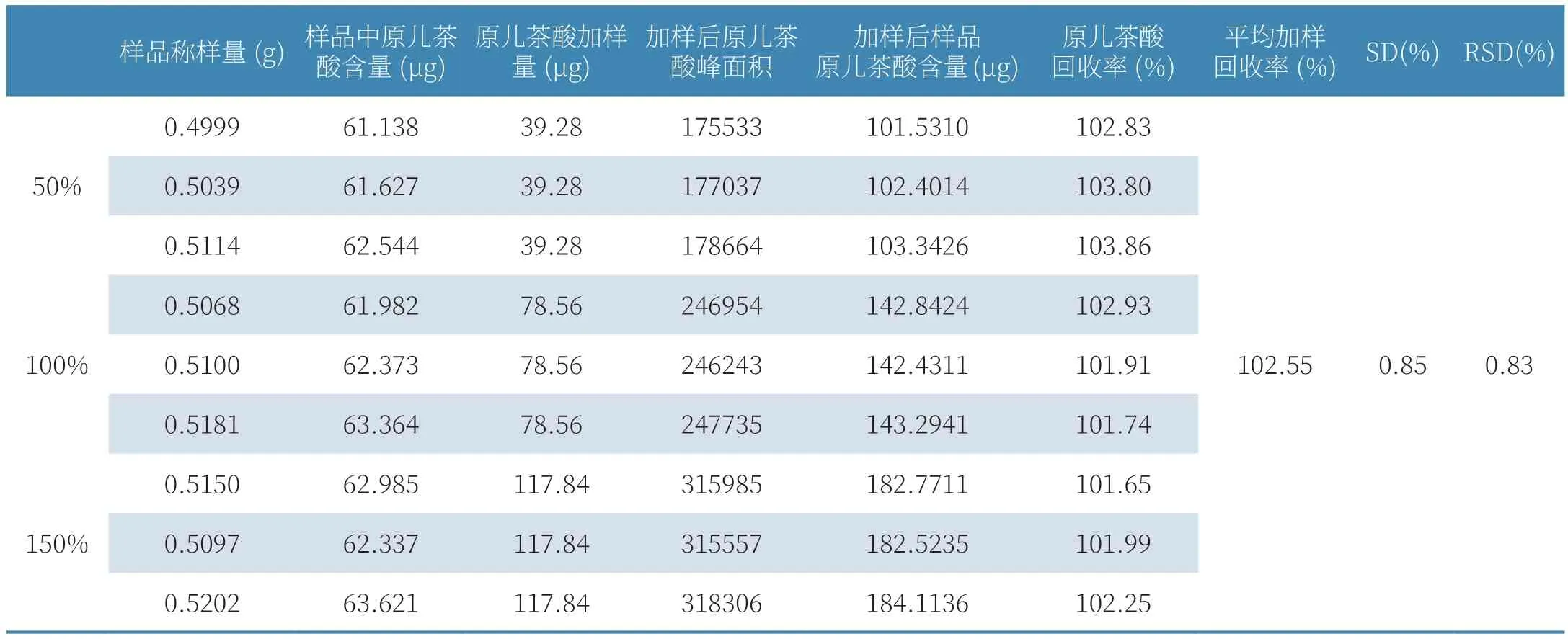
表1 加样回收率实验结果
(4)重复性实验。取大山楂颗粒磨成细粉,精密称取6份,每份1.0g。按2.2.2项下制备方法,得到样品溶液,按2.2.1项下色谱条件,进样6次,每次10μL,以原儿茶酸对照品溶液(19.64μg/ml)为参照,计算样品中原儿茶酸的含量。结果显示RSD=0.33%,符合《中国药典》要求(RSD<2%),表明实验重复性良好。
(5)稳定性实验。取大山楂颗粒磨成细粉,精密称取1.0g。按2.2.2项下制备方法,得样品溶液,间隔1h进样一次,按2.2.1项下色谱条件,进样6次,每次10μL,以原儿茶酸对照品溶液(19.64μg/ml)为参照,计算样品中原儿茶酸的含量。结果显示RSD=0.66%,符合中国药典要求(RSD<2%),表明供试品在6h内稳定。
(6)加样回收率实验。取大山楂颗粒磨成细粉,精密称取9份,每份1.0g,分为3组。每组按取样量的50%、100%、150%分别加入原儿茶酸对照品,按2.2.2项下制备方法,得样品溶液,按2.2.1项下色谱条件,进样9次,每次10μL,以原儿茶酸对照品溶液(19.64μg/ml)为参照,计算样品中原儿茶酸的含量,结果见表1。结果显示,平均加样回收率结果为102.55%,RSD=0.83%,符合《中国药典》要求(RSD<2%),表明实验可行性良好,该方法可用于大山楂颗粒的含量测定。
2.2.6 含量测定
取15个不同批次的大山楂颗粒磨成细粉,每份称取1.0g,按2.2.2项下制备方法,得样品溶液,按2.2.1项下色谱条件,进样6次,每次10μL,以原儿茶酸对照品溶液(19.64μg/ml)为参照,计算样品中原儿茶酸的含量,结果见表2。结果表明:大山楂颗粒中原儿茶酸的平均含量为0.0653mg/g,最低为0.0265mg/g。
3.结论与讨论
由于大山楂颗粒是通过水煎煮而得的,且炒麦芽与六神曲中存在许多酶类,所以在煎煮过程中,许多的成分都通过酶反映了在煎煮过程中有许多成分可能会发生变化。通过多次的试验发现,在处方药材中能够检测出来的许多成分在样品中不能被检测出来,而样品中能被检测出的成分在药材中有不能被检测出来。在高效液相色谱法测定山楂含量中,对已有山楂报道中的很多成分检测后发现,在样品中都不能被检测出来,经过很多次试验发现原儿茶酸在药材和样品中都被检测出来,通过试验得出药材与样品的转化率均大于100%(三批样品的转化率分别是113%、137%、146%),说明原儿茶酸在煎煮的过程中由于酶的作用生成了更多的原儿茶酸。因此,最低限量不是通过转移率来计算,而是通过15批最低量再低一点来确定。
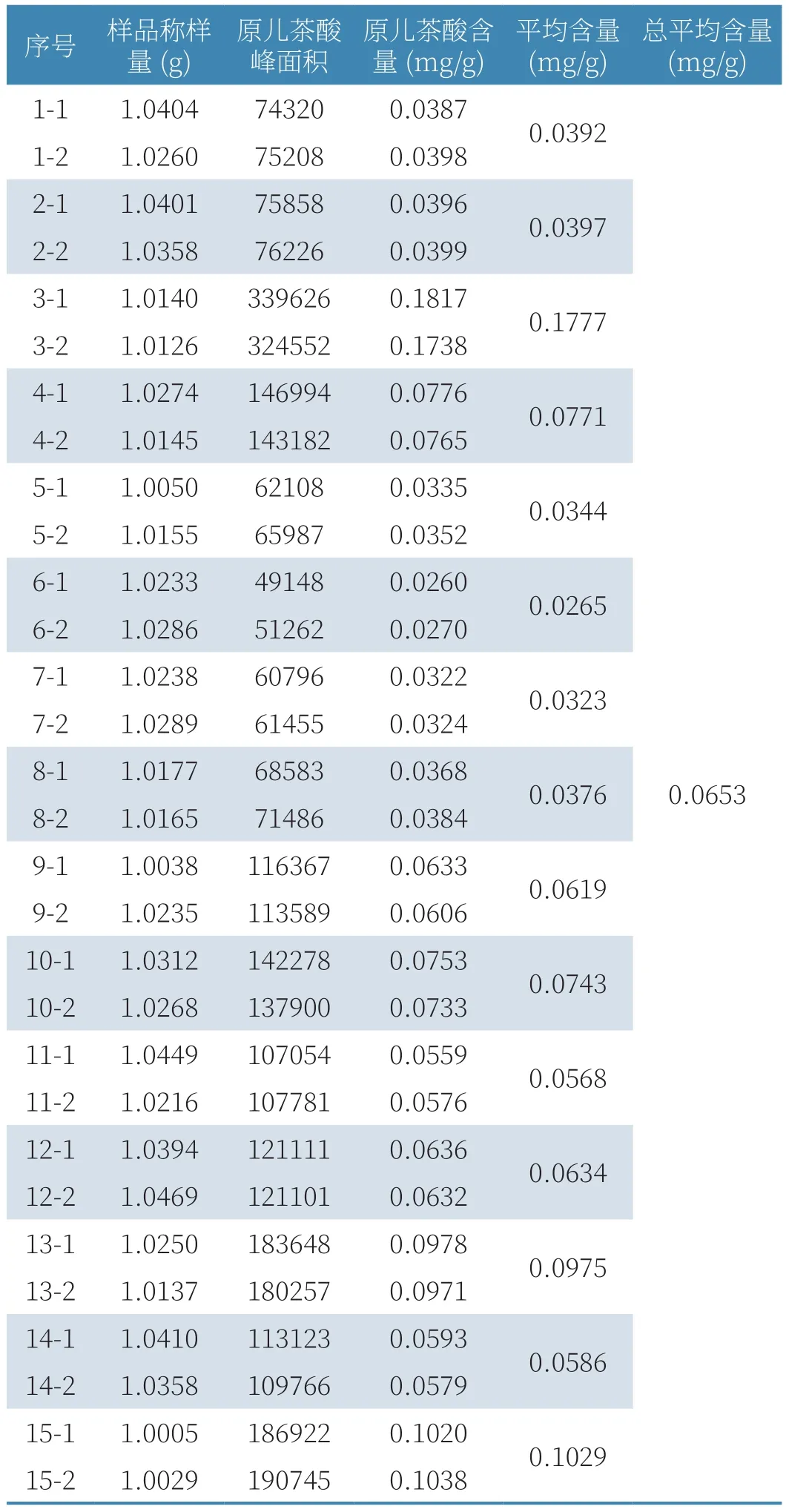
表2 含量测定实验结果
对15批大山楂颗粒样品的含量测定发现,大山楂颗粒的平均含量为0.0653mg/g,最低含量为0.0265mg/g,考虑到药材每年含量会有所不同,因此将大山楂颗粒中的原儿茶酸的限量定为:大山楂颗粒每包含原儿茶酸不得少于50μg。另外,大山楂颗粒的薄层色谱鉴别中还有六神曲和炒麦芽都没有被鉴别出来。含量测定方面,本研究没能找出单一的一味药的含量测定,只是控制了大山楂颗粒中原儿茶酸的总含量。稳定性研究方面,也只是做了初步的研究,对于大山楂颗粒还需要做更长期的稳定性研究。
