慢病毒介导NFAT基因对HepG2细胞生物学行为的影响①
2020-02-20张雅敏刘子荣天津市第一中心医院器官移植中心天津300192
许 洋 张雅敏 王 建 杨 龙 刘子荣 (天津市第一中心医院器官移植中心,天津 300192)
活化T细胞核因子(nuclear factor of activated T cell,NFAT)最初作为与人T细胞中IL-2启动子的抗原受体应答元件-2(ARRE-2)相结合的诱导型核因子被发现[1]。NFAT家族包括5名成员:NFATc1(也称NFAT2)、NFATc2(NFAT1)、NFATc3(NFAT4)、NFATc4(NFAT3)和NFAT5,当细胞受到信号刺激时,通过钙离子/钙调蛋白激酶信号通路,使 NFAT 蛋白迅速去磷酸化,进入细胞核内,与 NFAT 靶基因上的位点结合发挥其介导的基因转录调节功能。NFAT信号传导的失调与肿瘤恶性表型和肿瘤进展有关,其已显示出在调节肿瘤的发生发展,细胞的增殖、分化、侵袭、转移、血管形成和肿瘤微环境中起到的重要作用[2]。血管内皮生长因子A(VEGFA)作为血管生成刺激因子,在血管生成的调节中起重要作用,是血管系统发育和分化所必需的,当它与血管内皮生长因子受体(VEGFR)结合后,会使众多通道上游和下游信号形成级联,最终增强内皮细胞周围组织的增殖、迁移、通透和渗透能力。然而NFAT在肝癌中的作用并没有明确,并且在肝癌中NFAT与VEGFA的关系不清楚,为进一步探索NFAT蛋白与肝癌发生发展及其恶性特征的关系,本实验将利用shRNA干扰技术,观察干扰NFAT基因对于人肝癌HepG2细胞生长增殖、细胞侵袭迁徙及对VEGFA分子表达的影响,进一步揭示 NFAT 相关通路与临床肝癌发生发展的关系。
1 材料与方法
1.1材料与试剂 肝细胞癌细胞系HepG2购自北京协和细胞中心,DMEM高糖液体培养基、胎牛血清购自美国Gibco公司,兔抗人NFAT多克隆抗体、兔抗人GAPDH多克隆抗体购自英国Abcam公司,羊抗兔IgG—HRP第二抗体购自武汉博士德公司,总RNA提取试剂Trizol、逆转录-聚合酶链反应(qRT-PCR)试剂盒购自大连TaKaRa公司(Cell counting kit-8)CCK-8试剂盒购自日本同仁公司,Transwell小室购自美国Corning公司,Matrigel基质胶购自美国BD公司。
1.2方法
1.2.1shRNA载体慢病毒的合成 根据GenBank的人NFAT mRNA(NM_172390)编码区序列,遵循设计原则,设计干扰病毒,并设置阴性对照,shRNA慢病毒表达载体构建工作由上海吉凯公司完成。序列如下:NFAT-shRNA101:5′-CcggcgGAATCCTGAAACTCAGAAACTCGAGTTTCTGAGTTTCAGGATT-CCGTTTTTg-3′,NFAT-shRNA102:5′-CcggAAGCCGAATTCTCTGGTGGTTCTCGAGAACCACCAGAGA-ATTCGGCTTTTTTTg-3′,NFAT-shRNA103:5′-CcggCTGCATGGCTACTTGGAGAATCTCGAGATTCTCCA-AGTAGCCATGCAGTTTTTg-3′,阴性对照(CON313):5′-CcggTTCTCCGAACGTGTCACGTCTCGAACGTGA-CACGTTCGGAGAATTTTTg-3′,阴性对照分子序列与NFAT基因及靶细胞内其他基因无明显同源性。
1.2.2细胞培养与转染 细胞培养于含10%胎牛血清(FBS)的DMEM培养液中,青霉素100 U/ml,链霉素100 mg/L,37℃、5%CO2,孵箱内培养,选取对数生长期的细胞用0.25%的胰酶消化后,调整细胞浓度为1×105个/ml,接种至6孔板中,贴壁后遵循慢病毒转染说明书,以MOI=10指数转染六孔板中细胞,加人终浓度5 μg/ml的Polybrene,8~12 h根据细胞状态更换新鲜完全培养基,72 h后应用荧光观察及嘌呤霉素进行稳定株筛选,嘌呤霉素筛选13 d后药物克隆(细胞群落)出现,用浸有0.25%胰酶的无菌棉签将群落消化,转移至25 cm培养瓶培养,得到稳定转染细胞克隆。细胞分组:未处理的HepG2细胞为对照组,阴性对照慢病毒转染的HepG2细胞为阴性对照组,3种干扰慢病毒转染的HepG2细胞为干扰组。
1.2.3Real-time PCR检测NFAT mRNA、VEGFA mRNA表达 收集各组细胞用磷酸盐缓冲液洗涤后用Trizol一步抽提法提取细胞总RNA,按照逆转录盒及实时定量PCR试剂盒说明进行逆转录及Real-time PCR反应,引物用设计软件Primer premier5.0 设计,由苏州金唯智公司合成。NFAT上游引物:5′-CTCACAGCGATCTATTGTTCC-3′,下游引物:5′-CCTTCAGGTTGTTTCTTTCC-3′,PCR产物265 bp;VEGFA上游引物:5′-GAAAGACAGATCACAGGTACAG-3′,下游引物:5′-TTCCAACAATGTGTCTCTTC-3′,PCR产物241 bp;β-actin上游引物:5′-CGTGACATTAAGGAGAAGCTG-3′,下游引物:5′-CTAGAAGCATTTGCGGTGGAC-3′,PCR产物500 bp。PCR扩增条件:95℃预变性30 s,95℃变性10 s,58℃退火30 s,72℃延伸30 s,共45个循环,通过2-ΔΔCt计算各组相对对照组表达量。
1.2.4Western blot检测NFAT蛋白、VEGFA蛋白水平的表达 提取各组细胞蛋白并进行蛋白定量,将蛋白样品和5× loading buffer按4∶1的比例混匀,置于沸水中加热10 min,配制10%SDS-PAGE分离胶,配制浓缩胶,后将蛋白转移至PVDF膜上,5%脱脂奶室温封闭2 h,加入NFAT一抗(1∶1 000)、VEGFA一抗(1∶1 000)、GAPDH一抗(1∶5 000)4℃过夜,后以TBST洗脱,1∶3 000二抗封闭作用2 h,TBST洗脱,ECL显影观察结果。
1.2.5CCK-8检测细胞增殖能力 调整各组细胞浓度为5×104ml-1,接种阴性对照组细胞(NC组)、对照组细胞(control)及干扰组细胞(shRNA)于96孔板中,每孔各100 μl,每组设置5个平行对照并设置不含细胞的空白对照,培养5 d,每天相同时间点进行检测,每孔加入10 μl CCK-8试剂,继续培养2 h,检测450 nm波长下OD值。
1.2.6Transwell 实验检测各组细胞迁移和侵袭能力 细胞饥饿24 h后,调整各组细胞浓度为5×104ml-1,以无血清DMEM培养基配制单细胞悬液,每个Transwell上室加入200 μl细胞悬液,下室加入650 μl含10%FBS血清的DMEM培养基,侵袭实验于小室上层铺Matrigel基质胶,迁徙实验则不铺胶。培养24 h后取出小室,棉签擦干小室上层,4%多聚甲醛固定30 min,结晶紫染色30 min,冲洗干净,在200倍视野下随机选取5个视野拍照计数。
2 结果
2.1细胞转染效率 阴性对照组及NFAT-shRNA(101-103)慢病毒转染的HepG2细胞内可见绿色荧光。各组慢病毒转染后转染效率达80%以上,后以嘌呤霉素筛选稳定转染单克隆细胞系,见图1。
2.2Real-Time PCR检测稳定细胞株中NFAT mRNA、VEGFA mRNA表达 结果显示,阴性对照组与对照组之间差异无明显统计学意义(P>0.05),NFAT-shRNA101、NFAT-shRNA102、NFAT-shRNA103干扰组中NFAT mRNA表达较对照组及阴性对照组降低,差异有统计学意义(P<0.01),表明转染携带表达载体的慢病毒后能有效沉默人肝癌HepG2细胞中NFAT的表达,其中shRNA103干扰效果最明显,干扰效率最高,见图2、3。

图1 荧光显微镜观察各组HepG2细胞转染效果Fig.1 Fluorescence microscopy was used to detected HepG2 cells transfected with each groupNote:A.NFAT-shRNA101;B.NFAT-shRNA102;C.NFAT-shRNA103;D.NFAT-NC.

图2 HepG2各组细胞转染后NFAT mRNA表达量Fig.2 HepG2 expression of NFAT mRNA after transfectedNote:NC.Negative control group.**.P<0.01,vs NFAT-NC and Control.
2.3Western blot检测各组稳定细胞株中NFAT及VEGFA蛋白表达 结果显示,阴性对照组与对照组蛋白水平表达无明显差异,NFAT-shRNA101、NFAT-shRNA102、NFAT-shRNA103 干扰组中NFAT蛋白表达水平较对照组及阴性对照组降低,其中shRNA103组蛋白几乎不表达,表明其干扰效果最明显,干扰效率最高。结果显示,NFAT干扰组中VEGFA蛋白水平表达较对照组及阴性对照组降低,见图4、5。

图3 HepG2各组细胞转染后VEGFA mRNA表达量Fig.3 HepG2 expression of VEGFA mRNA after transfectedNote:NC.Negative control group.**.P<0.01,vs NFAT-NC and Control.

图4 Western blot检测人肝癌HepG2细胞 NFAT蛋白表达Fig.4 Western blot analysis were used to detect NFAT expression in HepG2 cell linesNote:A.Control;B.Negative control;C.NFAT-shRNA101;D.NFAT-shRNA102;E.NFAT-shRNA103.*.P<0.05,vs NFAT-NC and Control;**.P<0.01,vs NFAT-NC and Control.
2.4干扰NFAT基因后对HepG2细胞增殖能力的影响 阴性对照组与对照组对于细胞增殖的影响差异未见明显统计学意义(P>0.05),NFAT-shRNA组细胞增殖能力受到明显抑制,与阴性对照组及对照组相比有明显统计学意义(P<0.01),表明干扰NFAT基因后,能有效抑制HepG2细胞的增殖,见图6。
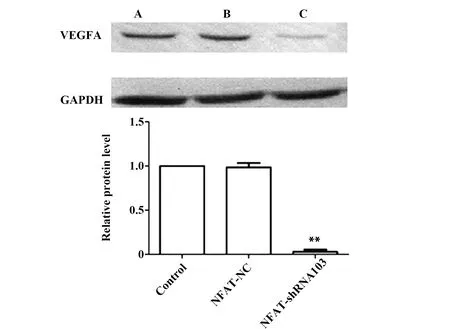
图5 Western blot检测人肝癌HepG2细胞VEGFA蛋白表达Fig.5 Western blot analysis were used to detect VEGFA expression in human HepG2 cell linesNote:A.Control;B.Negative control;C.NFAT-shRNA103.**.P<0.01,vs NFAT-NC and Control.

图6 CCK-8检测细胞增殖能力Fig.6 Determination of cell proliferation by CCK-8Note:*.P<0.05,vs NFAT-NC and Control.

图7 Transwell检测HepG2细胞侵袭能力Fig.7 Transwell assays of HepG2 cells invasion ability
2.5干扰NFAT基因对HepG2细胞迁徙及侵袭能力的影响 HepG2细胞迁徙实验结果显示,相对于对照组及阴性对照组,干扰组迁徙及侵袭数量减少,差异有统计学意义(P<0.01),表明干扰NFAT基因后,能有效抑制HepG2细胞的迁徙及侵袭能力,见图7~10。

图8 各组HepG2细胞穿膜数Fig.8 Number of invasion of HepG2 cells in each groupNote:NFAT-NC.Negative control group.**.P<0.01,vs NFAT-NC and Control.

图9 Transwell检测细胞迁徙能力Fig.9 Transwell assays of HepG2 cells migration ability

图10 各组HepG2细胞穿膜数Fig.10 Number of migration of HepG2 cells in each groupNote:NFAT-NC.Negative control group.**.P<0.01,vs NFAT-NC and Control.
3 讨论
原发性肝癌作为全世界最常见的恶性肿瘤,其在恶性肿瘤的死因中位列第二位,仅2015年全球新发病人数约745 000人[3]。尽管目前的手术治疗及相关药物治疗效果较过去有明显提高,术后5年生存率可达50%~60%,但复发率也高达60%~70%,对于早期诊断、手术后高复发率、高转移率及不良预后的问题仍亟待解决。因此,为了改善及提升原发性肝癌治疗的预后,关键在于对肝癌发生机制中相关新型特异性及敏感性靶点的发现及研究。本课题组在前期的实验中发现,FK506作为钙调神经磷酸酶抑制剂,能抑制NFAT的转录活化,而且其能显著抑制HepG2和HepG2.2.15细胞增殖,其抑制增殖作用随剂量增加而增强,这提示 NFAT 可能为促癌基因,NFAT信号通路的激活与肝癌的发生有着密切的联系,抑制NFAT信号通路可能会阻止肝癌的进展[4]。同时NFAT具有多向调节功能,其不仅在多种免疫细胞如T细胞、B细胞、NK细胞中有表达,在非免疫细胞中也存在普遍表达,并且在胚胎发育、器官生成中起到重要作用[5,6]。一些研究证实,在人类实体恶性肿瘤及血液恶性肿瘤中,NFAT均存在过表达现象,并且在恶性肿瘤的生长增殖、细胞侵袭迁徙、血管生成及转移的调节中扮演重要角色[7,8]。
基因沉默技术常用到的为小干扰RNA(siRNA),其为一个长20~25个核苷酸的双股RNA,在生物学上有许多不同的用途,目前siRNA主要参与RNA干扰(RNAi)现象,以带有专一性的方式调节目的基因的表达,对特定基因产生具有专一性的敲弱效果,基因沉默技术的发展为肿瘤基因靶向治疗提供了新的途径[9,10]。传统的干扰基因方式为通过转染siRNA的方法使之进入细胞内,参与到RNAi途径,发挥使靶基因沉默的效应,这一方法受转染效率的影响较大。本实验采用含shRNA表达载体的慢病毒干扰目的基因,相对于siRNA瞬转方式,其转染细胞时,载体可以稳定地整合到基因组中,在细胞内转录生成shRNA,利用细胞内的Dicer酶,生成相应的siRNA,发挥RNAi作用,并且在细胞中脱靶效应要低于siRNA,其感染细胞效率高,干扰效果持久且稳定,后期经嘌呤霉素筛选出单克隆细胞株,形成稳定转染细胞系。
为保证mRNA被有效抑制,本实验针对不同靶点设计3种不同shRNA,在3种干扰病毒作用下,PCR及Western blot结果显示,相对于对照组,NFAT-shRNA101、NFAT-shRNA102及NFAT-shRNA 103组中NFAT mRNA及NFAT蛋白均明显降低,HepG2细胞中NFAT基因受到抑制,根据结果,确定NFAT-shRNA103组为干扰效果最好,故后续实验以其作为干扰组。同时,阴性对照组未见明显抑制,表明shRNA抑制具有特异性。各组VEGFA的基因表达及蛋白表达结果表明,NFAT对于VEGFA的表达有促进作用,其很可能作为NFAT下游的靶蛋白而发挥作用。Wang等[11]发现在HepG2细胞中激活钙调神经磷酸酶/NFAT通路后,肿瘤细胞的侵袭及增殖能力大大增强。Chen等[12]发现当使用siRNA沉默细胞内VEGFA基因表达时,其Transwell结果显示侵袭实验及迁徙实验中细胞穿膜数均较对照组明显减少,且细胞增殖能力明显减弱。本实验中CCK-8及Transwell实验证明干扰NFAT基因,VEGFA基因及蛋白表达量明显减弱,细胞增殖活性、侵袭及迁徙能力显著降低,这些结果表明NFAT可能为其生物学行为改变的重要基因,激活的NFAT蛋白可能激活下游VEGFA基因,促进VEGFA蛋白转录活化,增强了肿瘤细胞侵袭及增殖能力,而干扰NFAT的表达后,其生物学恶性行为明显减弱。Müller等[13]发现VEGF由内皮细胞、成纤维细胞及肿瘤细胞分泌,其与内皮细胞上相关受体(VEGFAR)结合后,引起PLCγ的激活,从而引起钙内流而使NFAT蛋白转录活化,而激活的NFAT蛋白又促进了VEGFA及VEGFAR的合成从而形成瀑布式效应。所以激活NFAT通路后VEGFA及其受体会持续转录活化,促进细胞生长增殖、侵袭及迁徙能力。
综上所述,NFAT蛋白在肝癌的发生发展中起到重要作用,活化的NFAT蛋白可能通过级联作用激活下游的VEGFA因子,从而增强细胞的生物学功能。通过使用靶向NFAT的shRNA载体转染后,不仅抑制NFAT在细胞内的水平,还特异性抑制其生物学行为,提示NFAT可作为肝癌基因治疗的潜在靶点,为临床肝癌的诊断及治疗提供新思路。此外,抑制过表达NFAT基因导致细胞增殖、侵袭及迁徙能力改变是否完全依赖于VEGFA的作用,是否存在其他下游靶点的激活或抑制,其作用机制还有待进一步研究。