miR-433-3p靶向MAPK8对肝癌细胞MHCC97H增殖、凋亡和迁移的调控作用①
2020-02-20万智双眉山市人民医院眉山620010
万智双 熊 丁 曹 宸 (眉山市人民医院,眉山 620010)
肝癌是一种频繁发生于慢性肝脏疾病和肝硬化中的恶性肿瘤疾病,原发性肝癌在常被诊断出的癌症当中位居第六,并且是导致世界范围内癌症相关性死亡的第二大主要原因[1,2]。超过半数的肝癌新病例和死亡都发生在中国,其中最常见的原发性肝癌类型是肝细胞癌[3]。在中国所有的癌症病例当中,肝癌生存率最低,由于早期诊断的缺乏,当诊断出肝癌时已经到了晚期,不适合采用根治性手术治疗[4]。因此,发现能特异性阻断肝癌细胞增殖和转移的靶向分子,对于肝癌的治疗具有重要意义。
MicroRNA(miRNA)是一种长度约18~22 nt的内源性小分子非编码RNA,在基因表达调控中发挥着重要作用[5]。miRNA在生物体内的异常表达与诸多疾病都有着密切联系,其中包括癌症。迄今为止已有大量文献报道了miRNA在癌症发展和药物抗性中所起到的关键调控作用[6,7]。然而由于miRNA功能的复杂性,很多方面仍有待进一步研究。在多篇文献中均报道了miR-433-3p对包括神经胶质瘤、食管鳞状细胞癌、膀胱癌等在内的多种肿瘤的抑制作用[8-10]。本研究通过体外细胞实验探讨了miR-433-3p与有丝分裂原活化蛋白激酶8(mitogen-activated protein kinase 8,MAPK8)的关系,以及miR-433-3p对肝癌细胞MHCC97H增殖、凋亡和迁移的调控,为miR-433-3p对肝癌的作用提供了新的实验及理论依据。
1 材料与方法
1.1材料
1.1.1主要试剂 DMEM培养基、胎牛血清购自美国Gibco公司,青链霉素、Trizol提取液、RIPA裂解液购自北京索莱宝生物公司,lipofectamine 2000购自美国Thermo Fisher公司,miR-433-3p mimic、阴性对照mimic、pcDNA3.1-MAPK8(pc-MAPK8)由广州锐博生物公司合成,Primescript RT Reagent kit和SYBR PremixEX Taq II试剂盒购自TaKaRa公司,荧光素酶报告系统购自美国Promega公司,BCA试剂盒购自广州永诺生物公司,CCK8试剂盒、Hoechst试剂盒购自上海碧云天生物公司,所用引物由上海生工生物合成,MAPK8、增殖细胞核抗原(Prolifera-ting cell nuclear antigen,PCNA)、活化半胱天冬酶3(cleave caspase 3,cl-CASP3)、上皮性钙黏附蛋白(E-cadherin)、神经性钙黏附蛋白(N-cadherin)抗体购自美国Santa Cruz公司。
1.1.2临床样本获取 收集从2010年到2016年存档于眉山市人民医院的经病理检查确诊为肝癌的石蜡包埋组织27例及癌旁组织27例,所有样本获取已取得患者家属知情同意,研究获得本院伦理委员会批准。
1.2方法
1.2.1细胞培养 SMMC-7721、HepG2、MHCC 97H、Hep3B肝癌细胞株和HL-7702人正常肝细胞株购自美国ATCC公司,采用含1%青链霉素和10%胎牛血清的DMEM培养基进行培养,培养于37℃和5%CO2环境中。
1.2.2细胞分组和处理 将MHCC97H细胞分为空白对照(Control)组、阴性对照(negative control,NC)组、miR-433-3p组、pc-MAPK8组和miR-433-3p+pc-MAPK8组,根据对应的组别,按照lipofectamine 2000说明书,阴性对照mimic转染NC组细胞,miR-433-3p mimic转染miR-433-3p组细胞,pc-MAPK8转染pc-MAPK8组细胞,miR-433-3p mimic和pc-MAPK8共转染miR-433-3p+pc-MAPK8组细胞,转染24 h后收集细胞用于后续实验。
1.2.3RT-PCR检测 Trizol溶液提取各组样品RNA并通过反转录得到cDNA,进行PCR反应,条件设置为:95℃预变性2 min,95℃变性5 s,60℃退火10 s,反应进行40个循环。按照SYBR PremixEX TaqⅡ试剂盒说明书检测mRNA或miRNA转录水平,通过2-ΔΔCt法进行计算。
1.2.4荧光素酶报告实验检测 生物信息学的方法分析预测了miR-433-3p与MAPK8的靶向作用位点,构建MAPK8 3′-UTR区域的pGL3 luciferase promoter野生型(WT)和突变型(MUT)载体,分别与miR-433-3p或阴性对照mimic共转染HEK293细胞,48 h后检测荧光素酶酶活性。
1.2.5Western blot检测 RIPA溶液提取各组细胞总蛋白,BCA试剂盒定量,每孔30 μg上样量进行点样,通过10%SDS-PAGE分离蛋白,半干转膜法将蛋白印迹到PVDF膜上,使用5%脱脂牛奶封闭2 h,使用一抗4℃孵育过夜,PBS缓冲液清洗PVDF膜,加入二抗孵育2 h,滴加ECL显色液进行显影,实验采用GAPDH作为内参。
1.2.6CCK8法检测细胞增殖 将按1.2.1处理的细胞于5%CO2,37℃条件下继续培养,每隔1 d使用CCK8法测定细胞增殖倍数,总共进行3 d。具体测定方法为:细胞接种于96孔板,每孔加入10 μl的CCK8试剂并培养4 h,酶标仪测定450 nm吸光值。
1.2.7Hoechst检测细胞凋亡 细胞接种于6孔板,4%多聚甲醛固定细胞,0.5% TrintonX-100透膜处理,滴加Hoechst染料进行染色30 min,荧光显微镜观察细胞凋亡。
1.2.8Transwell检测细胞侵袭 50 μl基质胶加入Transwell小室中37℃凝固3 h,上室加入无血清培养基,下室加入完全培养基,各组细胞分别接种于Transwell小室上室,培养48 h。擦除未过膜的细胞,多聚甲醛固定残余的细胞,使用1%结晶紫进行染色并拍照。
1.2.9划痕愈合法检测细胞迁移 细胞接种于6孔板,细胞铺满板内80%的空间时,中枪头对细胞进行垂直水平划线,PBS清洗之后,在5%CO237℃的条件下培养24 h,显微镜观察划痕愈合情况。
2 结果
2.1肝癌细胞株中miR-433-3p表达下调 如图1A所示,与正常肝组织比较,肝癌组织中miR-433-3p表达显著降低,差异有统计学意义(P<0.01)。同时,如图1B所示,与正常肝细胞株HL-7702比较,肝癌细胞株SMMC-7721、HepG2、MHCC97H、Hep3B中miR-433-3p表达均显著降低,差异有统计学意义(P<0.01)。选用了miR-433-3p表达量最低的MHCC97H细胞株进行后续实验。
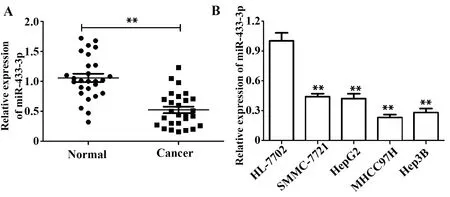
图1 RT-PCR检测人临床肝组织样本和细胞株中miR-433-3p表达Fig.1 RT-PCR detection of miR-433-3p expression in human clinical liver tissue samples and cell linesNote: **.P<0.01 versus Normal & HL-7702 group.
2.2miR-433-3p抑制MAPK8 mRNA转录 如图2所示,与Control组比较,NC组miR-433-3p表达水平无显著差异,miR-433-3p组miR-433-3p表达水平显著升高,差异有统计学意义(P<0.01);同时,与Control组比较,NC组MAPK8转录水平无显著差异,miR-433-3p组MAPK8转录水平显著降低,差异有统计学意义(P<0.01)。

图2 RT-PCR检测MHCC97H细胞中miR-433-3p对MAPK8转录的影响Fig.2 RT-PCR detection of effects of miR-433-3p on MAPK8 transcription in MHCC97H cellsNote: n=6,**.P<0.01 versus Control group.
2.3miR-433-3p靶向作用于MAPK8 如图3所示,与MAPK8 WT+NC比较,MAPK8 WT+miR-433-3p组荧光素酶活性显著降低,差异有统计学意义(P<0.01);MAPK8 MUT+NC与MAPK8 MUT+miR-433-3p组不存在显著的荧光素酶活性差异。
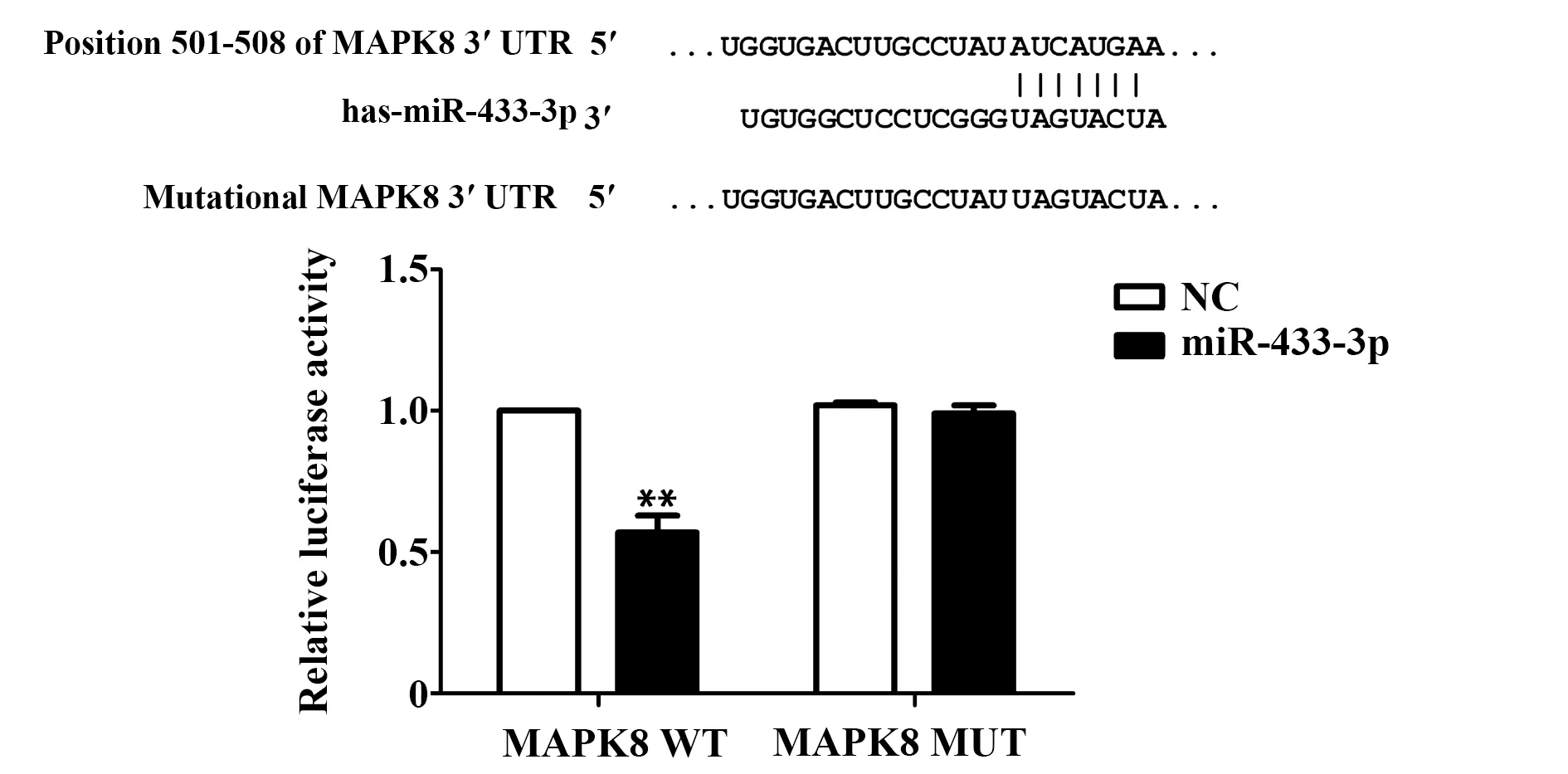
图3 荧光素酶报告实验检测miR-433-3p和MAPK8的靶向作用关系Fig.3 Luciferase reporter assay for targeting relationship between miR-433-3p and MAPK8Note: n=3,**.P<0.01 versus MAPK8 WT+NC group.
2.4miR-433-3p抑制MAPK8表达 如图4所示,与Control组比较,miR-433-3p组MAPK8蛋白表达显著降低,pc-MAPK8组MAPK8蛋白表达显著升高,差异有统计学意义(P<0.01);与pc-MAPK8组比较,miR-433-3p+pc-MAPK8组MAPK8蛋白表达显著降低,差异有统计学意义(P<0.01)。
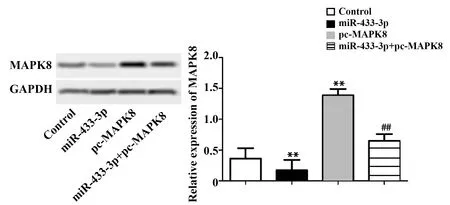
图4 Western blot检测MAPK8蛋白表达Fig.4 Western blot detection of MAPK8 protein expressionNote: n=6,**.P<0.01 versus Control group;##.P<0.01 versus pc-MAPK8 group.
2.5miR-433-3p抑制肝癌细胞增殖 如图5所示,与Control组比较,miR-433-3p组MHCC97H细胞增殖水平显著降低,pc-MAPK8组细胞增殖水平显著升高,差异有统计学意义(P<0.01);与pc-MAPK8组比较,miR-433-3p+pc-MAPK8组细胞增殖水平显著降低,差异有统计学意义(P<0.01)。
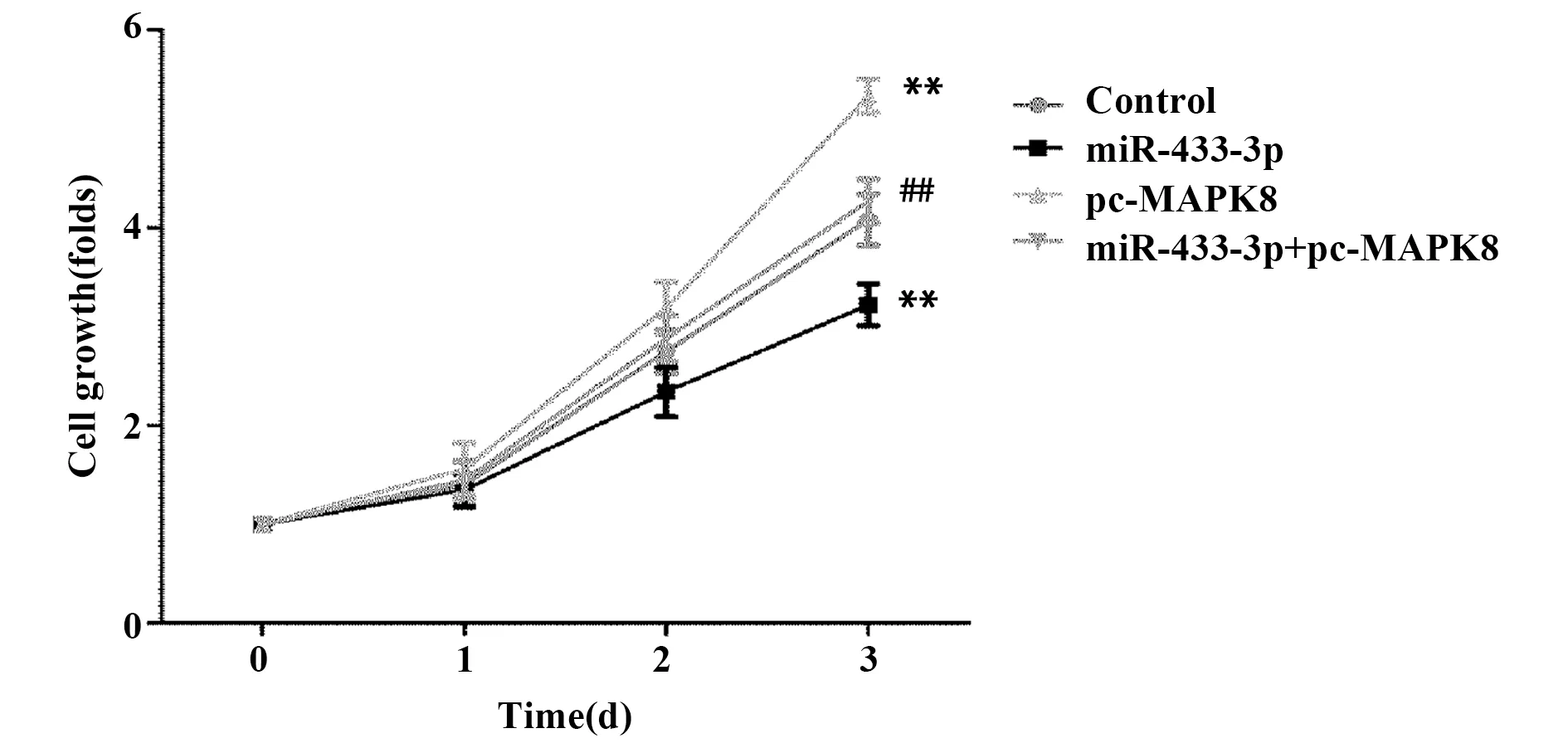
图5 CCK8检测MHCC97H细胞增殖Fig.5 CCK8 detection of cell proliferation of MHCC 97H cellsNote: n=6,**.P<0.01 versus Control group;##.P<0.01 versus pc-MAPK8 group.
2.6miR-433-3p诱导肝癌细胞凋亡 如图6所示,与Control组比较,miR-433-3p组MHCC97H细胞凋亡率显著升高,pc-MAPK8组细胞凋亡率显著降低,差异有统计学意义(P<0.01);与pc-MAPK8组比较,miR-433-3p+pc-MAPK8组细胞凋亡率显著升高,差异有统计学意义(P<0.01)。

图6 Hoechst检测MHCC97H细胞凋亡Fig.6 Hoechst detection of cell apoptosis of MHCC 97H cellsNote: n=6,**.P<0.01 versus Control group;##.P<0.01 versus pc-MAPK8 group.
2.7miR-433-3p抑制肝癌细胞迁移 如图7所示,与Control组比较,miR-433-3p组MHCC97H细胞划痕愈合率显著降低,pc-MAPK8组细胞划痕愈合率显著升高,差异有统计学意义(P<0.01);与pc-MAPK8组比较,miR-433-3p+pc-MAPK8组细胞划痕愈合率显著降低,差异有统计学意义(P<0.01)。

图7 划痕愈合法检测MHCC97H细胞迁移能力Fig.7 Wound healing test of migration ability of MHCC 97H cellsNote: n=6,**.P<0.01 versus Control group;##.P<0.01 versus pc-MAPK8 group.
2.8miR-433-3p抑制肝癌细胞侵袭 如图8所示,与Control组比较,miR-433-3p组MHCC97H细胞侵袭数目显著降低,pc-MAPK8组细胞侵袭数目显著升高,差异有统计学意义(P<0.01);与pc-MAPK8组比较,miR-433-3p+pc-MAPK8组细胞侵袭数目显著降低,差异有统计学意义(P<0.01)。

图8 Transwell法检测MHCC97H细胞侵袭能力Fig.8 Transwell chamber test of invasion ability of MHCC97H cellsNote: n=6,**.P<0.01 versus Control group;##.P<0.01 versus pc-MAPK8 group.
2.9miR-433-3p对增殖、 凋亡及转移相关蛋白的表达调控 如图9所示,与Control组比较,miR-433-3p组MHCC97H细胞中上皮间质转化相关蛋白E-cadherin和凋亡相关蛋白Caspase-3表达显著升高,上皮间质转化相关蛋白N-cadherin和细胞增殖相关蛋白PCNA表达显著降低,差异有统计学意义(P<0.01);与pc-MAPK8组比较,miR-433-3p+pc-MAPK8组细胞中E-cadherin和Caspase-3蛋白表达升高,N-cadherin和PCNA蛋白表达降低,差异有统计学意义(P<0.01)。

图9 Western blot检测增殖、凋亡及转移相关蛋白表达Fig.9 Western blot determination of proliferation,apoptosis and metastasis related protein expressionNote: n=6,**.P<0.01 versus Control group;##.P<0.01 versus pc-MAPK8 group.
3 讨论
有丝分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPKs)家族是一类在细胞中扮演着重要调控作用的丝氨酸-苏氨酸蛋白激酶家族。促炎细胞因子、生长因子、环境胁迫等因素产生的刺激经过一系列激酶信号级联放大,促使MAPK激活[11]。MAPK8又被称为c-Jun氨基末端激酶1(c-Jun N-terminal kinase 1,JNK1),是MAPKs家族的重要成员之一,可磷酸化并激活转录因子激活子蛋白1(activator protein-1,AP-1),进而激活下游一系列基因的表达,在细胞增殖、细胞分化、细胞生存、细胞死亡、炎症及其他病理过程中起着重要的调控作用[12]。在肝癌中,已有大量文献表明MAPK8与肝癌具有密切的关系[13,14],具有作为药物治疗靶点的潜力。而Tao等[15]的研究表明,在心肌中miR-433-3p可靶向作用于MAPK8与AZIN1,调控心肌纤维化的进程,Yang等[16]报道了miR-433-3p可通过抑制cAMP反应元件结合蛋白1(cAMP response element-binding protein 1,CREB1)的表达与功能,发挥抑制肝癌细胞迁移的作用。推测在肝癌细胞中miR-433-3p可能与MAPK8存在靶向作用,调控肝癌的发展。为了证实这一推测本文首先检测了miR-433-3p在多种肝癌细胞株中的表达,发现在肝癌细胞株中miR-433-3p表达均发生下调,表明miR-433-3p可能参与了肝癌的调控。进一步研究发现miR-433-3p与MAPK8存在靶向作用关系,并且miR-433-3p的高表达可显著抑制MAPK8的转录和蛋白表达,结果表明在肝癌细胞MHCC97H中miR-433-3p可靶向作用于MAPK8,抑制MAPK8的表达。
不受控制的细胞增殖以及逃避凋亡的能力是癌细胞的主要特征之一,研究表明MAPK8对肝癌细胞的增殖起着重要的调控作用。Hui等[14]报道了JNK1在肝细胞癌模型中可通过提高细胞增殖促进基因c-Myc的表达,下调增殖抑制因子p21的表达,促进肿瘤生长。本研究发现miR-433-3p显著抑制了肝癌细胞MHCC97H的增殖并促进细胞凋亡,MAPK8的过表达可逆转miR-433-3p的作用。同时,miR-433-3p显著提升了cl-CASP3的表达,抑制PCNA的表达,MAPK8过表达可逆转这一作用。PCNA可调节细胞从G1期进入S期,参与了DNA复制所需的聚合酶的合成,其表达水平与细胞增殖呈正相关;细胞凋亡主要是由Caspase家族蛋白介导的,cl-CASP3是细胞凋亡途径的最主要的执行蛋白[17,18]。实验结果表明miR-433-3p可通过下调MAPK8表达抑制肝癌细胞MHCC97H的增殖并促进细胞凋亡。
不受限制的远端转移能力是癌细胞的另一主要特征,其中迁移和侵袭在癌细胞转移过程中起着重要作用。研究表明MAPK8同样参与了对肝癌细胞迁移和侵袭的调控作用。Tsai等[19]报道了甘草查尔酮A可通过下调MKK4/JNK信号通路,抑制肝癌细胞的迁移和侵袭。本研究发现miR-433-3p显著抑制了肝癌细胞MHCC97H的迁移和侵袭,MAPK8过表达可逆转miR-433-3p的抑制作用。同时,miR-433-3p显著提升了E-cadherin的表达,抑制N-cadherin的表达,MAPK8的过表达可逆转miR-433-3p的调控作用。E-cadherin参与同类型细胞的黏附连接作用,是维持上皮细胞形态的重要成分,N-cadherin则起着相反的作用,促进细胞向间质形态转变[20,21]。实验结果表明miR-433-3p可通过下调MAPK8表达抑制肝癌细胞MHCC97H的迁移和侵袭。
综上所述,miR-433-3p可靶向抑制肝癌细胞MHCC97H中MAPK8的表达,提升cl-CASP3和E-cadherin的表达,抑制PCNA和N-cadherin的表达,进而抑制细胞的增殖、迁移和侵袭,促进细胞凋亡。本研究首次探究了在肝癌中miR-433-3p通过靶向作用于MAPK8,对肝癌细胞生长和转移的调控作用,为肝癌的靶向治疗干涉提供了新的参考。