抗阿尔茨海默症单链抗体的制备与体外活性研究①
2020-02-20朱禹奇宋思璇张凌宇张文慧张林波
付 璐 张 谦 杨 西 朱禹奇 宋思璇 张凌宇 张文慧 张林波
(吉林农业大学生命科学学院,长春 130118)
阿尔茨海默症(Alzheimer′s disease,AD)是一种渐行性神经退行疾病,患者表现为记忆力减退、认知能力障碍、行为异常,最终将丧失独立生活能力,在发病后的10~20年因并发症死亡[1]。2018年,世界AD患者人数为5 000万,预计到2050年,世界患病人口数将达到15 200万[2]。然而目前没有任何一种药物能够有效地延缓AD的疾病进程[3]。研究表明,AD患者脑中有三大病理学特征:β淀粉样蛋白(Amyloid-β,Aβ)聚积形成的斑块、高度磷酸化的微管结合蛋白聚集形成神经元纤维缠结和神经元丢失[4]。其中,研究者普遍认为患者脑中Aβ含量的异常升高是导致AD发病的最主要原因。因此,利用免疫疗法清除脑中的Aβ是最具潜力治疗AD的手段。
Aβ被动免疫疗法是向体内输入Aβ特异性抗体,从而清除脑中过量的Aβ,以达到治疗AD的目的。很多药物研发公司进行了临床实验[5]。如辉瑞和强生公司研发的Bapineuzumab,礼来公司研发的Solanezumab,都是以Aβ为靶点的抗体,临床实验结果显示,应用Aβ特异性抗体能够减少患者脑中Aβ的沉积,并对轻度AD患者的认知功能有一定的改善[6-8]。而后,由百健公司开发的抗体BIIB037,在Ⅰ期临床试验中取得了较好的效果,目前正在准备进行Ⅲ期临床试验[9];由百健和卫材公司一同研制的BAN2401,也在长达18个月的Ⅱ期临床试验中取得了较好的治疗效果[10]。这些实验结果都显示出了Aβ被动免疫疗法的治疗潜力。虽然Aβ被动免疫疗法已经取得了一定的治疗效果,但是由于全抗体存在抗体恒定区片段,易引发炎症反应,全抗体在AD治疗领域中的应用依旧存在安全性问题。
单链抗体(single chain fragment variable,scFv)是一种基因工程抗体,其只含有抗体重链以及轻链的可变区,并通过柔性铰链相连接[11]。对于AD的治疗,scFv显示出了极大的优势。首先,由于scFv相对分子质量较小,其能够更好地透过血脑屏障,显著提高治疗效果;此外,scFv能够更好地靠近脑中Aβ沉积,高效率地封闭Aβ的致病形式,有更高的治疗效率[12]。更重要的是,由于scFv不含有全抗体的恒定区结构,不能够引起补体反应,也不会激活脑中的免疫细胞,降低引起脑部炎症反应的可能,提高抗体治疗的安全性[13]。因此,单链抗体在AD治疗领域的应用,显示出了极大的优势。
本研究设计并成功制备了靶向Aβ的单链抗体,并对其体外活性进行了研究。结果显示,该单链抗体能够很好地与各种形式的Aβ相结合,具有良好的生物学活性,为AD的被动免疫疗法奠定了理论依据。
1 材料与方法
1.1材料 单链抗体基因合成于生工生物工程(上海)股份有限公司;载体pET20b质粒、人神经母细胞瘤细胞(SH-SY5Y)由吉林农业大学生命科学学院病原微生物与免疫团队提供;Aβ42多肽由上海吉尔生化合成;限制性内切酶、T4 DNA 连接酶(TaKaRa公司);质粒小提试剂盒、凝胶回收试剂盒[天根生化科技(北京)有限公司];镍柱柱料(GE公司);6E10抗体(Covance公司);Anti-His 单克隆抗体、AP 标记鼠二抗(Jackson Immuno Rearch 公司);小牛血清、细胞培养基、胰酶(Hyclone 公司);免疫组化试剂盒(迈新生物科技有限公司);其他常规试剂均为进口或国产分析纯试剂。
1.2方法
1.2.1scFv的表达与纯化 查找PDB数据库,获得能够识别Aβ3-7表位的抗体12B4(PDB ID:3IFP)的氨基酸序列,通过基因合成的方式,获得12B4-scFv的基因片段,并将其构建到pET20b表达质粒上,获得能够表达scFv的重组质粒pET20b-12B4-scFv。将重组质粒转入BL21(DE3)大肠杆菌表达系统中,对scFv进行表达与纯化,获得单链抗体12B4-scFv。
1.2.2Aβ寡聚体与Aβ纤维的制备 将Aβ42多肽溶解于六氟异丙醇中,避光溶解至溶液澄清。在室温条件下将六氟异丙醇挥发完全。用DMSO将Aβ42多肽完全溶解后,加入F12培养基,涡旋形成多肽悬液。将多肽悬液在4℃ 孵育24 h 后,获得Aβ寡聚体;将多肽悬液在37℃ 孵育24 h后,获得Aβ纤维,样品置于-80℃ 冰箱备用。
1.2.3ELISA法检测scFv对不同聚集形式Aβ的结合活性 在ELISA板中包被Aβ42多肽单体、Aβ寡聚体以及Aβ纤维,每孔100 ng,4℃包被过夜。包被完成后,洗去包被物质,在37℃下封闭2 h。封闭后,将单链抗体从1∶1 000起,5倍稀释至1∶125 000,加入到孔板中,37℃ 孵育2 h。随后加入抗His单克隆抗体,37℃ 孵育2 h。然后进行二抗孵育与显色,并利用酶标仪检测结果。样品OD值高于背景值2倍视为阳性结果。
1.2.4Western blot法检测scFv对Aβ寡聚体形成的抑制作用 在上述制备Aβ寡聚体的过程中,加入scFv,4℃孵育24 h 后,收取样品,进行Western blot实验。首先利用SDS-PAGE对样品进行电泳分离,然后利用电泳半干转化仪,将蛋白转移至硝酸纤维素膜上。牛奶溶液封后,利用Aβ特异性抗体6E10抗体进行孵育,2 h 后,进行二抗与显色。
1.2.5硫黄素-T荧光法检测scFv对Aβ纤维形成的抑制作用 采用硫磺素T(THT)法检测scFv对Aβ纤维形成的抑制作用。将THT溶液加入到Aβ储备液中。并向其中加入纯化后的scFv,至总体积150 μl,混匀后加入孔板中。将孔板置于37℃中进行反应,每30 min利用荧光酶标仪对荧光进行检测,激发波长425 nm,发射波长460 nm,并绘制纤维生长曲线。
1.2.6MTT法检测scFv对Aβ寡聚体产生的细胞毒性的保护作用 将SH-SY5Y铺于 96 孔板中,每孔约 5×104个细胞。37℃培养24 h后,向孔中分别加入空培养基(阴性对照组)、寡聚体(实验对照组)或寡聚体和抗体混合物(实验组)。37℃孵育48 h 后,向孔板中加入MTT,37℃ 孵育4 h。然后将孔板离心后弃去孔中上清。向每孔加入150 μl DMSO,充分振荡混匀后,用酶标仪在490 nm处检测吸光度。
1.2.7免疫组化法检测scFv对AD模型小鼠脑中Aβ斑块的结合能力 取9月龄 APP/PS1 AD模型小鼠大脑,多聚甲醛固定后,脱水、透蜡、并进行石蜡包埋与切片。将切片进行高压抗原修复后封闭,以12B4-scFv为一抗进行孵育,然后以anti-His单克隆抗体为二抗进行孵育,滴加适量酶标抗体于切片上,孵育后显色。复染、脱水、透明后封片,镜检照相。
1.3统计学处理 采用SPSS统计软件对数据进行分析,组间比较采用t-Test分析,P<0.05为差异具有统计学意义。
2 结果
2.1scFv的构建、表达与纯化 我们成功将12B4-scFv的基因序列构建到pET20b质粒上,并用大肠杆菌对12B4-scFv进行表达。利用镍柱亲和层析法,对scFv进行了纯化。实验结果表明,12B4-scFv能够很好地表达,经过纯化,能够获得纯度达95%以上的蛋白。12B4-scFv的SDS-PAGE与Anti-his Western blot结果如图1 所示。
2.2scFv能够与不同聚集形式Aβ相结合 我们通过ELISA的方式对纯化所得12B4-scFv与Aβ多肽、Aβ寡聚体以及Aβ纤维的结合活性进行了检测,结果如图2所示。12B4-scFv能够很好地与3种不同形式的Aβ相结合,其效价能够达到105。其中,抗体与Aβ多肽的结合能力最强,与Aβ纤维的结合能力最弱。这可能是由于12B4-scFv识别的是Aβ3-7,Aβ在聚集形成寡聚体或者纤维后,其N端暴露部分减少,导致抗体的结合能力减弱。
2.3scFv对Aβ寡聚体和纤维的形成具有抑制作用 我们首先通过Western blot 的方式检测了制备Aβ寡聚体,其分子量大小约为16 kD。在寡聚体制备过程中,加入12B4-scFv共同孵育,能够显著减少Aβ寡聚体的含量(图3A)。

图1 12B4-scFv的表达纯化图Fig.1 Purification of 12B4-scFv
THT能够与β折叠结构相结合,在激发光存在的情况下,发出荧光。在Aβ形成纤维的过程中,会产生大量β折叠结构,因此Aβ纤维能够与THT结合,并通过检测荧光的强度来检测Aβ纤维的形成情况。我们在制备Aβ纤维的过程中,加入12B4-scFv,检测抗体对Aβ纤维形成的抑制作用。实验结果如图3B所示,12B4-scFv的加入能够抑制Aβ纤维的形成,减少Aβ纤维的生成量,并能够减慢Aβ纤维形成的速率,与未加入抗体的对照组相比,差异具有显著统计学意义(P<0.001)。
2.4scFv对Aβ寡聚体产生的细胞毒性起到保护作用 我们利用SH-SY5Y细胞为模型,通过MTT法检测了Aβ寡聚体对PC12细胞的毒性以及12B4-scFv对细胞的保护作用。实验结果如图4所示。与对照组相比,12B4-scFv能够抑制Aβ寡聚体产生的细胞毒性,12B4-scFv的加入可以有效地保护细胞,当加入抗体的量为0.1 mol/L时,其对细胞的保护效率能够达到50%(P<0.01)。
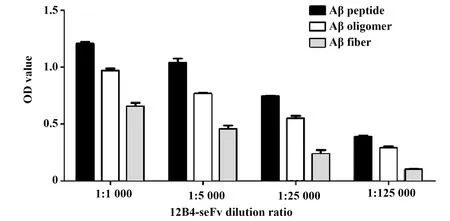
图2 ELISA法检测12B4-scFv与不同形式Aβ的结合活性Fig.2 ELISA assay to determine binding activity of 12B4-scFv to different forms of Aβ

图3 12B4-scFv对Aβ寡聚体与纤维形成的抑制作用Fig.3 Inhibition on formation of Aβ oligomers and fibers by 12B4-scFvNote:A.Western blot assay to determine the inhibitory effect of 12B4-scFv against the formation of Aβ oligomer;B.THT method was used to detect the inhibition of 12B4-scFv on the formation of Aβ fibers.

图4 12B4-scFv对Aβ寡聚体产生的细胞毒性的保护作用Fig.4 Protective effect of 12B4-scFv on cytotoxicity induced by Aβ oligomerNote:**.P<0.01.

图5 12B4-scFv与AD模型鼠脑中Aβ斑块的结合作用Fig.5 12B4-scFv bind to Aβ plaques in brain of AD model mice
2.5scFv能够与AD模型小鼠脑中Aβ斑块结合 我们取9月龄 APP/PS1 AD模型小鼠的脑组织,并制备组织切片。以12B4-scFv为一抗,anti-His单克隆抗体为二抗,进行免疫组化实验。结果如图5所示。12B4-scFv能够与AD模型鼠脑中海马区Aβ斑块相结合,具有治疗潜力。
3 讨论
AD的发病机制复杂且至今未明确,目前尚无一种有效的治疗手段能够延缓AD的疾病进程[3]。淀粉级联假说指出,Aβ在脑中的异常分泌和产生过多,使其在脑组织内沉积,对周围的突触和神经元具有毒性作用,可破坏突触膜,最终引起神经细胞死亡[14]。Aβ的沉积还会导致AD的其他病理变化,如微管结合蛋白的过度磷酸化等,是AD发病的核心环节[15]。减少Aβ的形成,抑制Aβ的沉积,是最可能治疗AD的有效途径。
在过去的十几年中,Aβ免疫疗法逐渐发展起来。AN1792是第一个进入临床的AD主动免疫疗法,其以全长的Aβ42为免疫原进行了临床试验,但不幸的是这种主动免疫会引起T细胞免疫反应,导致6%的受试者产生了脑膜脑炎反应,最终该临床实验因安全性问题而失败[16]。虽然临床试验以失败告终,但结果显示,相比于对照组,Aβ的免疫治疗能够减少患者脑中Aβ沉积,并改善生活障碍。因此,如果能够避免主动免疫的副作用,Aβ免疫疗法依旧充满希望[17,18]。此后,以Aβ为靶点的被动免疫疗法发展起来,直接向人体注射靶向不同Aβ形式的抗体,具有靶点精确,起效快速,副作用小等特点。很多以Aβ为靶点的被动免疫疗法进入了临床试验,并取得了一定的治疗效果[19]。但是由于全抗体存在抗体恒定区片段,易引发炎症反应,并且具有分子量较大、血脑屏障透过率低等缺点,其在AD的治疗领域中的应用依旧存在安全性与有效性的问题。scFv由于其分子量小,不含有恒定区片段,大大增加了抗体治疗的安全性与有效性,成为AD被动免疫治疗的新方向[20]。
本研究在Aβ免疫疗法的基础上,对靶向Aβ3-7的抗体12B4进行了改造,成功表达纯化了其12B4-scFv。该scFv能够与Aβ单体、寡聚体、纤维很好地结合,并能够有效抑制Aβ寡聚体与纤维的形成。此外,该scFv还能抑制Aβ寡聚体产生的细胞毒性,能够与AD模型鼠脑中产生的斑块相结合,具有非常好的体外活性。12B4-scFv避免了Aβ免疫疗法目前存在的安全性与有效性的问题。此外,其体外功能的研究更揭示了抗体清除体内Aβ的作用机制。在下一步的实验中,我们将会利用12B4-scFv对不同年龄段的AD模型鼠进行治疗,进一步探究12B4-scFv对AD模型小鼠的神经保护作用,为阿尔茨海默症的新型抗体疗法奠定基础。