当归多糖通过调节p38通路抑制宫颈癌Hela细胞生长、迁移和侵袭①
2020-02-20唐治蓉龙琼先刘欣雅廖文华张旭乾王胜岚南充市中心医院病理科南充637000
唐治蓉 龙琼先 刘欣雅 廖文华 张旭乾 王胜岚 (南充市中心医院病理科,南充 637000)
宫颈癌也称子宫颈癌,是常见的发生在子宫阴道部及宫颈管的妇科恶性肿瘤,是继乳腺癌之后的女性健康第二杀手[1]。目前,每年我国诊断出宫颈癌新发病例将近一百万,年死亡率高达30%以上,其发病率和死亡率还在急剧上升[2]。宫颈癌主要以手术、化疗、放疗三大方式治疗,治疗药物主要是顺铂等,但这些治疗药物存在毒副作用大、容易让患者产生耐药性等缺陷,因此,找到新的宫颈癌治疗药物是迫切需要解决的问题[3]。当归多糖(angelica polysaccharide,AP)是中药当归的主要水溶成分,具有明显地改善血液系统、免疫促进、抗肿瘤等广泛的药理活性[4]。已有研究证明,当归多糖能够抑制宫颈癌Hela细胞的增殖并诱导这些细胞凋亡[5],但当归多糖对宫颈癌Hela细胞迁移和侵袭的机制尚不清楚。p38通路参与调节细胞的生长、分化、分裂、死亡等,其以正调节的方式参与了肿瘤的发生、侵袭及转移[6]。本文主要研究当归多糖通过p38通路对宫颈癌Hela细胞生长、迁移和侵袭的影响,以期为宫颈癌的治疗提供参考数据。
1 材料与方法
1.1材料 4~6周龄,体重18~22 g雌性BALB/c裸鼠50只,购自成都达硕实验动物有限公司,生产许可证:SCXK(川)2015-030。宫颈癌Hela购自中国科学院细胞库,RPMI1640培养液(上海栩冉生物科技有限公司),胎牛血清(素尔生物科技有限公司),当归多糖(西安雨泽生物科技有限公司),顺铂(浙江联硕生物科技有限公司),SB203580(百奥莱博生物科技有限公司),RIPA裂解缓冲液(南京海克尔生物科技有限公司),BCA试剂盒(上海易色医疗科技有限公司),p-p38抗体和p38抗体(沈阳万类生物科技有限公司),MMP-2抗体(上海户实医药科技有限公司),MMP-9抗体(上海沪峥生物科技有限公司),二抗(维奥生物科技有限公司),ECL化学发光底物(上海恒斐生物科技有限公司)。
1.2方法
1.2.1动物分组处理 裸鼠饲养在SPF级动物实验室,实验前适应1周。在超净工作台内于每只裸鼠右后肢皮下注射0.2 ml(2×107个/L)的宫颈癌Hela细胞悬液,用游标卡尺测量皮下肿瘤体积,7 d后所有裸鼠均出现大于100 mm3的皮下结节,表明移植瘤模型构建成功。将50只造模成功的裸鼠随机分为5组:模型组、阳性对照组(2 mg/kg顺铂),低、中、高剂量当归多糖组(30 mg/kg、100 mg/kg、300 mg/kg)[7],每组10只,每天腹腔给药0.2 ml,连续21 d。脱颈法处死所有裸鼠,完整剥离移植瘤,测量移植瘤体积及质量,计算抑瘤率。抑瘤率=(1-实验组移植瘤重量/模型组移植瘤重量)×100%。治疗期间实验组裸鼠死亡超过20%(2 只)或平均体质量(去瘤后)下降>15%则认为药物具有毒性。
1.2.2细胞培养及分组处理 宫颈癌Hela细胞在37℃、5%CO2条件下,于含有10%胎牛血清的RPMI1640培养基中培养。实验设置宫颈癌Hela组,阳性对照组,当归多糖低、中、高剂量组,SB203580组,当归多糖高剂量+SB203580组,其中宫颈癌Hela组细胞用正常培养基培养,阳性对照组细胞用含有10 μmol/L顺铂的培养基培养,当归多糖低、中、高剂量组细胞分别用含有100、200、400 mg/L 当归多糖的培养基培养[8],SB203580组细胞用含有10 μmol/L SB203580的培养基培养,当归多糖高剂量+SB203580组用含有400 mg/L当归多糖和10 μmol/L SB203580的培养基培养。
1.2.3MTT检测细胞生长情况 细胞按照1×104个/孔的密度接种于96孔板,分别用各组培养基制成单细胞悬液,置于 37℃ 5%CO2的条件下培养。每组设5个复孔,待细胞长至 50%融合时,分别于转染后0、12、24、36、48 h 加入20 μl MTT 溶液,再培养4 h,弃上清后加入150 μl DMSO,于酶标仪490 nm 处检测OD值。
1.2.4划痕实验检测细胞迁移能力 将各组宫颈癌Hale细胞消化铺满单层后用小号枪头垂直划痕,加入无血清培养基,在5%CO2、37℃恒温的培养箱培养24 h后,分别在显微镜下拍照,用 Image J 软件分析。
1.2.5Transwell检测细胞侵袭情况 将细胞以无血清培养液培养24 h后,用0.25%胰蛋白酶消化细胞并传代接种于用Matrigel预处理的Transwell小室中,细胞终浓度为3×105个/ml。小室上层加入无血清培养液培养细胞,下层则加入含血清的各组培养液。48 h后用无菌棉签擦去小室上层细胞,下层细胞HE染色后计数统计。
1.2.6Western blot检测p-p38和p38、MMP-2和MMP-9蛋白表达水平 用RIPA裂解液提取培养3 d 的各组细胞总蛋白。用BCA试剂盒检测总蛋白浓度,10%SDS-PAGE分离蛋白后用半干转膜仪转移蛋白质至PVDF膜。用5%脱脂牛奶室温封闭蛋白2 h,随后加入一抗(p-p38 1∶500、p38 1∶1 000、MMP-2 1∶500、MMP-9 1∶500)于4℃封闭过夜,第二天加入对应二抗室温封闭1 h,最后滴ECL进行曝光。
2 结果
2.1当归多糖抑制宫颈癌移植瘤的发展 实验结束时,各组裸鼠均无死亡。与模型组相比,阳性对照组和当归多糖裸鼠移植瘤重量和体积均明显减少,抑瘤率明显增加,均具有统计学意义(P<0.05,P<0.01,图1),且当归多糖各组随着当归多糖剂量的增加,抑制效果越明显,这说明当归多糖呈剂量依赖性抑制宫颈癌移植瘤的发展。
2.2当归多糖抑制宫颈癌Hela细胞的生长 通过MTT检测细胞生长情况可知:与宫颈癌Hela组相比,阳性对照组和当归多糖各组Hela细胞的生长受到不同程度抑制,均具有统计学意义(P<0.01,图2),且当归多糖各组随着当归多糖剂量的增加,抑制效果越明显,这说明当归多糖呈剂量依赖性抑制宫颈癌Hela细胞的生长。
2.3当归多糖抑制宫颈癌Hela细胞的侵袭和迁移 通过划痕实验检测细胞迁移能力发现:与宫颈癌Hela组相比,阳性对照组和当归多糖各组Hela细胞的迁移能力受到不同程度抑制,划痕闭合率明显降低,均具有统计学意义(P<0.01,图3A),且当归多糖各组随着当归多糖剂量的增加,抑制效果越明显,这说明当归多糖呈剂量依赖性抑制宫颈癌Hela细胞的迁移。
通过Transwell检测细胞侵袭情况发现:与宫颈癌Hela组相比,阳性对照组和当归多糖各组Hela细胞的侵袭细胞数目明显降低,均具有统计学意义(P<0.01,图3B),且当归多糖各组随着当归多糖剂量的增加,降低程度越明显,这说明当归多糖呈剂量依赖性抑制宫颈癌Hela细胞的侵袭。
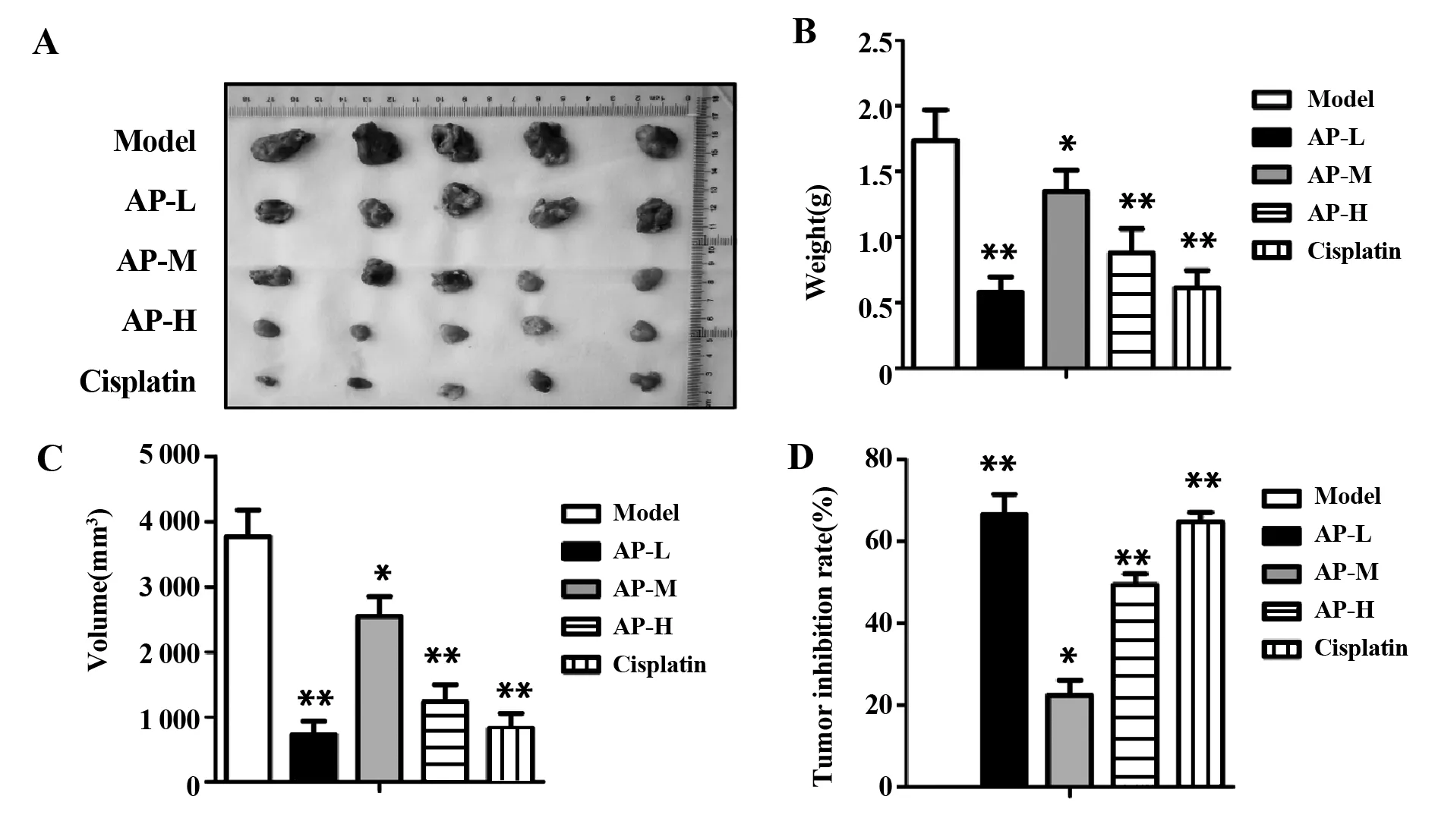
图1 当归多糖抑制宫颈癌移植瘤的发展
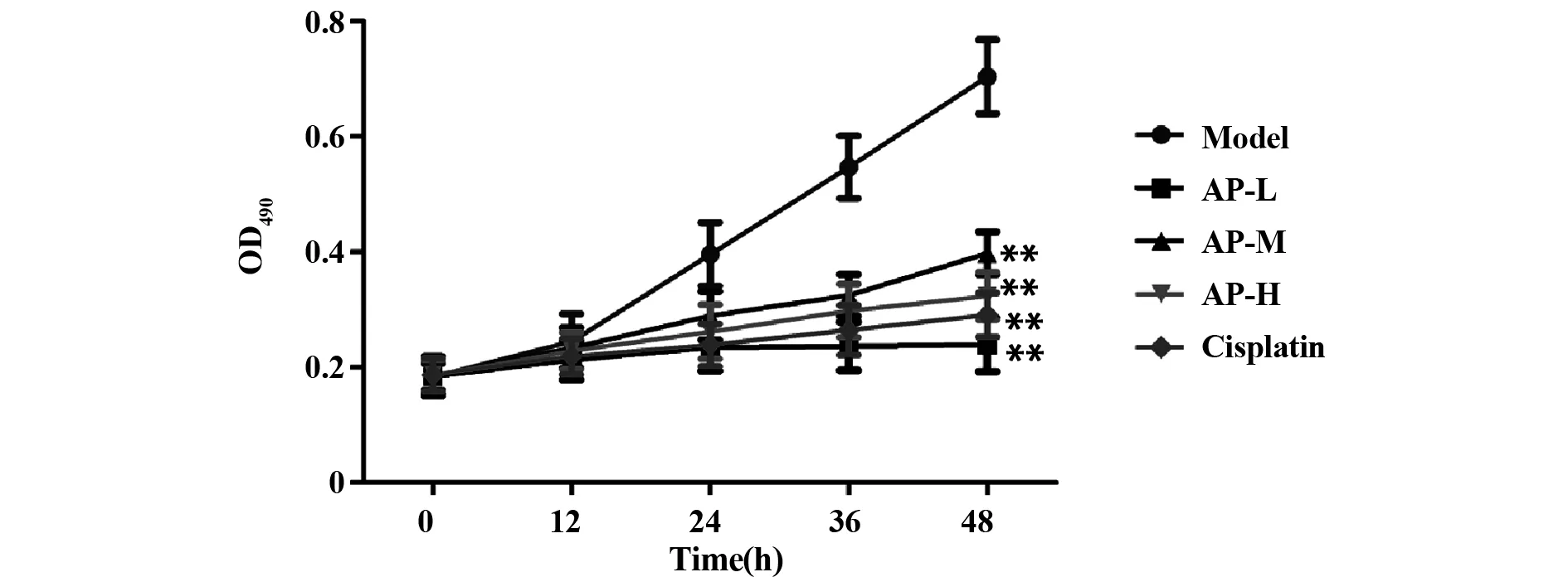
图2 MTT检测Hela细胞生长情况
2.4当归多糖抑制宫颈癌Hela细胞p38通路 通过Western blot检测 p-p38/p38、MMP-2和MMP-9蛋白表达水平可知:与宫颈癌Hela组相比,阳性对照组和当归多糖各组Hela细胞的p-p38/p38、MMP-2和MMP-9蛋白表达水平明显下调,均具有统计学意义(P<0.01,图4),且当归多糖各组随着当归多糖剂量的增加,下调程度越明显,这说明当归多糖呈剂量依赖性抑制宫颈癌Hela细胞的p38通路。
2.5当归多糖通过调节p38通路抑制宫颈癌Hela细胞的生长、侵袭和迁移 加入p38通路抑制剂SB203580后,通过Western blot检测p-p38/p38、MMP-2和MMP-9蛋白表达水平发现:与宫颈癌Hela组相比,SB203580组和当归多糖高剂量组细胞p-p38/p38、MMP-2和MMP-9蛋白表达明显下调,且具有统计学意义(P<0.01,图5),说明SB203580和当归多糖都能抑制p38通路下游蛋白p-p38/p38、MMP-2和MMP-9表达;与当归多糖高剂量组相比,当归多糖高剂量+ SB203580组细胞p-p38/p38、MMP-2和MMP-9蛋白表达明显下调,且具有统计学意义(P<0.01,图5)。
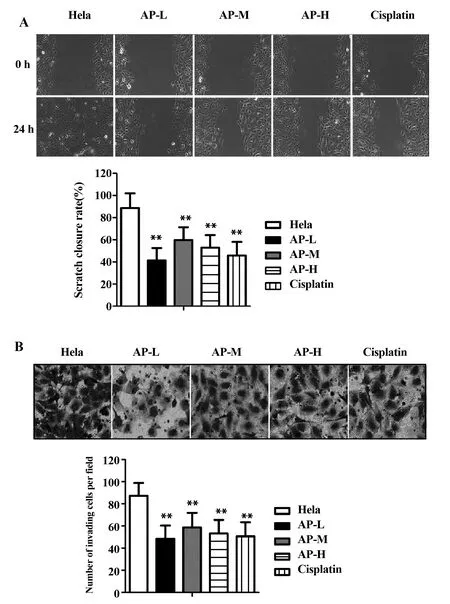
图3 各组Hela细胞迁移和侵袭能力
加入p38通路抑制剂SB203580后,通过MTT检测细胞生长情况可知:与宫颈癌Hela组相比,SB203580组和当归多糖高剂量组细胞生长情况明显被抑制,且具有统计学意义(P<0.01,图6),说明SB203580和当归多糖都能抑制宫颈癌Hela细胞生长;与当归多糖高剂量组相比,当归多糖高剂量+SB203580组细胞生长情况明显被抑制,且具有统计学意义(P<0.01,图6),说明当归多糖通过调节p38通路抑制宫颈癌Hela细胞生长。
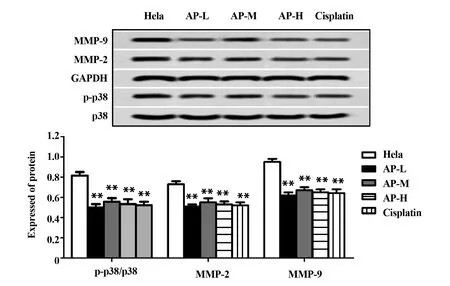
图4 Western Blot检测 p-p38/p38、MMP-2和MMP-9蛋白表达水平
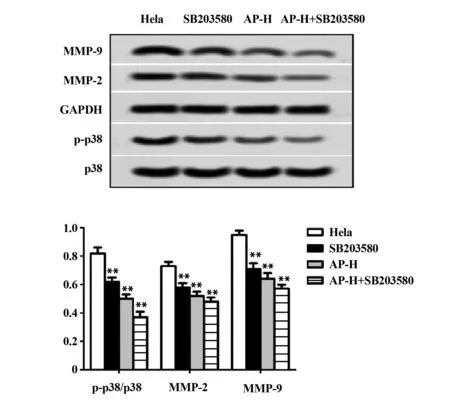
图5 加入p38通路抑制剂后,Western Blot检测p-p38/p38、MMP-2和MMP-9蛋白表达水平
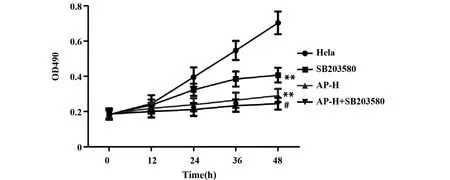
图6 加入p38通路抑制剂后,通过MTT检测细胞生长情况
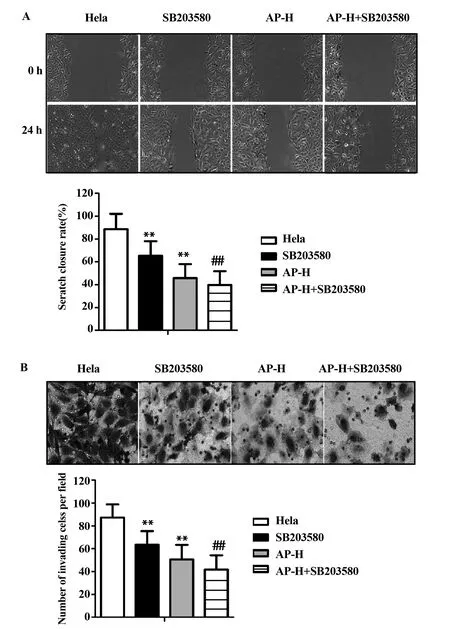
图7 加入p38通路抑制剂后,各组细胞迁移和侵袭能力
加入p38通路抑制剂SB203580后,通过划痕实验检测细胞迁移能力发现:与宫颈癌Hela组相比,SB203580组和当归多糖高剂量组细胞迁移速度明显被抑制,划痕闭合率明显降低,且具有统计学意义(P<0.01,图7A),说明SB203580和当归多糖都能抑制宫颈癌Hela细胞迁移;与当归多糖高剂量组相比,当归多糖高剂量+ SB203580组细胞迁移速度明显被抑制,划痕闭合率明显降低,且具有统计学意义(P<0.01,图7A),说明当归多糖通过调节p38通路抑制宫颈癌Hela细胞迁移。
加入p38通路抑制剂SB203580后,通过Transwell检测细胞侵袭情况发现:与宫颈癌Hela组相比,SB203580组和当归多糖高剂量组侵袭细胞数目明显减少,且差异具有统计学意义(P<0.01,图7B),说明SB203580和当归多糖都能抑制宫颈癌Hela细胞侵袭;与当归多糖高剂量组相比,当归多糖高剂量+ SB203580组侵袭细胞数目明显减少,且具有统计学意义(P<0.01,图7B),说明当归多糖通过调节p38通路抑制宫颈癌Hela细胞侵袭。
3 讨论
宫颈癌是一种严重危害妇女健康和生命的生殖系统恶性肿瘤。据统计,全世界宫颈癌死亡约85%是发生在不发达国家或发展中国家,而我国宫颈癌患者已占到全球病例的 28%以上,同时每天大约 5 万左右的患者死于该病[9]。而宫颈癌的常规治疗手段虽具有一定效果,但是存在较多副作用和并发症。因此,为了更好的治疗宫颈癌,急需发现新药物。当归是伞形科植物当归的根,药性甘、辛、温,具有活血、补血、润肠、调经、止痛等功效,是临床最为常用的药物,素有“十方九归”之说[10]。当归多糖是中药当归的主要活性成分之一,具有调经、补血、消炎、抗菌、镇痛、提高机体免疫及抗肿瘤等药理作用。已发现当归多糖对乳腺癌、肝癌、人神经母细胞瘤等肿瘤细胞增殖、迁移和侵袭具有抑制作用[11,12],因此,当归多糖有望抑制宫颈癌Hela细胞的生长、迁移和侵袭。本文通过研究发现当归多糖呈剂量依赖性抑制宫颈癌移植瘤的发展,并抑制宫颈癌Hela细胞的生长、迁移和侵袭。
局部侵袭和远处迁移是临床治疗宫颈癌的主要限制因素,也是导致癌症患者治疗失败和死亡的主要原因之一。因此,降低宫颈癌细胞的迁移和侵袭能力可以增强宫颈癌治疗效果。本文研究表明当归多糖呈剂量依赖性抑制宫颈癌细胞的侵袭和迁移能力。p38信号通路对宫颈癌细胞的生长、迁移和侵袭等具有重要的调节作用。本文研究发现,当归多糖能够降低p38磷酸化水平,说明当归多糖能够下调p38通路。已有Li等[13]报道槐耳水提取物通过p38途径抑制宫颈癌细胞增殖,Wu等[14]发现苦参碱通过下调p38信号通路抑制人宫颈癌细胞的转移特性,因此,下调p38信号通路有望抑制宫颈癌细胞生长、迁移和侵袭。同苦参碱有效抑制Hela细胞的黏附和侵袭与其通过抑制p38信号通路的活性进一步调节MMP-2和MMP-9的表达有关一样[15],本文发现当归多糖在与p38信号通路抑制剂SB203580联合应用后,显著增强了其对MMP-2和MMP-9的蛋白表达的下调作用及对宫颈癌Hela细胞的生长、迁移和侵袭的抑制作用,提示其对宫颈癌Hela细胞生长、迁移和侵袭的抑制作用是通过调节p38信号通路的活性进一步调节MMP-2和MMP-9的表达来实现的。且已有研究表明,p38 MAPK促进肿瘤细胞迁移和侵袭的机制之一是MMPs的上调,激活p38信号通路能够有效增强下游如MMP-2和MMP-9等多种靶点的表达与活化[16]。而恶性肿瘤的侵袭和转移过程主要受蛋白水解酶的表达调控,肿瘤细胞浸润和转移能力与蛋白酶的产生程度密切相关[17]。基质金属蛋白酶是肿瘤细胞完成转移侵袭的主要蛋白酶,其中以MMP-2 和MMP-9研究最多[18]。MMP-2 和MMP-9的表达升高后,宫颈癌细胞的迁移和侵袭能力明显增强;MMP-2 和MMP-9的表达受到抑制之后,宫颈癌细胞的迁移和侵袭能力明显抑制[19]。
综上所述,本文研究发现当归多糖能够有效抑制宫颈癌Hela细胞的生长、迁移和侵袭,这种抑制作用可能是通过下调p38信号通路活性,进一步抑制MMP-2和MMP-9表达来实现的。这为当归的开发利用提供参考数据,为宫颈癌的治疗奠定基础,本文后续将研究当归多糖对宫颈癌作用的分子机制。