羽扇豆醇缓解氧化应激对心肌缺血再灌注大鼠心脏功能和心肌组织的保护作用①
2020-02-20崔勤涛王俊华刘晓晨王学惠苏国宝新乡医学院第一附属医院心血管外科新乡453000
崔勤涛 王俊华 刘晓晨 王学惠 苏国宝 (新乡医学院第一附属医院心血管外科,新乡 453000)
冠心病是由动脉粥样硬化引起的血管狭窄/阻塞,导致心肌缺血缺氧型心脏病,其发病的主要原因为心肌缺血[1,2],冠状动脉经皮介入是目前治疗冠心病手段之一,但同时也伴随着心肌缺血再灌注损伤(myocardial ischemia-reperfusion injury,MI/RI)。MI/RI病理学表现为心肌组织排列紊乱、胞外基质沉积增加、心肌组织损伤,从而引起心率失常,严重时可诱发猝死[3]。羽扇豆醇是三萜烯,存在于食用植物以及中草药中,动物研究证实羽扇豆醇具有抗炎症、抗氧化以及促进伤口愈合的作用,并且对前列腺癌、乳腺癌以及黑色素瘤等有抑制作用。有研究显示羽扇豆醇可以改善脑缺血再灌注大鼠的氧化应激损伤并减轻炎症反应[4],但羽扇豆醇在心肌缺血再灌注方面的氧化应激研究报道较少,因此,本研究通过制备大鼠MI/RI模型来探讨羽扇豆醇对心肌缺血再灌注大鼠心脏功能、心肌损伤以及氧化应激作用的影响,为临床治疗心肌缺血再灌注患者方案选择提供动物实验依据。
1 材料与方法
1.1材料
1.1.1试剂 Caspase-3免疫组化剂盒(货号:IH-0081R,上海雅吉生物科技有限公司)、羽扇豆醇(CAS号:545-47-1;上海源叶生物科技有限公司)、TRIzol RNA提取试剂盒(货号:BTN71201-WJU,北京百奥莱博科技有限公司)、地尔硫卓(CAS号:42399-41-7;上海晶都生物技术有限公司)、CK-Mb(货号:QY-BM11392,上海乔羽生物科技有限公司)、Mb(货号:0-027530,上海江莱生物科技有限公司)、cTnI(货号:BS-E12272R1,广州徕智生物科技有限公司)、TNF-α(货号:QY-BM10200,上海乔羽生物科技有限公司)、IL-1β(货号:YAD23684S,北京杰辉博高生物技术有限公司)、iNOS[货号:JK-(a)-1607,上海晶抗生物工程有限公司]、IL-6[货号:JK-(a)-0023,上海晶抗生物工程有限公司]、MDA(货号:0-100860,上海将来实业股份有限公司),SOD[货号:JK-(a)-1752,上海晶抗生物工程有限公司],LDH(货号:YM-QP11477,上海远慕生物科技有限公司)、Nrf1、PGC-1α、TFAM抗体购于武汉博欧特生物科技有限公司。
1.1.2仪器 冷冻离心机(CTK48,湖南湘仪实验室仪器开发有限公司)、荧光显微镜(Ti2-U,NIKON)、小动物呼吸机(R407,深圳市瑞沃德生命科技有限公司)、切片机(HM 340E,赛默飞)、超低温冰箱(Forma 700,赛默飞)、多功能酶标仪(SpectraMax Paradigm,美谷分子仪器上海有限公司)。
1.2方法
1.2.1动物饲养及分组 4~5周龄的SPF级SD雄性健康大鼠90只,体质量(190±20)g,购于成都达硕实验动物有限公司,生产许可证号为SCXK(川)2015-030,购回饲养1周,饲养环境温度20~25℃,湿度40%~50%,人工光照(12 h/昼、12 h/夜),全天自由饮水。将90只SD大鼠随机均分为6组,分别为健康对照组(Ctrl)、模型组(I/R)、阳性对照组(Diltia)、10 mg/kg Lupeol组、20 mg/kg Lupeol组、50 mg/kg Lupeol组,Diltia组与Lupeol组SD大鼠分别灌胃5 mg/kg地尔硫卓、10 mg/kg羽扇豆醇、20 mg/kg羽扇豆醇、50 mg/kg羽扇豆醇,1次/d,连续灌胃1周,健康对照组与I/R模型大鼠灌胃等体积的生理盐水,连续灌胃1周。
1.2.2模型构建 MI/RI大鼠模型制备:采取结扎左冠状动脉前降支方法制备大鼠MI/RI模型,腹腔注射1%戊巴比妥钠麻醉,取仰卧位固定头部、四肢于手术台,连接心电电极并监测Ⅱ导联心电图、小动物呼吸机(呼吸频率70次/min,潮气量9 ml/kg,呼吸比1∶2),左侧第3~4肋间处剪开大鼠皮肤,分离肌肉组织、打开胸腔、分离心包膜、轻挤压胸廓、暴露心脏,从左心耳、肺动脉圆锥间找出冠状动脉左前降支。5/0号带弯钩尼龙缝线结扎分支起点外,在结扎时尼龙缝线与心肌间放置一根约1 cm细长棉线,此时缺血心肌表现出发绀、膨出迹象,心电图有2个以上ST段抬高,T波高耸,或者QRS波增高增宽与T融合,表明心肌缺血形成,结扎30 min后松开结扎线,心电图ST段恢复或与缺血前水平相似,表明大鼠缺血再灌注模型建立成功。其中结扎前心电图异常,未观察至终点就死亡以及造模不成功的大鼠剔除。Ctrl组大鼠不做任何处理。
1.2.3观察指标 再灌注120 min时,采用超声心动图检查各组大鼠左心室射血分数(LVEF)、左心室短轴缩短率(FS)、左心室壁厚度(LVWT)、心率(HR)、左心室收缩压(LVSP)水平,各组大鼠心脏功能指标记录结束后,抽取各组大鼠股动脉血5 ml,3 000 r/min 离心15 min,取上层血清并储存于-80℃,用于肌酸激酶同工酶(CK-Mb)、Mb、心肌肌钙蛋白I(cTnI)的含量、肿瘤坏死因子-α(TNF-α)、IL-1β、一氧化氮合酶(iNOS)以IL-6、丙二醛(MDA)、超氧化物歧化酶(SOD)、乳酸脱氢酶(LDH)含量检测。再灌注120 min后,麻醉处死大鼠,取出心脏组织,一部分固定于10%甲醛中性溶液中,用于HE染色以及免疫组化实验,一部分心脏组织储存于-80℃,用于RT-PCR以及Western blot检测。
1.2.4HE切片染色及免疫组化 取置于10%甲醛中性溶液中的心脏组织,经脱水、透明、浸蜡、包埋,5 μm切片,一部分用于HE染色,切片后进行脱蜡、复水、HE染色、再次脱水及透明,中性树胶封片,光镜下观察心肌细胞形态结构变化。另一部分用于免疫组化,切片脱蜡与复水,PBS浸泡5 min,微波抗原修复,3%H2O2孵育15 min以消除过氧物酶活性,按照试剂盒说明书操作进行,加入DAB显色,封片图像采集。
1.2.5Western blot 提取心脏组织蛋白,调整蛋白质浓度保持一致,经过SDS-PAGE电泳,将膜转移至PVDF膜,加入Nrf1、PGC-1α、TFAM、β-actin一抗,于4℃条件下孵育过夜,再用TBST漂洗40 min,分为3次漂洗,再加入经HRP标记的二抗继续孵育1 h,根据ECL试剂盒说明书对蛋白条带进行显影、定影,观察各组蛋白条带成像情况,并进行蛋白条带分析。
1.2.6RT-PCR 采用TRIzol试剂盒提取组织total RNA,依据cDNA反转录试剂盒说明书反转录第一条链cDNA,用SYBR PCR Master Mix用于RT-PCR,PCR程序设置参考试剂盒说明书,文章用所用引物设计及合成均由Sangon Biotech公司完成。

2 结果
2.1各组大鼠心脏功能及超声心动图检查结果比较 与I/R组相比,Ctrl组、Diltia组、20 mg/kg Lupeol组以及50 mg/kg Lupeol组的HR、LVSP、LVEF、FS以及LVWT均增加(P<0.05),而10 mg/kg Lupeol组大鼠的HR、LVSP、LVEF、FS以及LVWT与Ctrl组的差异比较无统计学意义(P>0.05),见表1。
2.2各组大鼠CK-Mb、Mb、cTnI含量比较 与I/R组相比,Ctrl组、Diltia组、20 mg/kg Lupeol组以及50 mg/kg Lupeol组的CK-Mb、Mb、cTnI含量均降低(P<0.05),而10 mg/kg Lupeol组大鼠的CK-Mb、Mb、cTnI含量与Ctr组的差异比较无统计学意义(P>0.05),见表2。
2.3羽扇豆醇对MI/RI大鼠心肌组织损伤的保护作用 采用HE染色观察各组大鼠心肌组织损伤情况,结果显示Ctrl组大鼠心肌组织细胞排列规则紧密、心肌纤维无变形现象且分布均匀;I/R组大鼠心肌组织细胞心肌纤维排列紊乱,胞质间水肿现象明显;Lupeol组大鼠心肌组织细胞损伤程度逐渐减轻,其中 Lupeol 50 mg/kg时的细胞损伤程度最小;Diltia组大鼠心肌细胞的损伤程度明显低于I/R模型组,见图1。采用RT-PCR检测各组大鼠心肌组织中Ki67、Survivin表达量,结果显示,与I/R组相比,Ctrl组、Diltia、20 mg/kg Lupeol组以及50 mg/kg Lupeol组心肌组织中的Ki67、Survivin mRNA含量增加(P<0.05),而10 mg/kg Lupeol组大鼠心肌组织中的Ki67、Survivin mRNA含量与Ctrl组差异无统计学意义(P>0.05),见表3。采用免疫组化检测各组大鼠心肌组织中Caspase-3水平,结果显示,Diltia组、20 mg/kg Lupeol组以及50 mg/kg Lupeol组心肌组织中的Caspase-3阳性率明显低于I/R组(P<0.05),而10 mg/kg Lupeol组Caspase-3阳性率与I/R组差异无统计学意义(P>0.05),见图2、表3。

GroupsDosage(mg/kg)HR(beat/min)LVSP(mmHg)LVEF(%)FS(%)LVWT(mm)Ctrl-414.87±35.161)135.37±21.291) 58.05±11.281)28.12±6.930.85±0.061)I/R -207.21±26.5257.02±12.1723.37±8.458.05±1.890.52±0.04Lupeol 10213.12±28.6162.13±14.5425.92±7.369.49±2.010.54±0.0520298.19±38.541) 93.36±10.421) 39.16±6.421)15.05±3.731)0.73±0.071)50349.21±35.491)127.07±9.271) 49.93±8.391)24.46±5.921)0.90±0.051)Diltia5275.64±22.931) 99.58±12.141) 42.03±7.481)20.01±4.141)0.74±0.06
Note:1)P<0.05 compared with the I/R group.

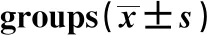

GroupsDosage(mg/kg)CK-Mb(U/L)Mb(ng/ml)cTnI(ng/ml)Ctrl- 21.27±7.381)27.08±8.391)0.12±0.021)I/R -114.25±11.23148.16±14.450.65±0.03Lupeol 10108.74±12.77137.38±18.540.63±0.0620 75.12±10.531) 89.23±11.421)0.29±0.041)5028.52±9.071) 45.26±5.381)0.16±0.031)Diltia537.76±5.981) 58.01±8.071)0.26±0.051)
Note:1)P<0.05 compared with the I/R group.
2.4各组大鼠TNF-α、 IL-1β、 iNOS以及IL-6含量比较 与I/R组相比,Ctrl组、Diltia组、20 mg/kg Lupeol组以及50 mg/kg Lupeol组的TNF-α、IL-1β、iNOS以及IL-6含量均降低(P<0.05),而10 mg/kg Lupeol组大鼠的TNF-α、IL-1β、iNOS以及IL-6含量与Ctrl组的差异无统计学意义(P>0.05),见表4。
2.5各组大鼠MDA、SOD、LDH含量比较 与I/R组相比,Ctrl组、Diltia组、20 mg/kg Lupeol组以及50 mg/kg Lupeol组的MDA含量均降低(P<0.05),SOD、LDH活性增加(P<0.05),而10 mg/kg Lupeol组大鼠的MDA含量、SOD、LDH活性与Ctrl组的差异无统计学意义(P>0.05),见表5。
2.6各组大鼠Nrf1、PGC-1α、TFAM水平比较 与I/R组相比,Ctrl组、Diltia组、20 mg/kg Lupeol组以及50 mg/kg Lupeol组的Nrf1、PGC-1α、TFAM水平增加(P<0.05),而10 mg/kg Lupeol组大鼠的Nrf1、PGC-1α、TFAM水平与Ctrl组比较,差异无统计学意义(P>0.05),见表6、图3。

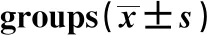
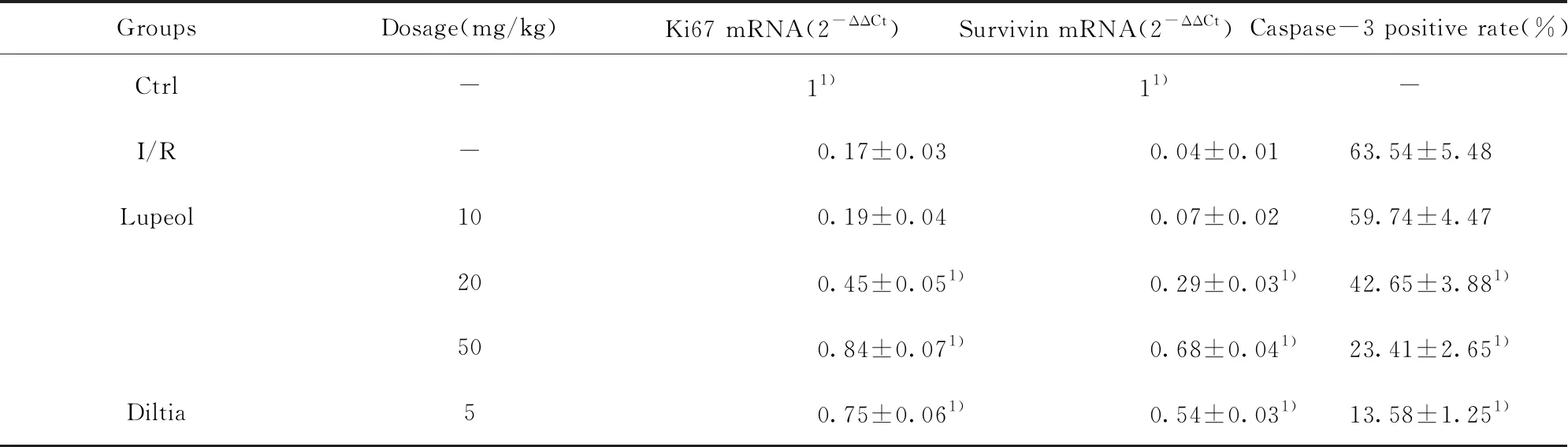
GroupsDosage(mg/kg)Ki67 mRNA(2-ΔΔCt)Survivin mRNA(2-ΔΔCt)Caspase-3 positive rate(%)Ctrl-11)11)-I/R -0.17±0.030.04±0.0163.54±5.48Lupeol 100.19±0.040.07±0.0259.74±4.47200.45±0.051)0.29±0.031)42.65±3.881)500.84±0.071)0.68±0.041)23.41±2.651)Diltia50.75±0.061)0.54±0.031)13.58±1.251)
Note:1)P<0.05 compared with the I/R group.

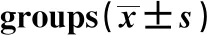

GroupsDosage(mg/kg)TNF-α(pg/ml)IL-1β(pg/ml)iNOS(pg/ml)IL-6(pg/ml)Ctrl- 45.16±7.341) 37.42±0.091)54.64±8.821)14.17±4.171)I/R -144.64±16.54176.79±21.25231.42±29.4889.73±13.68Lupeol 10139.48±19.62169.66±25.34226.43±25.6685.69±11.3120 96.35±12.141) 107.01±18.121) 145.62±15.281)57.36±9.051)50 53.48±9.441) 63.55±9.171) 79.38±8.441)26.21±6.531)Diltia5 62.53±10.261) 58.68±11.141) 98.06±13.541)38.32±7.281)
Note:1)P<0.05 compared with the I/R group.

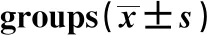

GroupsDosage(mg/kg)MDA(mmol/ml)SOD(U/ml)LDH(U/L)Ctrl-2.15±0.311)11.03±1.611)896.39±125.041)I/R -5.72±0.543.58±0.572 371.01±284.12Lupeol 105.68±0.463.54±0.762 291.42±219.48203.52±0.351)7.14±0.441)1 732.39±165.281)502.44±0.521)10.05±0.821)1 023.48±127.131)Diltia52.83±0.431)6.04±0.611)1 648.03±150.941)
Note:1)P<0.05 compared with the I/R group.

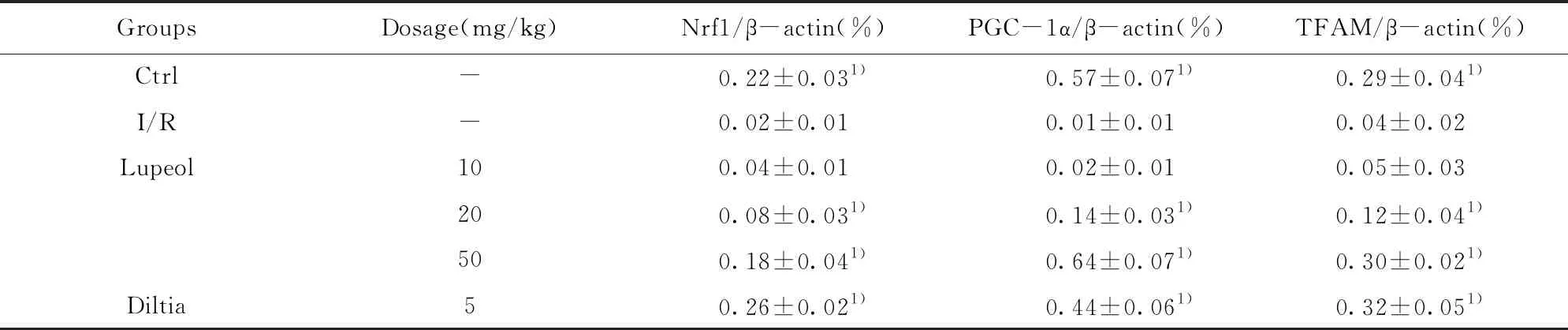
GroupsDosage(mg/kg)Nrf1/β-actin(%)PGC-1α/β-actin(%)TFAM/β-actin(%)Ctrl-0.22±0.031)0.57±0.071)0.29±0.041)I/R -0.02±0.010.01±0.010.04±0.02Lupeol 100.04±0.010.02±0.010.05±0.03200.08±0.031)0.14±0.031)0.12±0.041)500.18±0.041)0.64±0.071)0.30±0.021)Diltia50.26±0.021)0.44±0.061)0.32±0.051)
Note:1)P<0.05 compared with the I/R group.
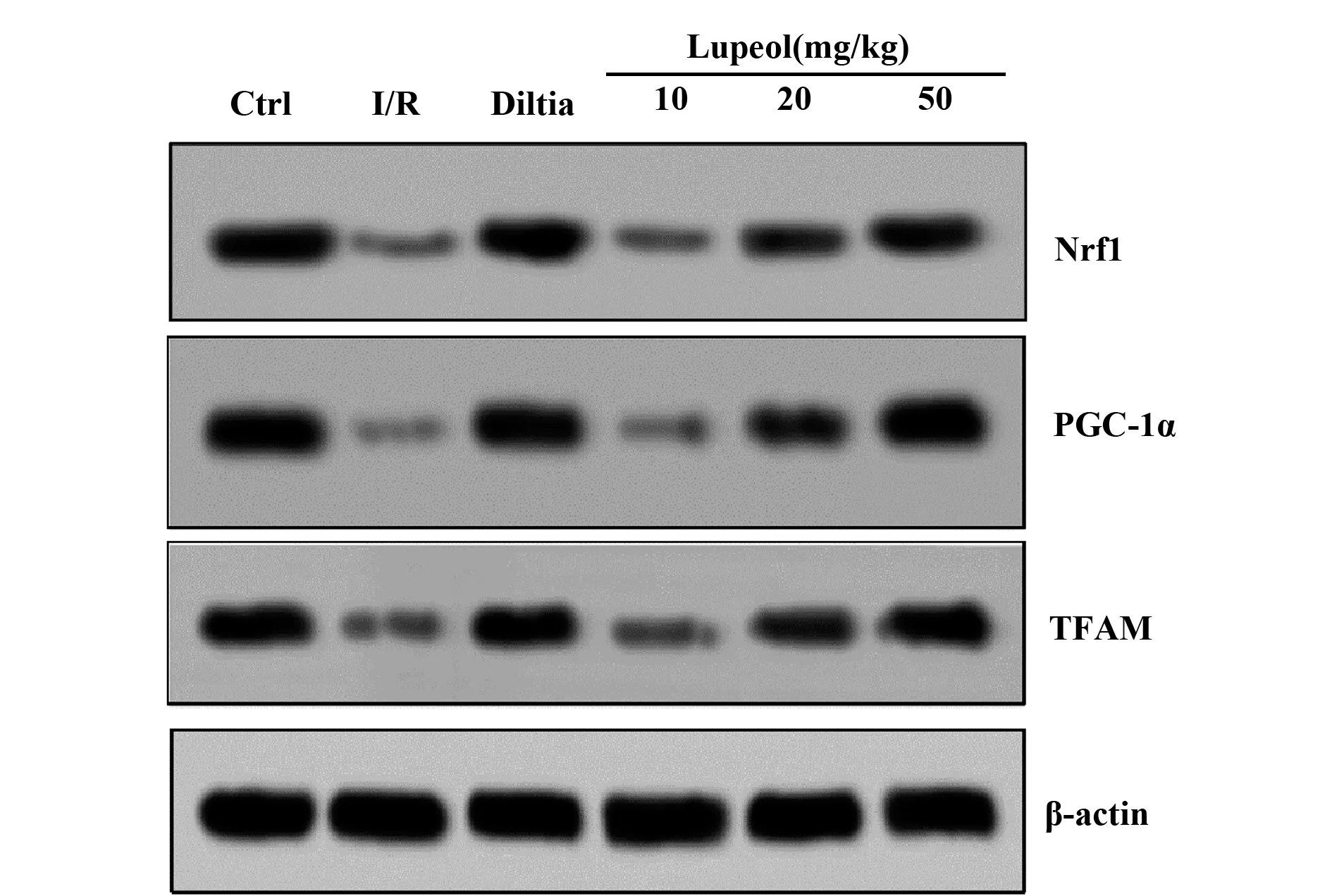
图3 各组大鼠心肌组织Nrf1、PGC-1α、TFAM凝胶成像结果(×200)
3 讨论
再灌注是治疗冠心病急性心肌梗死的重要方式之一,可以快速打开患者堵塞血管并恢复患者冠状脉血供。虽然再灌注治疗在冠心病救治方面取得一定效果,但其也只限于局部治疗,不能有效阻止冠心病的病理进程,治疗后也会出现MI/RI心肌损伤,导致冠心病患者的治疗效果欠佳[5]。MI/RI为冠心病病理环节之一,临床表现为气短、胸痛、乏力、心率失常等症状,MI/RI使机体氧自由基增多、钙离子超载、炎症反应、线粒体功能及能量代谢出现障碍,最终使心肌组织细胞发生不可逆的损伤,增加患者心力衰竭、心源性猝死风险[6]。
MI/RI促进心肌细胞凋亡,增加心脏梗死面积,加重心肌功能损伤[7]。羽扇豆醇广泛存在于食用植物与中草药中,并且对多种癌症表现出抗癌作用,浓度羽扇豆醇可以致癌物质对大鼠肝脏损伤[8,9]。本研究结果显示I/R模型组大鼠HR、LVSP、LVEF、FS及LVWT降低,心脏组织的受损程度严重,羽扇豆醇预处理后再进行MI/RI可以明显改善大鼠再灌注后的心脏功能,减低血清CK-Mb、Mb、cTnI、LDH含量以及心肌组织的Caspase-3阳性率,并增加心肌组织中Ki67、Survivin mRNA含量。CK-Mb、Mb、cTnI及LDH是检测心肌损伤的重要指标[10],Ki67为调节细胞增殖有关基因并参与细胞周期调节[11],Survivin为凋亡抑制基因[12],Caspase-3是机体内所有凋亡途径最终行使凋亡功能的蛋白[13]。程斌等[14]研究发现人参皂甙Rb1可以促进Survivin表达,抑制大鼠脊髓缺血再灌注引起的细胞凋亡,从而保护神经功能。三七总皂苷可以增加全脑缺血大鼠侧脑室室管膜区的Ki67表达水平,加速神经祖细胞的增殖[15]。刘春晓等[16]研究显示枳实薤白桂枝汤可以抑制MI/RI大鼠血清中cTnI、LDH含量,并抑制心肌组织中Caspase-3表达。本研究结果与既往研究相似,表明羽扇豆醇对MI/RI大鼠的心脏具有保护作用,可能是通过上调Ki67、Survivin表达,降低心脏组织细胞中Caspase-3水平,促进心肌细胞增殖、抑制心肌细胞凋亡,来实现对大鼠的心脏保护作用。
正常生理状态下,心肌细胞中存在少量的氧自由基,但会被自由基清除系统清除,不会对心肌细胞产生严重损伤。当发生缺血缺氧时,机体清除自由基的能力降低,生成自由基的能力增强,当机体恢复血氧供给后,自由基含量增加,增强机体氧化应激反应。本研究结果显示心肌缺血再灌注大鼠的血清SOD活性降低,MDA、TNF-α、IL-1β、iNOS以及IL-6水平增加,而羽扇豆醇可以降低心肌缺血再灌注大鼠血清中MDA、TNF-α、IL-1β、iNOS以及IL-6含量并增加SOD活性。SOD在自由基清除过程具有重要作用,当机体内SOD减少时,细胞膜中的不饱和双键结构容易受到自由基破坏,使脂质发生降解产生MDA,同时也会改变细胞的通透性,导致线粒体功能出现障碍,所以MDA与SOD能够反映机体氧化应激状态[17,18]。与此同时,心肌缺血再灌注损伤也与炎症因子有着密切关系,当发生MI/RI时,巨噬细胞中的iNOS表达上调,使iNOS含量增加,促进再灌注损伤;TNF-α、IL-1β、IL-6炎症因子含量增加可以通过反馈作用促进氧自由基含量增多,加重缺血再灌注损伤。本研究结果发现羽扇豆醇可以增加MI/RI大鼠心肌组织中的Nrf1、PGC-1α、TFAM水平。Nrf1能够调节线粒体呼吸链相关基因表达的转录因子,是NRFs的亚型之一,PGC-1α可以与NRFs结合作用于线粒体转录因子A(TFAM)的启动子区,促进线粒体DNA复制与转录,促进线粒体的增殖。TFAM水平对维持机体线粒体呼吸链的电子传递具有重要作用,是细胞能量代谢的重要保证。刘路等[19]研究显示电针“足三里”穴可以促进大鼠心肌组织Nrf1、PGC-1α、TFAM水平,提高能量代谢。本研究与其相似,表明羽扇豆醇可以降低MI/RI大鼠的心肌组织的氧化应激及炎性反应,提高心肌细胞能量代谢,从而实现对心脏功能的保护作用。
综上所述,羽扇豆醇一方面可以通过降低MI/RI大鼠心肌细胞Caspase-3阳性率,上调心肌组织Ki67、Survivin表达,来促进心肌细胞增殖、降低细胞凋亡;羽扇豆醇一方面还可以降低MI/RI大鼠血清促炎性因子水平,提高机体清除自由基能力,降低机体氧化应激反应,保护线粒体呼吸链,提高心肌细胞的能量代谢,从而实现对MI/RI大鼠心脏功能及心肌损伤的保护作用。本研究结论仅仅是在大鼠实验所得,在临床上是否也存在相似功能,还需要进一步研究。