瘦素对大鼠肝脏缺血再灌注损伤的保护作用及机制研究
2020-02-18李盛
李 盛
(湖北省武汉市黄陂区人民医院肝胆外科, 武汉 430300)
瘦素由肥胖基因表达,是167个氨基酸残基组成的多肽,其表达和合成主要是在脂肪组织内,但是在胃、脑和骨骼肌等组织内也存在,瘦素的表达和分泌有日夜节律性,午夜最高,中午最低,其节律性受生长激素、胰岛素、皮质激素调节,并且和进食的时间以及食物的成分相关[1-2]。瘦素最主要的功能是作为能量过多的信号,当能量受限或者体质量减轻时瘦素的含量急速下降,进而促进进食以及使得机体降低能量消耗;并且可以直接或者间接地通过下丘脑调节来活化骨骼肌磷酸腺苷激酶(AMPK),增加脂肪酸的氧化代谢和葡萄糖摄取。此外,瘦素还具有调节免疫功能、血红细胞生成、血管发生、骨骼构建等功能[3-4]。
肝缺血再灌注损伤(HIRI)常见于肝切除、肝移植、休克后复苏时,引起损伤的主要原因是活性氧生成,Ca2+超载和白细胞活化,是导致患者预后不良的主要原因[5-6]。近年来,瘦素在能量代谢中的作用备受关注,而肝又是营养吸收和能量代谢的重要器官。研究瘦素对肝脏缺血再灌注的影响和机制,可能为缺血再灌注提供一个新的治疗方法。目前瘦素与HIRI诱导的肝损伤的影响及机制研究少有报道,基于此,本研究采用瘦素预处理HIRI大鼠模型,观察瘦素预处理对其影响,探讨瘦素预处理对HIRI的保护作用。
1 材料与方法
1.1 实验动物及分组清洁雄性SD大鼠40只,体质量200~250 g,购自北京维通利华实验动物技术有限公司,大鼠安置的条件:相对湿度(55±5)%,温度(22±2)℃,12 h/12 h的明暗循环。喂养条件:标准鼠粮和纯净水,自由摄食和自由饮用水。将大鼠随机分为假手术组(Sham组)、HIRI模型组、HIRI瘦素预处理组和HIRI术后瘦素处理组,每组10只。
1.2 主要仪器与试剂酶标分析仪(北京普朗,NM-9602A),人工重组瘦素购自R&D Systems公司,丙二醛(MDA)和超氧化物歧化酶(SOD)试剂盒均购自北京索莱宝科技有限公司。TUNEL细胞凋亡试剂盒(Promega 公司),超声匀浆机(北京百利安斯商贸有限公司)、电子秤(赛多利斯,德国)、全自动生化分析仪(美国Beckman),CytoFLEX S 流式细胞仪(美国Beckman)。
1.3 动物模型的制备及处理实验前12 h禁食不限水,以60 ng/kg戊巴比妥钠腹腔注射麻醉大鼠,无菌条件下开腹,HIRI模型组取右侧肋缘下斜切口,充分暴露第一肝门,以微血管夹夹闭供应肝左叶、中叶的肝蒂左分叉,但不夹闭肝蒂右分叉,右眼可见肝脏左、中叶由鲜红改变为粉红直至浅粉,颜色明显浅于肝右叶,证实肝左叶、肝中叶血管经皮阻断,无菌纱布覆盖于切口处,60 min后弃去血管夹,再次恢复肝脏血液循环,可见肝左、肝中叶迅速变为鲜红色,表明HIRI模型制备成功。Sham组开腹后仅钝性分离肝蒂左分叉,但不夹闭阻断肝叶供血。HIRI瘦素预处理组大鼠于HIRI术前30 min给予腹腔注射重组瘦素,剂量为0.2 mg/kg体质量。HIRI术后瘦素处理组大鼠于HIRI术后30 min给予腹腔注射重组瘦素,剂量为0.2 mg/kg体质量。
1.4 血清及组织样本制备以上4组大鼠于HIRI术后3 h时麻醉大鼠,行心脏取血,摇匀、抗凝,4℃,1 000 r/min离心10 min,分离血清于-80℃冰箱保存待测。随后处死取肝组织,一半肝用于HE染色,一半肝组织用于制备肝组织匀浆。
1.5 原位末端标记法(TUNEL)检测细胞凋亡大鼠肝组织行常规脱水,石蜡包埋切片,进行HE染色,根据HE染色结果判定缺血梗死灶部位,并进行切片。采用TUNE检测细胞凋亡情况。以细胞核显棕褐色颗粒者为TUNEL阳性细胞,每张切片各取5个相互不重叠的高倍视野(×400),计阳性细胞数及肝细胞总数,并计算阳性率。
1.6 氧自由基活性测定分别检测各组大鼠血清中MDA活性和超氧化物歧化酶SOD水平,严格按试剂盒说明书进行,分别于波氏532~550 nm紫外分光光度计下测定MDA和SOD水平。切取新鲜肝组织100 mg,制备成肝组织匀浆,4℃,8 000 r/min,离心10 min,取上清液于液氮中保存至检测,测定前标本置于冷水中复融,4℃,8 000 r/min,离心10 min,取上清液,按试剂盒说明书,用分光光度计检测,测定530 nm下和600 nm下的吸光度值,利用532 nm与600 nm下的吸光度值计算MDA含量。MDA含量(μmol/L)=6.45×(A532-A600)÷蛋白浓度(mg/mol)。SOD采用560 nm波长的吸光度值同理计算。
1.7 各组大鼠肝组织中白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)的检测按“1.4”项下离心的血清,采用酶联免疫吸附实验(ELISA)进行检测,采用全自动生化分析仪测定大鼠血清中ALT、AST活性。
2 结果
2.1 肝细胞凋亡情况凋亡肝细胞呈核固缩、浓染的棕褐色颗粒,Sham组见少量凋亡阳性肝细胞,HIRI模型组凋亡阳性肝细胞与Sham组比较明显增多(P<0.05),凋亡细胞主要分布于缺血梗死灶。HIRI瘦素预处理组凋亡细胞和阳性率较HIRI模型组和HIRI术后瘦素处理组明显减少(P<0.05),各组凋亡细胞数量及阳性率的比较见表1。

表1 各组大鼠凋亡细胞及阳性率的比较
注:与Sham组比较,*P<0.05;与HIRI模型组比较,■P<0.05;与HIRI瘦素预处理组比较,△P<0.05。
2.2各组大鼠肝组织匀浆中SOD和MDA含量测定HIRI模型组大鼠肝脏组织匀浆MDA含量明显高于Sham组大鼠肝脏组织匀浆中的含量,SOD含量明显低于Sham组(P<0.05),HIRI瘦素预处理组MDA含量高于Sham组,但明显低于HIRI模型组(P<0.05),SOD含量低于Sham组,但与HIRI模型组比较差异无统计学意义(P>0.05)。HIRI术后瘦素预处理组SOD、MDA含量与HIRI模型组比较,MDA含量低于HIRI,SOD高于HIRI模型组,差异无统计学意义(P>0.05),见表2。
2.3 各组大鼠肝组织中IL-6、TNF-α水平的比较与Sham组比较,各组大鼠IL-6和TNF-α水平明显升高(P<0.05),与HIRI模型组比较,瘦素预处理组大鼠IL-6和TNF-α水平降低,HIRI术后瘦素处理组IL-6和TNF-α水平较HIRI模型组升高,差异均有统计学意义(P<0.05),见表2、图1。
2.4 瘦素对大鼠肝缺血再灌注损伤血清ALT、AST水平的影响大鼠缺血再灌注损伤后,与Sham组比较,HIRI模型组血清ALT、AST水平均明显升高(P<0.05),与HIRI模型组比较,瘦素预处理组大鼠血清ALT、AST水平均明显降低(P<0.05),见表3、图1。

表2 各组大鼠肝组织中SOD、MDA、IL-6和TNF-α水平含量
注:与Sham组比较,*P<0.05;与HIRI模型组比较,■P<0.05;与HIRI瘦素预处理组比较,△P<0.05。
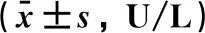
表3 瘦素对大鼠肝缺血再灌注损伤血清ALT、AST水平的影响
注:与Sham组比较,*P<0.05; 与HIRI模型组比较,■P<0.05;与HIRI瘦素预处理组比较,△P<0.05。

注: 与Sham组比较,*P<0.05;与HIRI模型组比较,■P<0.05; 与HIRI瘦素预处理组比较,△P<0.05。
图1 各组大鼠IL-6、TNF-α、ALT、AST水平
3 讨论
瘦素是一种神经肽类物质,脂肪类细胞分泌的具有调控食物摄入、维持能量稳态的肽类激素,目前发现有6种瘦素的受体同分异构体[7],其是调节体质量和能量稳态的脂类激素,具有广泛的药理作用,其可参与机体摄食、体温及能量平衡的调控,调节脂类代谢及胰岛素分泌。细胞内钙超载、氧自由基生成过多、细胞凋亡及炎性细胞因子的激活等是肝缺血再灌注损伤主要的病理、生理机制。脑缺血再灌注损伤与瘦素有非常密切的联系,在脑缺血再灌注模型中发现血清素明显升高。再灌注过程中生成的大量自由基是引起肝组织损伤的原因之一,自由基生成的定量可通过测定MDA和SOD的活性来间接判定[8-9]。MDA含量可反应脂质氧化的水平,也可间接反映机体受ROS攻击的程度[10]。氧自由基作用于脂质的不饱和脂肪酸,生成过氧化脂质,后者逐渐分解为系列复杂的化合物,其中包括MDA。通过检测MDA的水平,即可检测脂质氧化的水平。SOD能催化超氧化物阴离子发生歧化作用,生成过氧化氢和氧气(O2)是生物体内一种重要的抗氧化酶。本实验首先采用血管夹阻断供应大鼠肝左叶、肝中叶的血管和胆管,30 min后再重新恢复肝脏血液循环,制造大鼠HIRI模型;肝脏血液再灌注6 h后检测大鼠血清SOD水平、MDA水平,观察瘦素对肝缺血再灌注损伤的影响。本研究证实,肝脏缺血再灌注后MDA升高,SOD下降。提示HIRI对大鼠肝脏抗自由基损伤作用的减弱而脂质过氧化反应增强,增加了自由基对大鼠肝脏损伤的作用。与HIRI组比较,瘦素预处理组大鼠肝脏MDA含量明显降低,SOD活性明显增高,本研究证实,瘦素预处理可通过保护自由基清除系统,提高体内脂质氧化反应程度,降低肝脏缺血再灌注时的肝组织损伤,及有害代谢物(MDA)对肝脏的损害。另外,流式细胞仪检测结果也显示,HIRI术后瘦素处理组MDA、SOD水平与HIRI组比较差异无统计学意义,提示在HIRI手术后瘦素处理并不能降低氧自由基的产生,对氧化应急状态没有改变作用,对肝缺血再灌注损伤也没有改进措施。
TNF-α是细胞因子中一种重要的介质,是一种由血管内皮细胞、单核细胞分泌的因子,它不仅调节机体免疫应答功能,同时还能介导IL-6等炎症介质产生。此外,它在抗肿瘤、抗感染、凝血和内皮损伤反应中发挥作用[11-12]。白细胞介素-6是体内的一种具有各多种生物学效应的细胞因子,是重要的炎症介质,其主要介导和调节免疫反应及炎症反应,刺激造血功能并参与组织修复[13]。本研究结果显示,与假手术组比较,HIRI模型组大鼠IL-6和TNF-α水平明显升高,瘦素预处理组以上指标均较低,提示HIRI瘦素能抑制肝组织中IL-6的合成,减少肝脏炎性损伤,减轻炎症介质介导的损伤,可以起到保护肝脏作用。HIRI瘦素后处理组IL-6和TNF-α水平升高,说明HIRI术后瘦素处理对肝脏不起保护作用,反而加重炎性介导的损伤。
本研究发现,瘦素对HIRI的作用岁用药时间的不同而不同,瘦素预处理,即在缺血再灌注损伤模型制备前,瘦素的使用可以减轻氧自由基的产生,产生氧化反应,降低肝脏缺血,再灌注损伤,而肝脏缺血再灌注损伤后,瘦素对ALT、AST、MDA、SOD、IL-6、TNF-α各项指标均未产生明显影响。
综上所述,在大鼠肝缺血再灌注发生发展的病理过程中,给予一定浓度的外源性瘦素预处理,能够减少氧自由基的产生,减轻脂质氧化程度,抑制细胞凋亡水平,同时减轻炎症反应,降低大鼠肝脏损害,为临床提供一定的理论依据。
