Wnt-1诱导分泌蛋白2的表达与食管鳞癌患者临床病理参数及预后的相关性分析
2020-02-18迪丽努尔阿合拜尔卡吾力居买伊力亚尔夏合丁
迪丽努尔·阿合拜尔, 卡吾力·居买, 伊力亚尔·夏合丁
(新疆医科大学第一临床医学院暨第一附属医院胸外科, 乌鲁木齐 830054)
食管癌是我国最常见的消化道恶性肿瘤之一,河南、山西和新疆地区北部是我国食管癌集中高发区[1-2]。食管癌发生发展与多基因、多因素调控有关。Wnt-l诱导分泌蛋白2(Wisp2)基因是CCN家族的第五个成员,其编码的野生型Wisp2蛋白控制细胞周期的启动,防止突变基因出现遗传不稳定性和癌变,与人类多数恶性肿瘤有关[3]。本课题组在前期全基因组外显子测序中发现Tshd7A基因是食管癌差异突变基因之一,而Wisp2是Tshd7A下游食管癌相关基因。Wisp2基因在胃癌、乳腺癌等恶性肿瘤中显著高表达,但其作用机制尚不明确[4]。本研究应用免疫组化技术与免疫蛋白质印迹法检测食管鳞状细胞癌(ESCC)组织中Wisp2基因蛋白表达情况,并分析其与患者临床病理指标之间的相关性,从而评价Wisp2基因在ESCC中的发生、发展及其与预后的相关性。
1 资料与方法
1.1 临床资料收集整理2010年1月-2015年12月于新疆医科大学第一附属医院行手术治疗的95例ESCC患者为研究对象,随访至2019年1月,ESCC依据《食管癌规范化诊治指南》进行诊断[5]。ESCC及相应癌旁组织使用福尔马林固定、石蜡包埋。所有患者术前均未接受放疗、化疗及其它特殊治疗。按国际食管癌第7版TNM分期标准进行pTNM分期[6]。所有患者均有完整的临床病理资料和随访记录。临床病理资料包括患者性别、年龄、肿瘤大小、组织学类型、肿瘤状态、淋巴结转移、远处转移、TNM分期等。存活时间定义为从手术日到最后一个随访日或患者死亡日的时间。所有患者均获得知情同意,研究方案经新疆医科大学第一附属医院研究伦理委员会批准。
1.2 实验方法
1.2.1 免疫组织化学法 将ESCC患者癌组织设为主要研究对象,将ESCC患者癌旁正常组织设为对照采用免疫组织化学SP法检测Wisp2蛋白的表达情况。将收集的ESCC和癌旁正常组织制成4 μm石蜡切片,经过脱蜡、水化,微波炉抗原修复,3%过氧化氢阻断内源性过氧化物酶后,用小鼠抗人Wisp2单克隆抗体(ab38317,艾博抗,上海)于4℃环境中孵育(浓度为1∶100),次日37℃温箱孵育二抗(ab205718、艾博抗、上海),显微镜下DAB显色,再用苏木素-伊红(HE)法复染5~10 min,酒精梯度脱水,最后用中性树脂封片。
1.2.2 蛋白质印迹法检测Wisp2蛋白 按照试剂盒说明书,用细胞裂解试剂(Sigma-Aldrich,St.Louis,美国)制备新鲜组织和细胞提取物, 细胞蛋白含量以Thermo Sdentific Pierce BCA蛋白检测试剂盒(Pierce 23225,USA)定量。取适量蛋白通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)(10%)分离蛋白质样品,并用小鼠抗人Wisp2单克隆抗体检测。加入山羊抗兔IgG(Pierce, Rockford, 美国)与辣根过氧化物酶偶联的二抗和电化学发光(ECL)检测系统(SuperSignal West Femto, Pierce)进行检测。
1.3 结果判定由2位病理科室具有5年以上且经验丰富的高年资医师对染色结果进行评价,每例切片均应分别对超过100个观察细胞数的高倍镜视野进行独立评价,且高倍镜视野不能少于5个。免疫组织化化学法判定评分标准:Wisp2蛋白阳性细胞染色后细胞质中出现棕黄色或黄色颗粒。低表达与高表达的判定标准:以细胞质及细胞膜染色为有意义,结果由以下2项评分的乘积来判定。(1)以切片中细胞着色深浅评分:细胞无着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分;(2)以阳性细胞数在同类细胞数中所占百分比评分:无阳性细胞为0分,阳性细胞占比<20%为1分,20%~60%为2分,>60%为3分。2项乘积为最终的得分。得分<4分定义为低表达,≥4分定义为高表达。

2 结果
2.1 Wisp2蛋白在ESCC及癌周正常组织的形态学表现HE染色见癌组织细胞形态结构排列不规则,Wisp2蛋白在细胞膜与细胞质中表达,细胞核基本无表达,见图1。

A1: 癌周正常组织的HE染色

A2: 食管鳞癌组织的HE染色
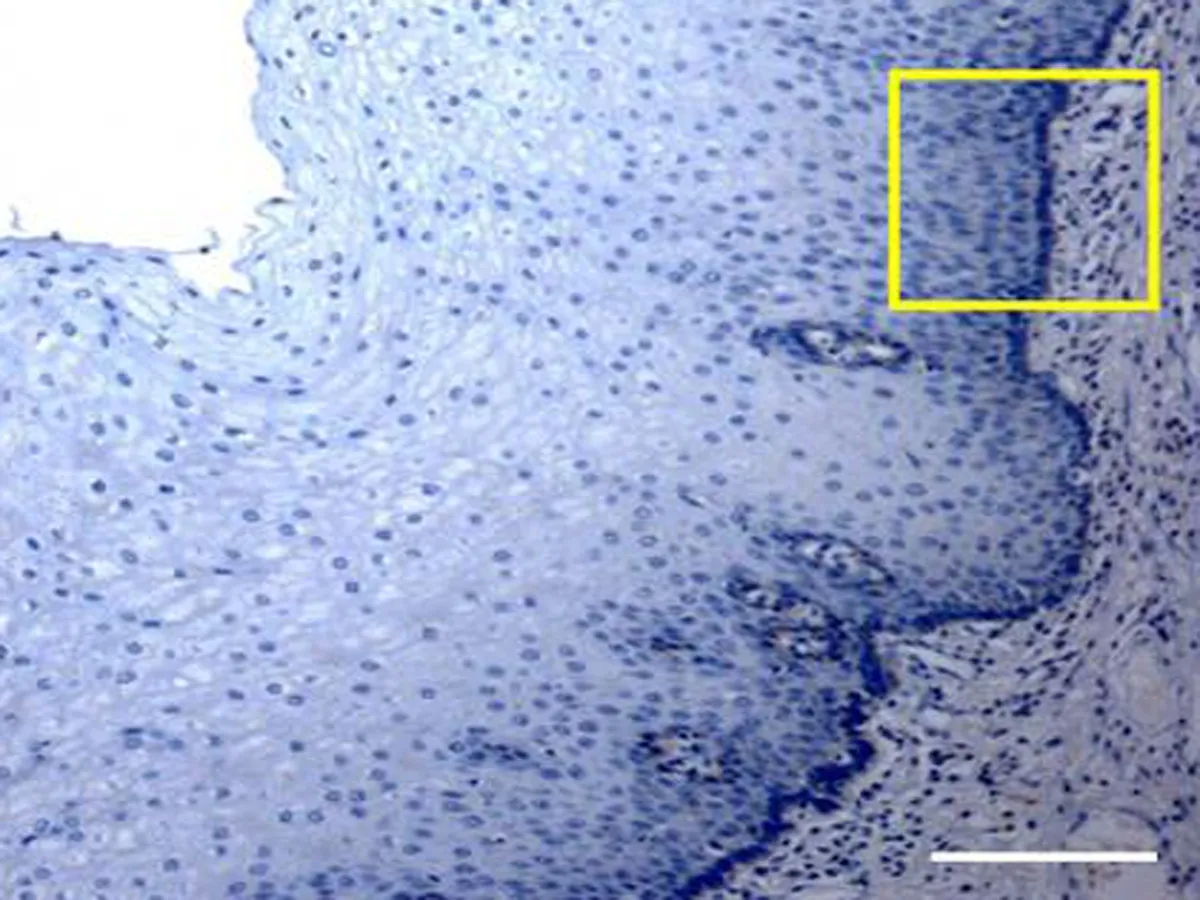
B1: 癌周正常组织免疫组织化学染色(×400)

B2: 食管鳞癌组织的Wisp2免疫组织化学染色(×400)
图1 Wisp2蛋白在 ESCC组织和癌旁正常组织中的表达
2.2 Wisp2在ESCC癌组织的表达ESCC癌组织中Wisp2蛋白的平均表达水平为(1.293±0.085),高于癌旁正常组织(0.298±0.042),差异有统计学意义(t=46.912,P<0.001) ,见图2。
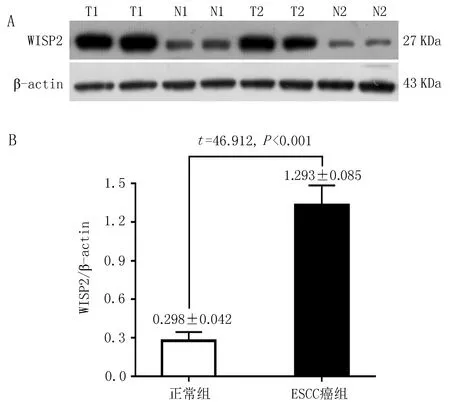
图2 ESCC癌组织与癌周正常组织的Wisp2蛋白相对表达水平
2.3 Wisp2蛋白表达与ESCC患者临床病理特征的关系ESCC患者临床分期越晚,Wisp2蛋白表达水平越高,随着浸润深度增加,表达水平越高,发生淋巴结转移的表达水平高,分化程度越低表达水平越高(P<0.05),而患者性别、年龄分层、肿瘤大小比较差异均无统计学意义(P>0.05),见表1。
2.4 Wisp2蛋白表达对于ESCC患者的预后价值30例Wisp2蛋白低表达ESCC患者的总体生存期比60例Wisp2蛋白高表达的ESCC患者更长(χ2=10.658,P<0.001,),见图3。单因素分析结果显示,性别、年龄、淋巴结转移、分化程度对ESCC患者的预后影响差异无统计学意义(P均>0.05);浸润深度、肿瘤大小、Wisp2蛋白的表达对ESCC患者的预后影响有明显差异(P均<0.05)。同时,多因素Cox回归分析结果表明,浸润深度、Wisp2的蛋白表达水平对ESCC患者生存预后产生影响,T3-T4级别的浸润深度以及Wisp2蛋白的高水平表达是ESCC患者总体生存的危险因素,见表2。
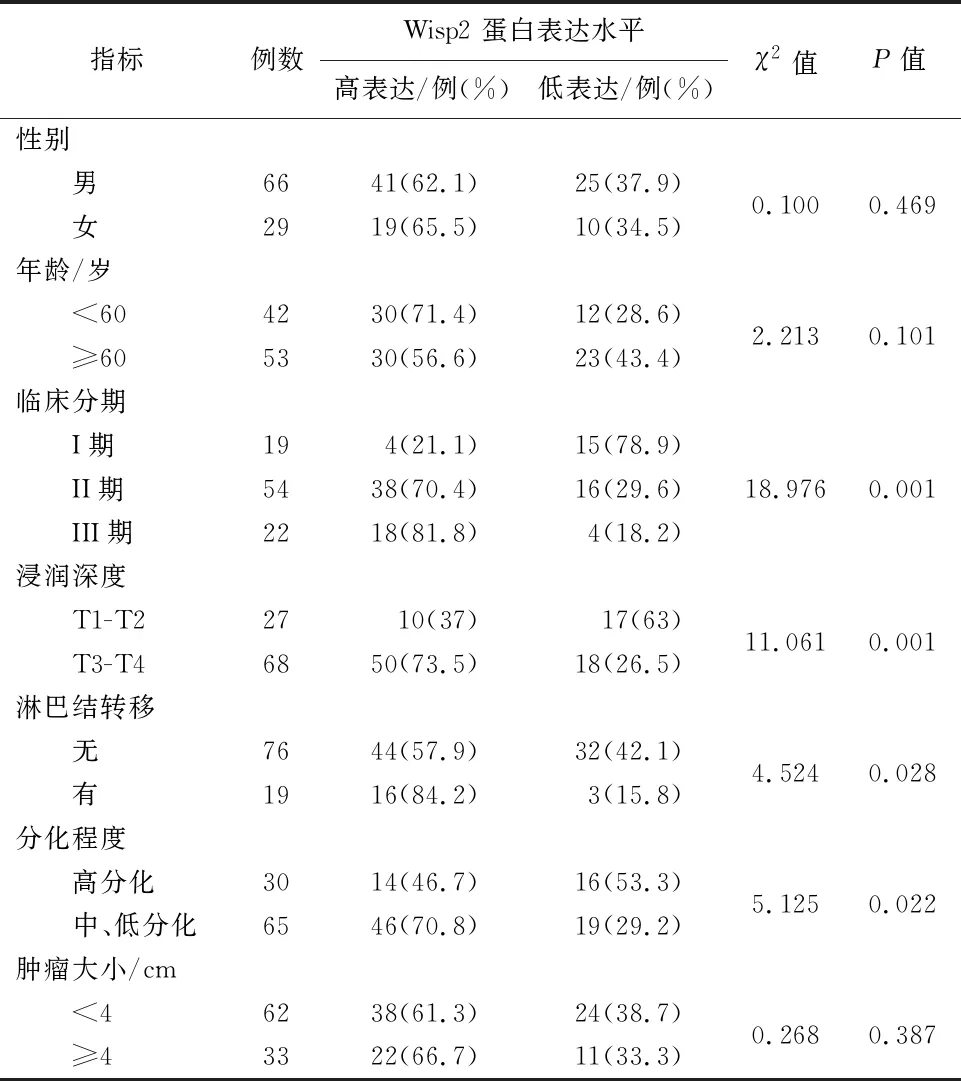
表1 食管鳞癌患者Wisp2表达的临床病理相关性

表2 ESCC患者Cox回归风险模型分析
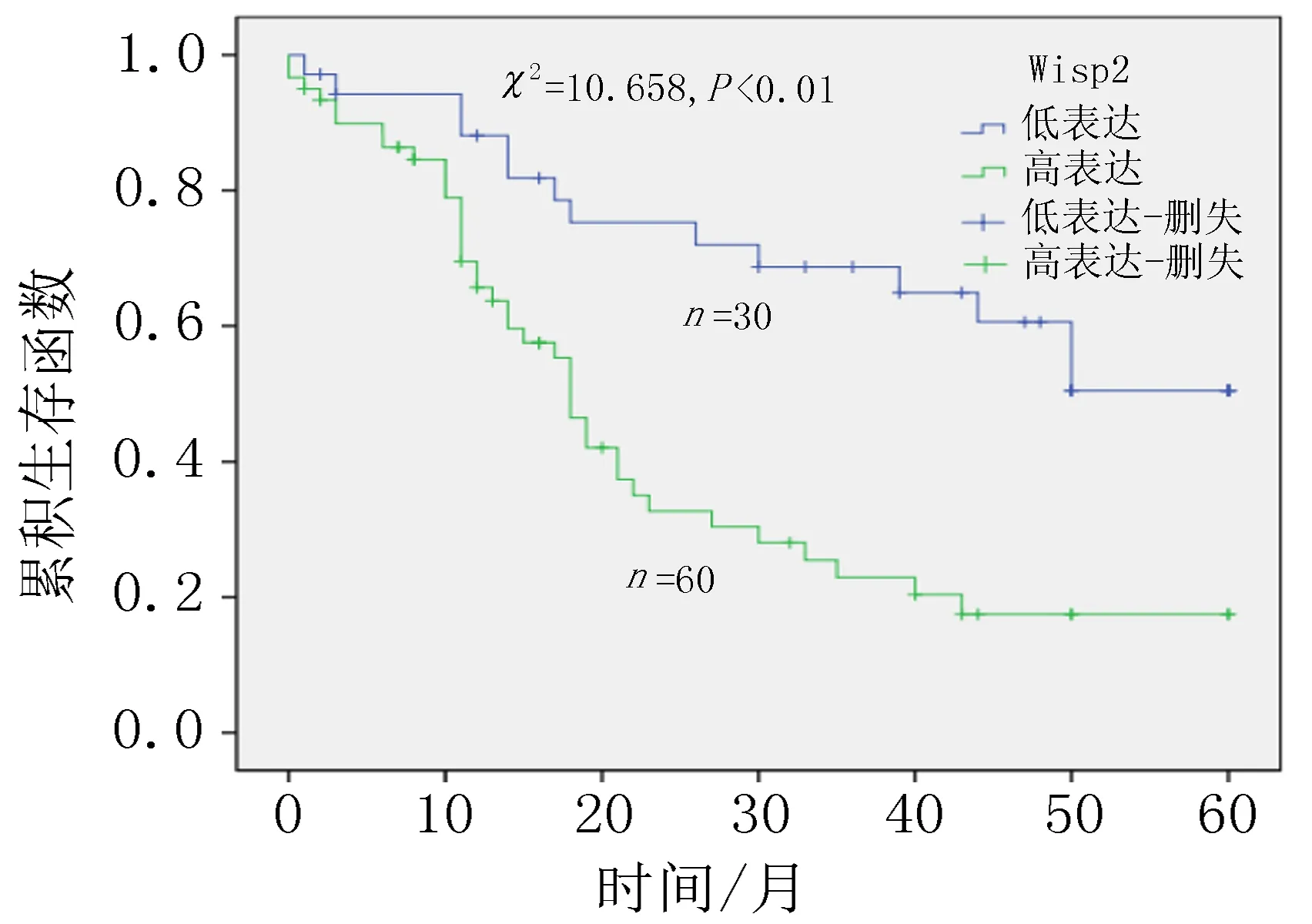
图3 不同Wisp2蛋白表达水平的Kaplan-Meier生存曲线
3 讨论
ESCC的生存率和治愈率均较差[7]。虽然可采取改变生活方式和改善营养等多种方法减少ESCC的发生,但这些方法并不容易实施。
在过去的二十年中,CCN蛋白家族的功能在各种类型的癌症中被发现,被认为是参与癌症病理演变的重要分子标志物[8]。Wisp2是CNN蛋白家族成员之一,其基因定位于20q12-20q13.1染色体。Wisp2与一般的CNN家族成员相比,仅有28个半胱氨酸,且末端氨基酸模式缺乏[9]。Wisp2与肿瘤的发生、发展关系密切,在不同的肿瘤组织中调节肿瘤细胞的发展。
关于Wisp2在肿瘤中的作用机制目前仍在探索之中。有研究显示,Wisp2蛋白在MCF-7乳腺肿瘤细胞中高表达,中断Wisp2信号传导会显著减少肿瘤细胞增殖[10]。已有研究发现Wisp2在乳腺癌组织中与肿瘤浸润深度、分化程度、临床分期等显著相关,提示Wisp2在乳腺癌中发挥癌基因的功能[11]。已有研究发现Wisp2蛋白主要通过参与细胞之间的粘附,干预其他细胞的迁移与分化,进而促进肿瘤血管形成和肿瘤细胞生长,提示Wisp2蛋白也可能对食管鳞癌细胞的病理演变过程发挥一定的作用[12]。
新疆地区人群食管癌发病率较高,增加对该疾病的了解意义重大[13]。本研究结果显示ESCC患者的癌组织较癌旁正常组织中Wisp2蛋白表达增加,进一步进行了Wisp2蛋白表达与临床病理特征关系的研究中发现Wisp2基因在ESCC中的表达率高于癌旁正常组织;蛋白质印迹分析进一步证明ESCC 组织中Wisp2蛋白过表达;Wisp2蛋白的表达与临床分期、浸润深度、分化程度、淋巴结转移等显著相关,而与患者性别、年龄、肿瘤大小等参数无关;高表达Wisp2的患者总体生存率下降(P<0.005),这充分表明Wisp2蛋白与ESCC恶性程度密切相关。对ESCC患者预后随访中发现Wisp2蛋白低表达者比Wisp2蛋白高表达者总体生存期更长,说明Wisp2蛋白过表达与ESCC的发生、发展、预后具有明显相关性,但Wisp2蛋白参与食管上皮细胞癌变的过程中的具体机制目前还不清楚,需要进一步研究。Wisp2蛋白表达增高在ESCC病理发展过程中扮演重要角色,可能参与癌症细胞增殖、迁移和侵袭的相关过程,可作为判定ESCC进展,预测ESCC患者预后的影响因素,为ESCC治疗的潜在生物标志物或治疗靶点提供信息和参考。
