2,3,4-三甲氧基查耳酮类衍生物的合成及体外抗宫颈癌活性研究
2020-02-18米热古丽买买提明木合布力阿布力孜艾孜提艾力艾海提
米热古丽·买买提明, 杨 争, 木合布力·阿布力孜, 艾孜提艾力·艾海提
(新疆医科大学药学院, 乌鲁木齐 830011)
宫颈癌是女性常见的恶性肿瘤之一,通常由于持续感染人乳头瘤病毒引起[1]。人乳头瘤病毒 (human papilloma virus,HPV)是一群双链DNA病毒,其中高危型HPV 16和HPV 18感染能导致约70%宫颈癌发生[2-4]。2019年中国癌症中心发布的最新癌症数据显示, 恶性肿瘤死亡占居民全部死因的23.91%,并且恶性肿瘤的发病率和死亡率呈上升趋势[5]。全球每年新发宫颈癌病例中80%发生在发展中国家[6],在我国宫颈癌的病死率在妇科生殖肿瘤中排名第一[7]。目前临床上对宫颈癌的治疗多采用顺铂、卡铂等细胞毒类化疗药,铂类药物对肿瘤细胞的选择性低,在杀灭肿瘤细胞的同时,对人体正常的造血细胞也造成损害,容易引起胃肠道毒性、肾毒性、耳毒性、骨髓抑制等副作用,并且此类药物长期使用易产生耐药性[8-10]。MDM2是一种p53特异性的E3泛素连接酶,它与p53蛋白结合后可使p53失活,从而导致肿瘤的发病[11-13]。研究证实查耳酮类化合物可通过抑制MDM2与p53结合而抑制宫颈癌的发生[14-15]。本课题组前期研究发现,新疆胀果甘草中含有抗宫颈癌的活性成分甘草查耳酮B(Licochalcone B, Lico B),但在甘草中Lico B的含量较低,提取成本高,由于Lico B结构中含有三个羟基,合成过程也非常复杂[16]。查耳酮类化合物A环4-位羟基被甲基化取代提高对p53-MDM2抑制活性有重要作用[17],同时三甲氧查耳酮B抗宫颈癌活性比Lico B强[18]。本研究以Lico B为先导化合物,对其进行结构修饰得到3种甲氧基取代的查耳酮类衍生物,通过MTT实验测定3种衍生物对人宫颈癌SiHa和HeLa细胞增殖的抑制活性,采用流式细胞法测对两种宫颈癌细胞的促凋亡作用和对HeLa细胞周期的影响,现报道如下。
1 材料与方法
1.1 仪器PS-1000型磁力搅拌器(日本EYELA公司),X-4型显微熔点仪(上海精密科学仪器有限公司),2F-2C型暗箱式自动紫外分析仪(上海安亭电子仪器厂),HX56039954型 Merck薄层层析硅胶板(德国默克公司),Unity-Inova 600型核磁共振谱仪(美国Varian公司),CO2培养箱(德国Heraeus公司),Multiskan GO全波长酶标仪(美国Thermo公司),EPICS-XL/XL-MCL型流式细胞仪(美国Beckmann公司)。
1.2 试药2,3,4-三甲氧基苯甲醛 (上海源叶生物科技有限公司,批号S44480), 4′-甲氧基苯乙酮 (上海源叶生物科技有限公司,批号S30280),2′,4′-二甲氧基苯乙酮 (北京百灵威科技有限公司,批号919312),3′,4′-二甲氧基苯乙酮 (上海源叶生物科技有限公司,批号S60572),无水乙醇(天津市北联精细化学品开发有限公司,批号20180328),TBD胎牛血清(广州展晨生物科技有限公司,批号2020HYT815),MTT(上海源叶生物科技有限公司,批号S19063),FITC偶联Annexin-V凋亡检测试剂盒(美国BD公司,批号8128539),顺铂注射液(江苏豪森药业集团,浓度5 mg/mL,批号181004),Lico B(实验室自制)。
1.3 目标衍生物的合成方法精密称取 2,3,4-三甲氧基苯甲醛和4′-甲氧基苯乙酮各10 mmol于100 mL三颈瓶中,加入50 mL无水乙醇超声溶解。将三颈瓶置于磁力搅拌器上,转速调至9,在室温条件下开始搅拌,混合均匀后缓慢滴加20%KOH溶液10 mL作为催化剂,开始反应。以石油醚∶乙酸乙酯=1∶ 2为展开剂,用TLC硅胶GF254板检测反应,待产物中原料药的斑点几乎消失,产物斑点不再加深时结束反应。按上述反应条件合成3种2,3,4-三甲氧基查耳酮类衍生物,衍生物1~3的反应时间分别为为4、2、3 h。反应结束时,合成衍生物1和衍生物2的三颈瓶中均有固体微粒析出,先将反应液分别抽滤,固液分开。滤渣在加热条件下加入少量无水乙醇溶解,置于4℃冰箱重结晶,收集析出物,析出物即为目标产物;滤液转移至500 mL的烧杯中,缓慢加入1 mol/mL的盐酸溶液调节pH=2,此时产生白色沉淀,减压过滤,弃去滤渣,将滤液转移至烧杯中,加入蒸馏水至溶液颜色变成浑浊的黄色,封口,置于4℃冰箱观察。待结晶析出后抽滤,收集滤渣,滤渣用无水乙醇重结晶,可得到目标产物,合并两次的产物,于50℃干燥箱干燥,分别得到衍生物1和衍生物2。衍生物3在反应结束时并没有固体微粒析出,因此滤液中加入1 mol/mL的盐酸溶液调节pH=2,抽滤,弃去滤渣,将滤液中加入蒸馏水待结晶析出,收集析出物,析出物用无水乙醇重结晶可得到衍生物3,干燥备用。合成路线见图1,其中Rx为4′-OCH3/2,4-OCH3/3,4-OCH3。
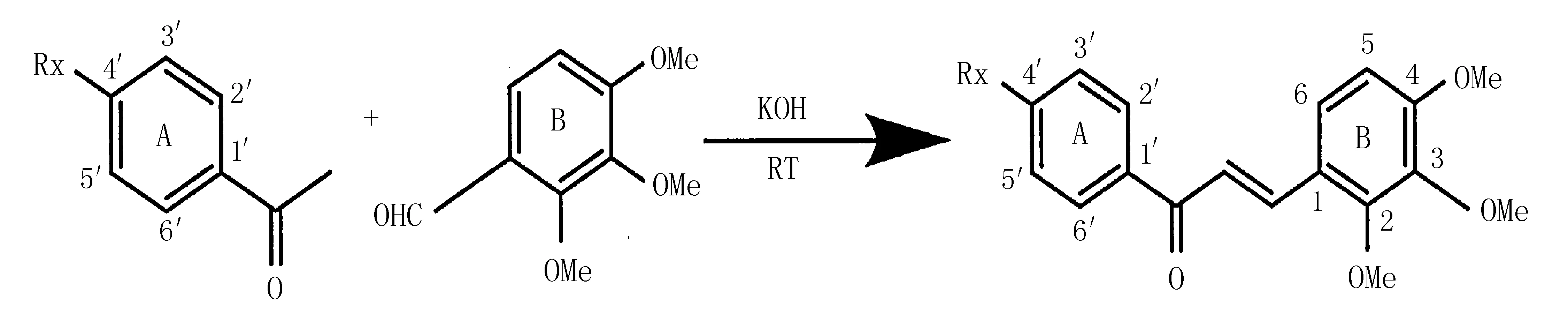
图1 三甲氧基查耳酮类衍生物的合成路线
1.4 目标衍生物的体外抗宫颈癌活性实验
1.4.1 MTT法测细胞增殖的抑制活性 取HeLa和SiHa细胞接种于含10% 胎牛血清、1%双抗和1% 谷氨酰胺的DMEM的培养液中,在5%CO2、37℃的培养箱中培养。将对数生长期的细胞消化、计数并稀释成5×104个/mL的细胞悬液, 200 μL/孔接种到96孔板中培养24 h。以浓度为1、10、25、50、75、100 μg/mL准备药液,每个浓度设6个复孔,以只加培养液的细胞悬液为空白组,顺铂为阳性对照组,每孔给药200 μL。培养24、48、72 h后每孔加入20 μL 5 mg/mL的MTT溶液,放入培养箱培养4 h,吸出上清液后每孔加入150 μL DMSO,用酶标仪在490 nm条件下测定吸光度(OD)值,计算其抑制率,抑制率=[(OD空-OD测)/OD空]×100%。
1.4.2 细胞凋亡实验 取对数生长期的SiHa和HeLa细胞消化、计数、稀释成1×105个/mL的细胞悬液、每孔2 mL接种到6孔板,置于含5% CO2的37℃培养箱培养24 h。给药浓度分别为5、10、20、30、40 μg/mL,以20 μg/mL的顺铂为阳性对照,以只加培养液的细胞为空白组,每孔给药2 mL干预24 h。24 h后用PBS冲洗、每孔加500 μL胰蛋白酶消化2 min后加培养液终止消化,转移至15 mL离心管,1 000 r/min 离心5 min,每个离心管中加100 μL Bingding Buffer吹打均匀,再各加入 FITC Annexin V 和PI各5 μL,室温下避光染色15 min,每管补加400 μL Bingding Buffer,过滤,经流式细胞仪测定细胞凋亡率。
1.4.3 细胞周期实验 取对数生长期的HeLa细胞,消化、计数并稀释成1×105个/mL的密度,每孔2 mL接种到6孔板,培养24 h,吸弃孔中的旧培养液,PBS冲洗后给药。给药浓度分别为10、20、30 μg/mL,给药体积为2 mL/孔,以10 μg/mL顺铂为阳性对照组,以只加培养液的细胞为空白组,干预24 h。每孔分别加PBS冲洗、消化、离心、收集细胞于对应的离心管。收集好的细胞各加4 mL 75%乙醇吹打均匀,放置4℃冰箱备用。1 000 r/min 离心5 min ,弃去上清液,加入5 mL PBS,1 000 r/min 离心5 min ,弃去上清液,每管各加400 μL PI/RNase Staining Buffer吹打均匀,室温避光染色15 min,过滤,测定。
2 结果
2.1 衍生物的结构特征
2.1.1 衍生物1 乳白色针晶,产率:85.7%,熔点:97.3-98.4℃。1H-NMR (600 MHz ,CDCl3) δ: 8.06(2H,d,J=8.4 Hz, 2′, 6′-H), 8.03 (1H,d,J=15.6 Hz,β-H),7.63(1H,d,J=15.6 Hz,a-H),7.44(1H,d,J=8.4 Hz,6-H),7.03(2H,d,J=8.4 Hz,3′-,5′-H),6.77(1H,d,J=8.4 Hz,5-H),3.99(3H,s,2-OCH3),3.96(3H,s,4-OCH3),3.94(3H,s,4′-OCH3),3.93(3H,s,3-OCH3)。13C-NMR (150 MHz, CDCl3) δ: 189.09 (C=O), 163.20 (C-4′), 155.59 (C-4),153.72 (C-2), 142.49 (C-3), 139.24 (C-β), 130.70 (C-2′, 6′), 131.44 (C-1′), 123.80 (C-a), 121.22 (C-6), 122.19(C-1),113.74(C-3′,5′),107.60(C-5),61.37(3-OCH3),60.90(2-OCH3),56.06(4-OCH3),55.44(4′-OCH3) ,为2,3,4-三甲氧-4′-甲氧基查耳酮。
2.1.2 衍生物2 淡黄色针晶,产率:57.9%,熔点:108.6-109.3℃。1H-NMR(600 MHz ,CDCl3)δ: 7.85 (1H,d,J=16.2 Hz,β-H), 7.71(1H,d,J=8.4 Hz,6′-H),7.47(1H,d,J=16.2 Hz,a-H), 7.32(1H,d,J=8.4 Hz,6-H), 6.67(1H,d,J=8.4 Hz,5-H),6.52(1H,dd,J1=8.4 Hz,J2=1.8 Hz , 5′-H), 6.46(1H,d,J=8.4 Hz, 3′-H) , 3.89(3H,s,2′-OCH3),3.85(3H,s,2-OCH3),3.85(3H,s,4-OCH3) ,3.84(3H,s,3-OCH3),3.81(3H,s,4′-OCH3)。13C-NMR (150 MHz, CDCl3) δ: 190.82 (C=O), 163.91 (C-4′), 160.23(C-2′) ,155.32 (C-4),153.55 (C-2), 142.43 (C-3), 137.30 (C-β), 132.66 (C-6′), 132.64(C-1′),126.38(C-a),123.43 (C-6),122.45(C-1),107.66(C-5′),105.16(C-5),98.60(C-3′),61.35(3-OCH3),60.82(2-OCH3),56.00(4-OCH3),55.68(2′-OCH3),55.44(4′-OCH3), 为2,3,4-三甲氧-2′4′-二甲氧基查耳酮。
2.1.3 衍生物3 亮黄色油状固体,产率:86.8%,熔点:113.7-114.4℃。1H-NMR(600 MHz,CDCl3)δ: 8.01 (1H,d,J=15.6 Hz,β-H),7.69(1H,dd,J1=9.0 Hz,J2=2.4 Hz ,6′-H),7.64(1H,d,J=1.8 Hz,2′-H),7.60(1H,d,J=16.2 Hz,a-H),7.40(1H,d,J=8.4 Hz,6-H),6.92(1H,d,J=9.0 Hz, 5-H),6.72(1H,d,J=9.0 Hz, 5′-H), 4.02(3H,s,4′-OCH3), 3.96(3H,s,3′-OCH3),3.93(3H,s,2-OCH3),3.89 (3H,s,4-OCH3), 3.71(3H,s,3-OCH3)。13C-NMR (150 MHz, CDCl3) δ: 188.92 (C=O), 155.60 (C-4′), 153.61(C-4),153.03 (C-2), 149.11 (C-3′), 142.42 (C-3), 139.18 (C-β), 131.56 (C-1′), 123.72 (C-6), 122.83 (C-a), 122.06(C-1), 120.96(C-6′),110.85(C-2′),110.04(C-5′),107.64(C-5),61.29(3-OCH3),60.79(2-OCH3),58.09(4-OCH3), 55.95(3′-OCH3),55.89(4′-OCH3) ,为2,3,4-三甲氧-3′4′-二甲氧基查耳酮。
2.2 MTT实验结果顺铂、LicoB和3种衍生物对宫颈癌SiHa和 HeLa细胞的增殖均有不同程度的抑制作用。与licoB比较,3种衍生物对SiHa和HeLa细胞增殖的抑制活性增高,差异均有统计学意义(P<0.05 );与顺铂比较, 衍生物2和衍生物3对SiHa和HeLa细胞增殖的抑制活性增高,差异均有统计学意义(P<0.05 )。衍生物3对SiHa和 HeLa细胞作用24 h 时IC50分别为9.66、5.64 μg/mL,均低于LicoB,差异均有统计学意义(P<0.05),见表1-3。
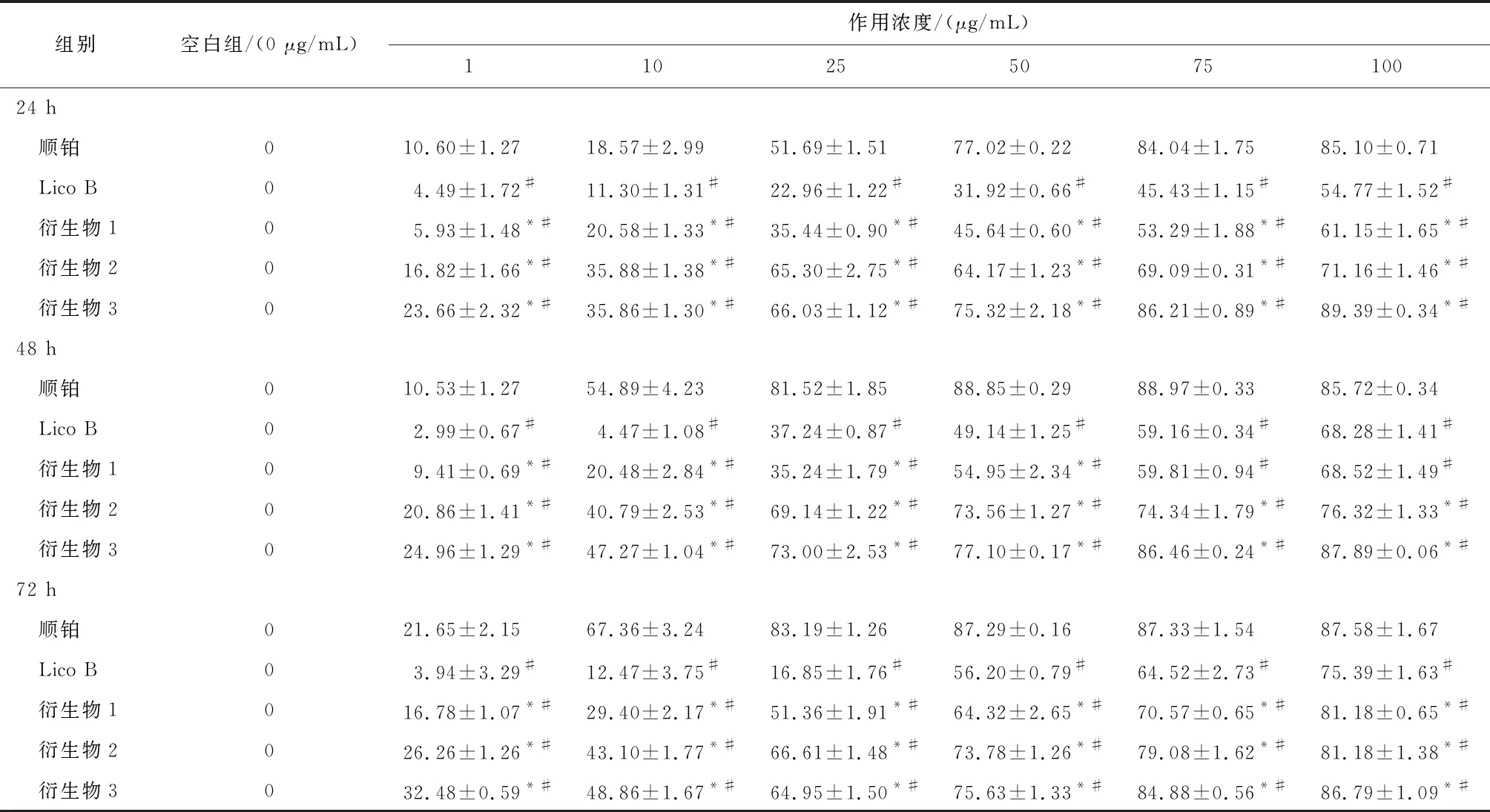
表1 Lico B、顺铂和衍生物(1~3)在不同浓度下对SiHa细胞作用24、48、72 h的抑制率/%
注:与Lico B比较,*P<0.05; 与顺铂比较,#P<0.05。
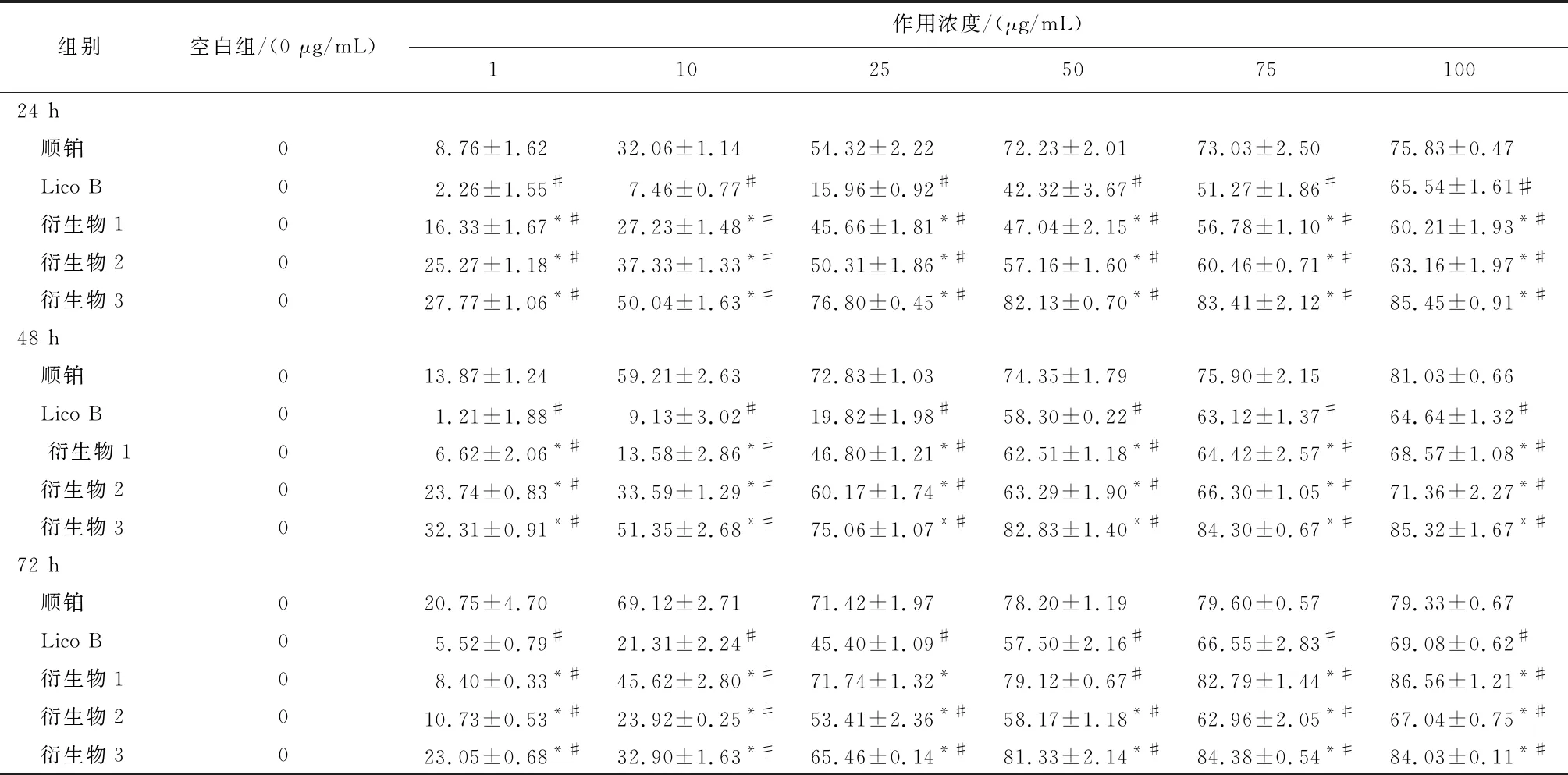
表2 Lico B、顺铂和衍生物(1~3)在不同浓度下对HeLa细胞作用24、48、72 h的抑制率/%
注: 与Lico B比较,*P<0.05; 与顺铂比较,#P<0.05。
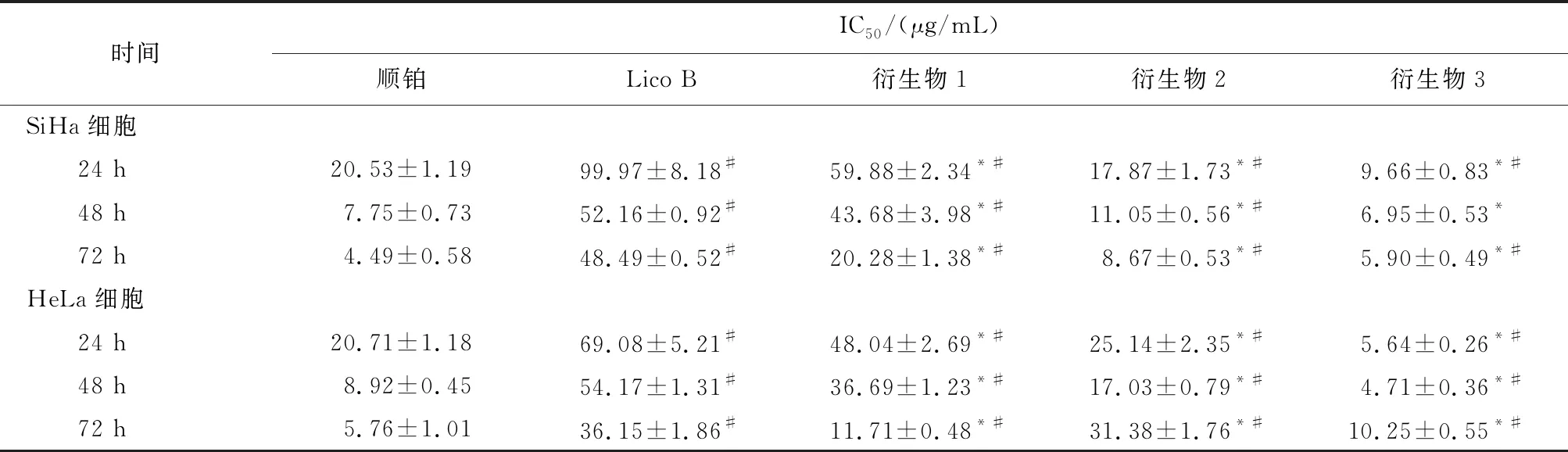
表3 Lico B、顺铂和衍生物(1~3)在不同时间段对 SiHa和HeLa细胞的IC50值
注: 与Lico B比较,*P<0.05; 与顺铂比较,#P<0.05。
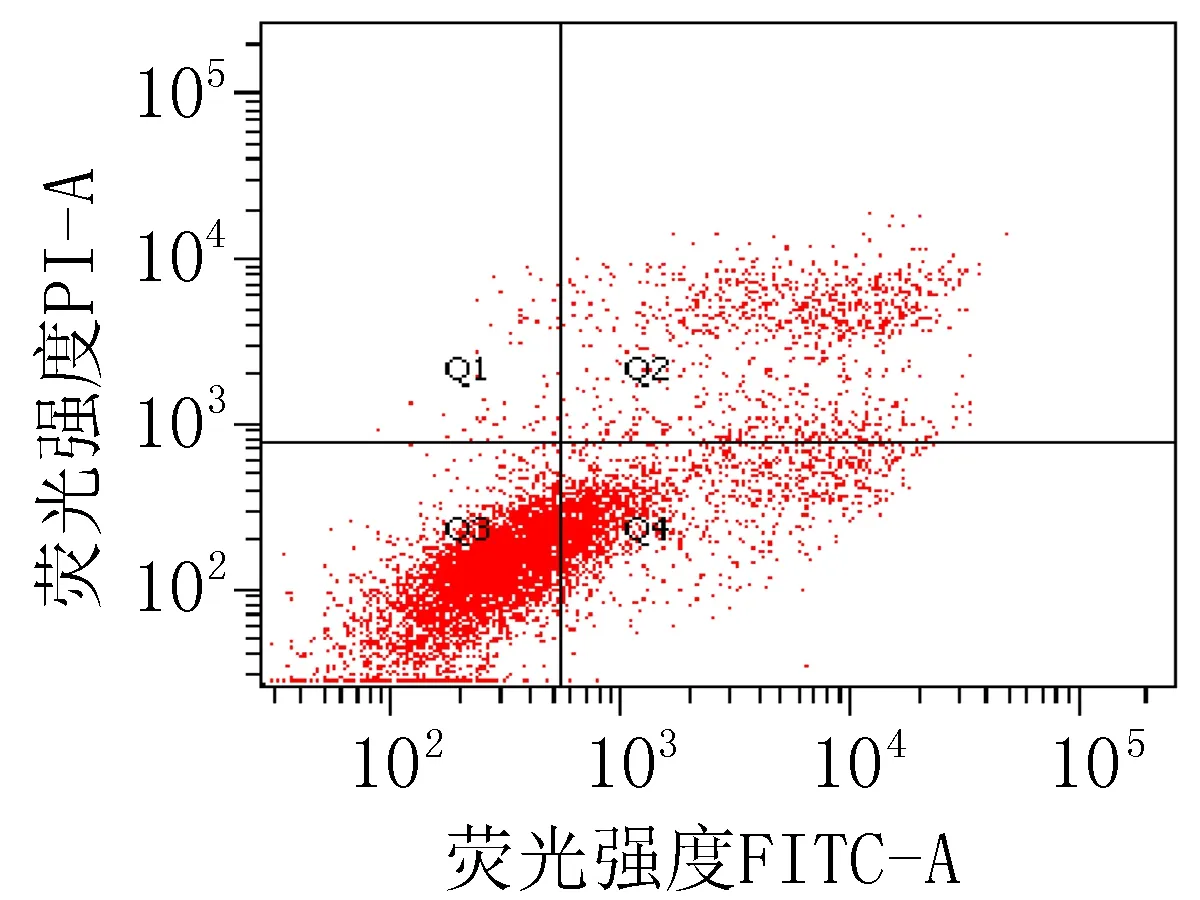
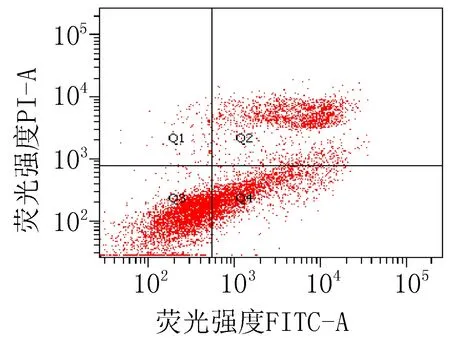
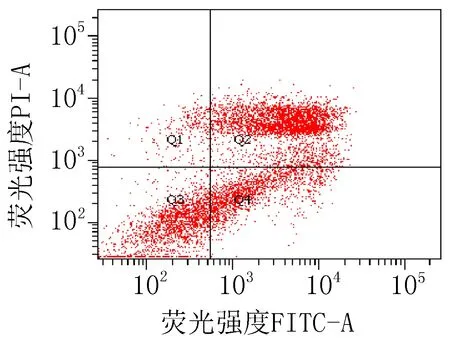
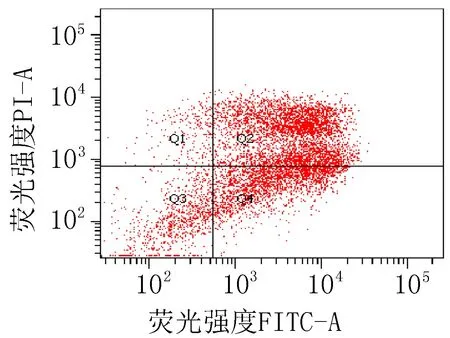
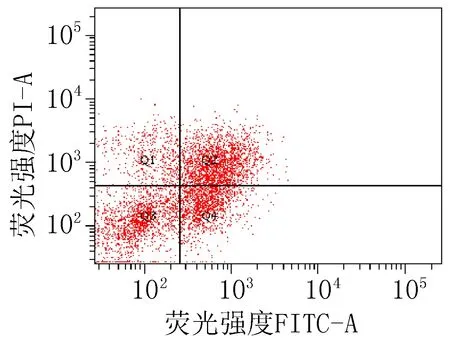
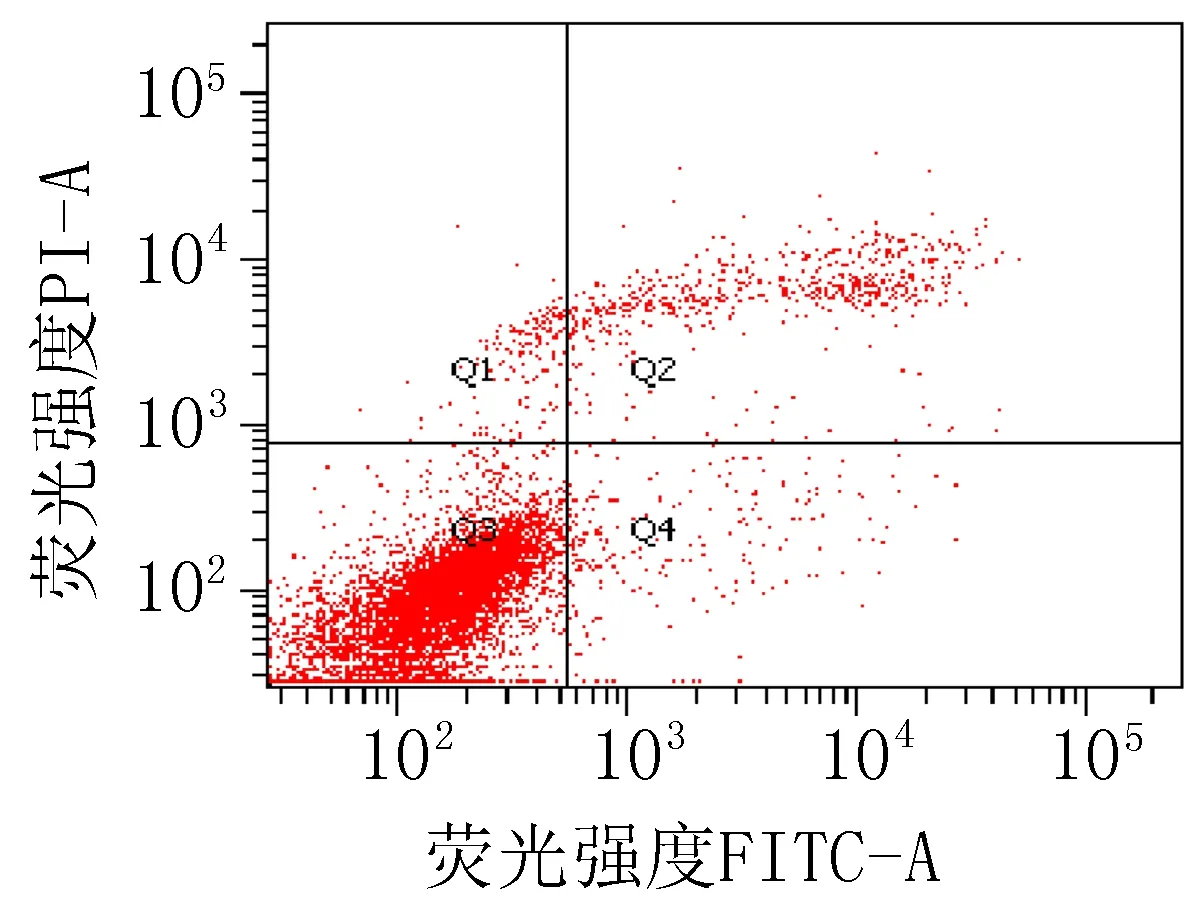
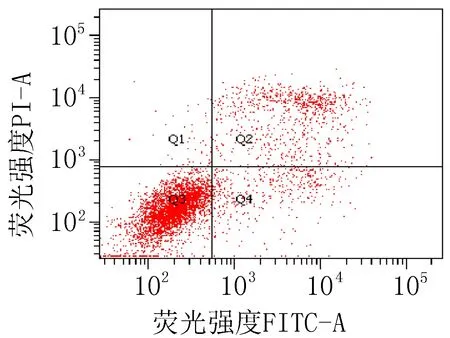
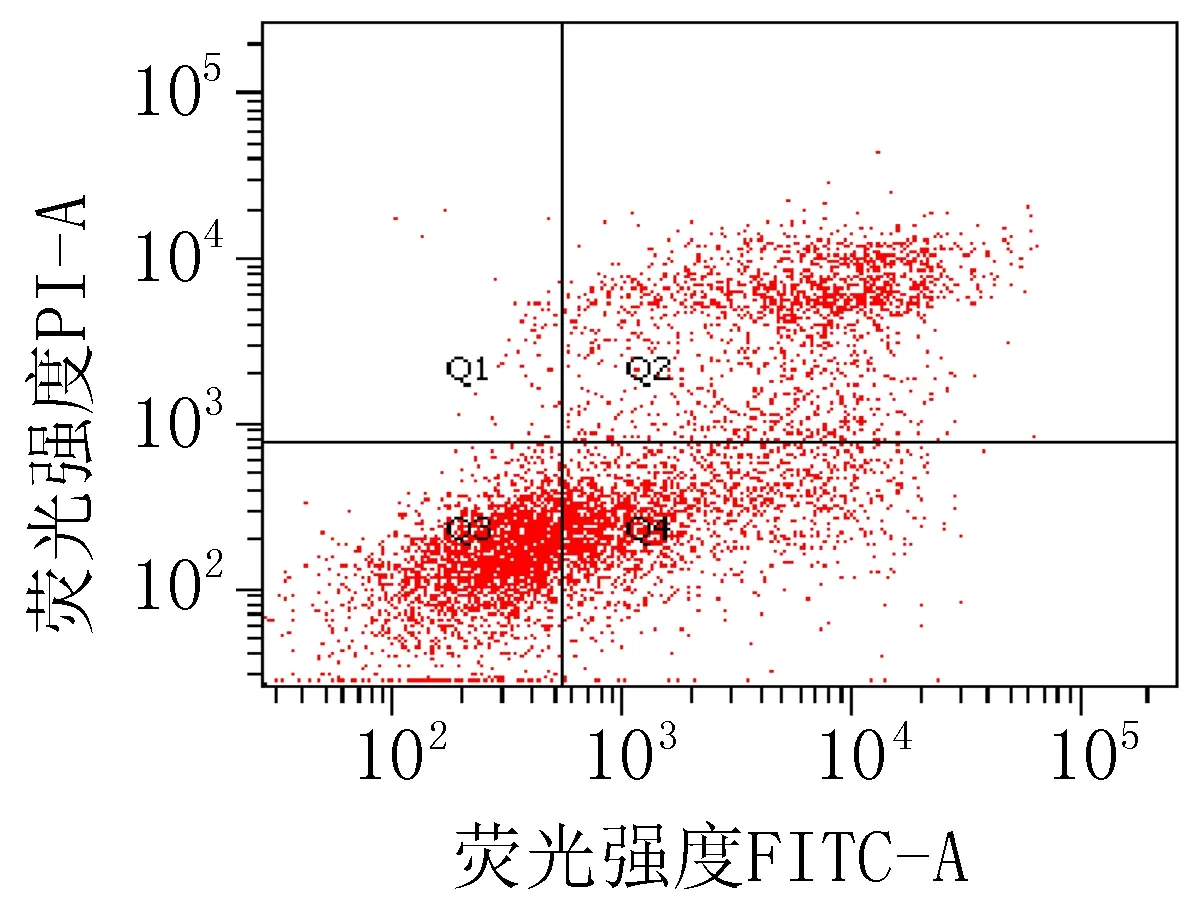
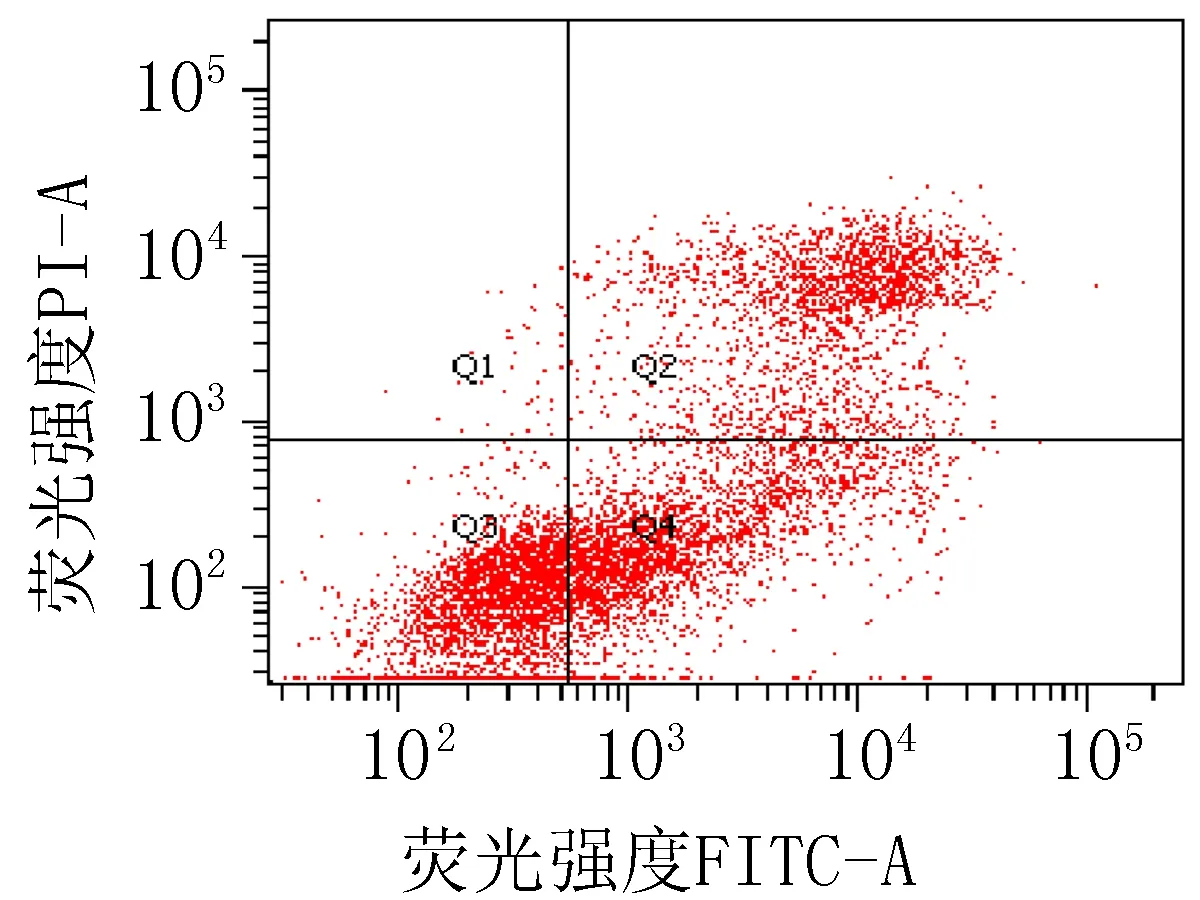
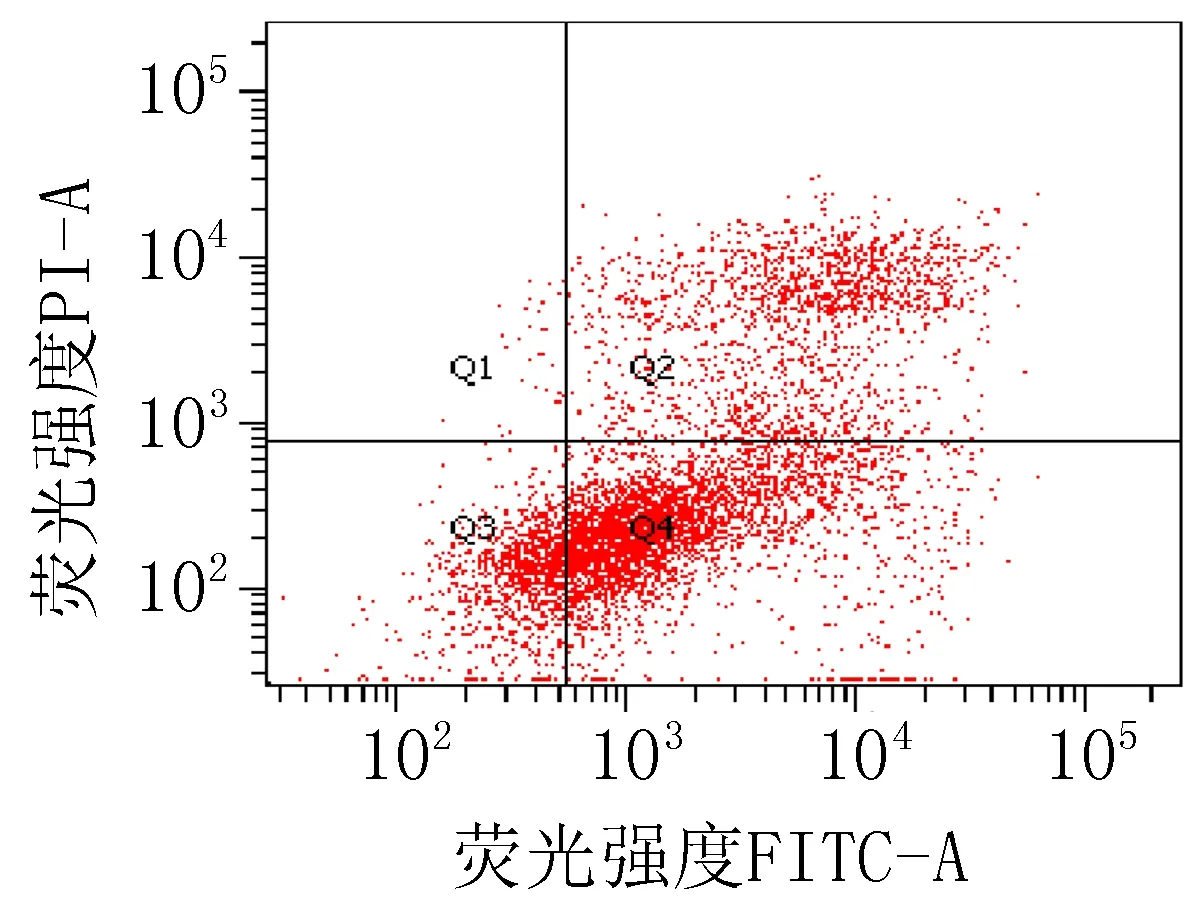
2.3 细胞凋亡实验结果衍生物3的浓度在5~40 μg/mL范围内,对SiHa细胞24 h的凋亡率为15.0%~85.6%;对HeLa细胞24 h的细胞凋亡率为23.3%~83.7%。20 μg/mL的阳性对照顺铂和空白组对SiHa细胞作用24 h的细胞凋亡率分别为47.6%和 15.4%;对HeLa细胞的凋亡率分别为42.9%和 9.70%,见图2、3和表4。
2.4 细胞周期实验结果空白组对HeLa细胞在G0/G1期为61.29%, G2/M期为8.20%。与空白组比较,HeLa细胞给药后,当衍生物3浓度从10 μg/mL 增加到30 μg/mL时,HeLa细胞在G0/G1期占比由48.01%降到3.39%,而在G2/M期占比从8.20%增加到46.22%,见图4、表5。
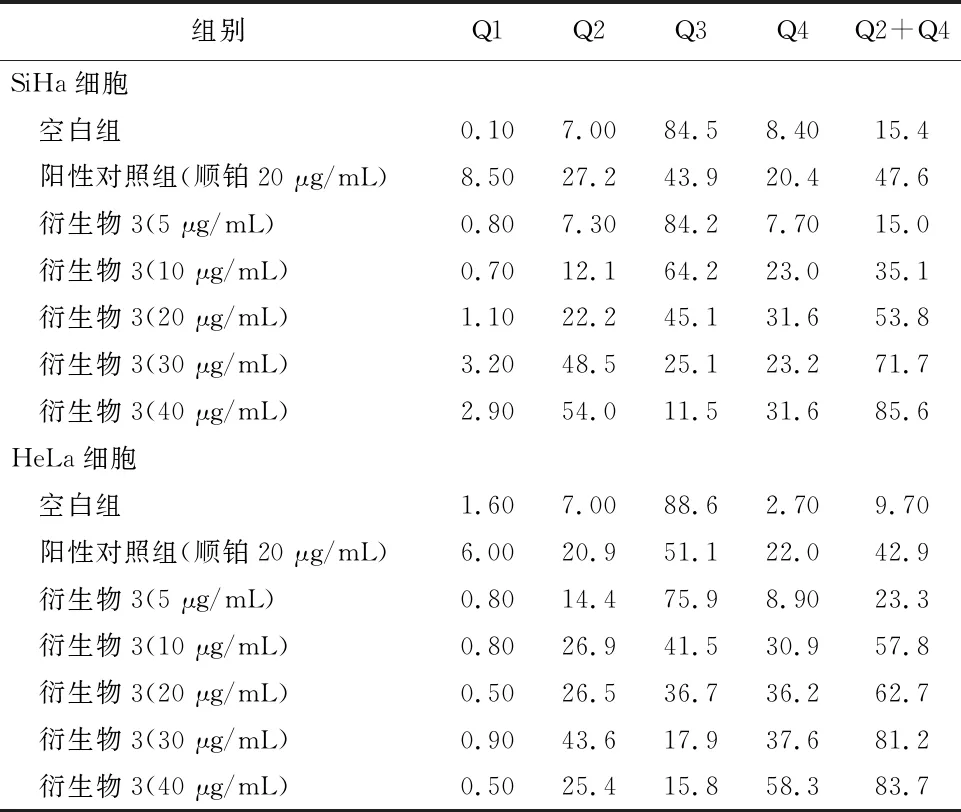
表4 衍生物3对SiHa和HeLa细胞作用24 h的促凋亡率/%
注: Q1: 机械损伤, Q2: 晚期凋亡, Q3: 正常的活细胞, Q4: 早期凋亡。
空白组
衍生物 3 (5 μg/mL)
衍生物 3 (10 μg/mL)
衍生物 3 (20 μg/mL)
衍生物 3 (30 μg/mL)
衍生物 3 (40 μg/mL)
阳性对照组 (顺铂20 μg/mL)
图2 衍生物3和阳性对照对SiHa细胞作用24 h的促凋亡作用
空白组
衍生物 3 (5 μg/mL)
衍生物 3 (10 μg/mL)
衍生物 3 (20 μg/mL)
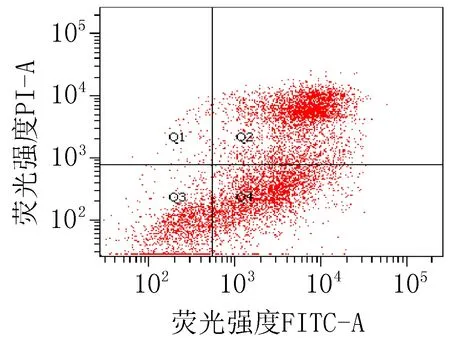
衍生物 3 (30 μg/mL)
衍生物 3 (40 μg/mL)
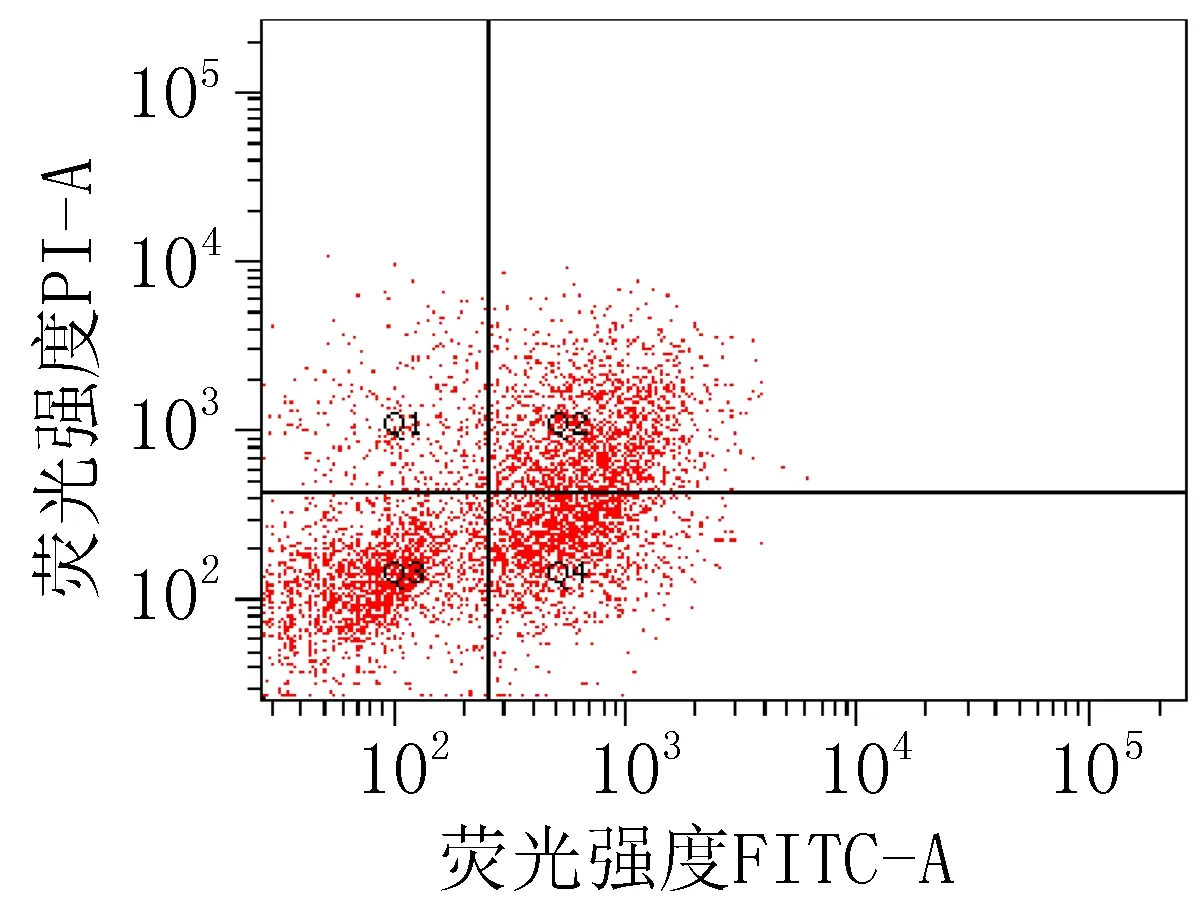
阳性对照组 (顺铂20 μg/mL)
图3 衍生物3和阳性对照对HeLa细胞作用24 h的促凋亡作用
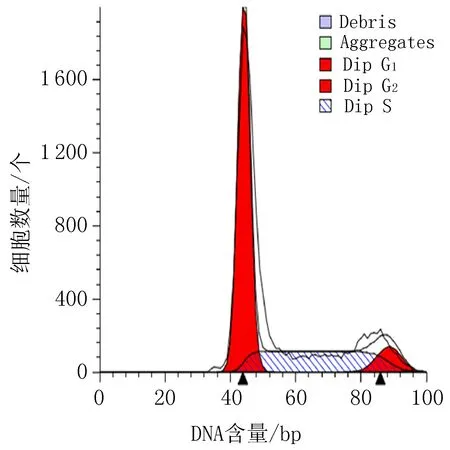
空白组
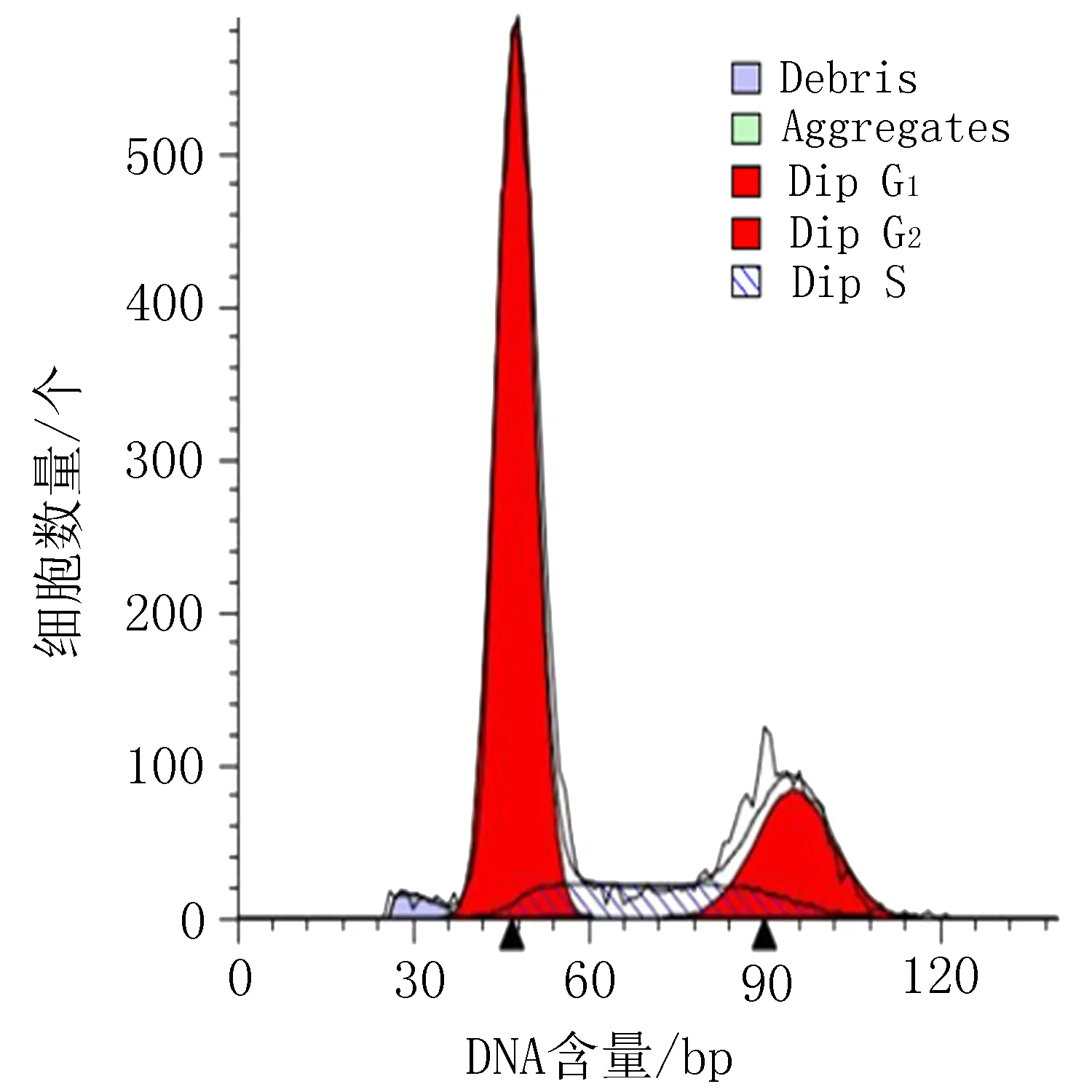
阳性对照组 (顺铂20 μg/mL)
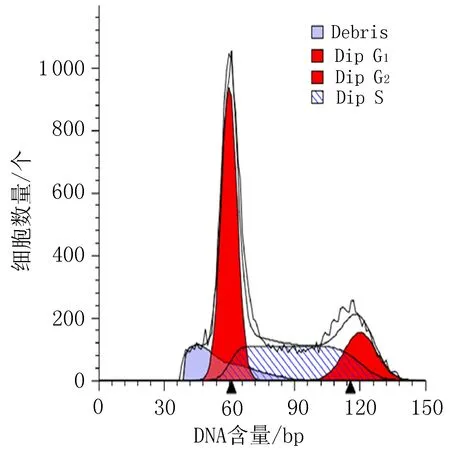
衍生物3 (10 μg/mL)
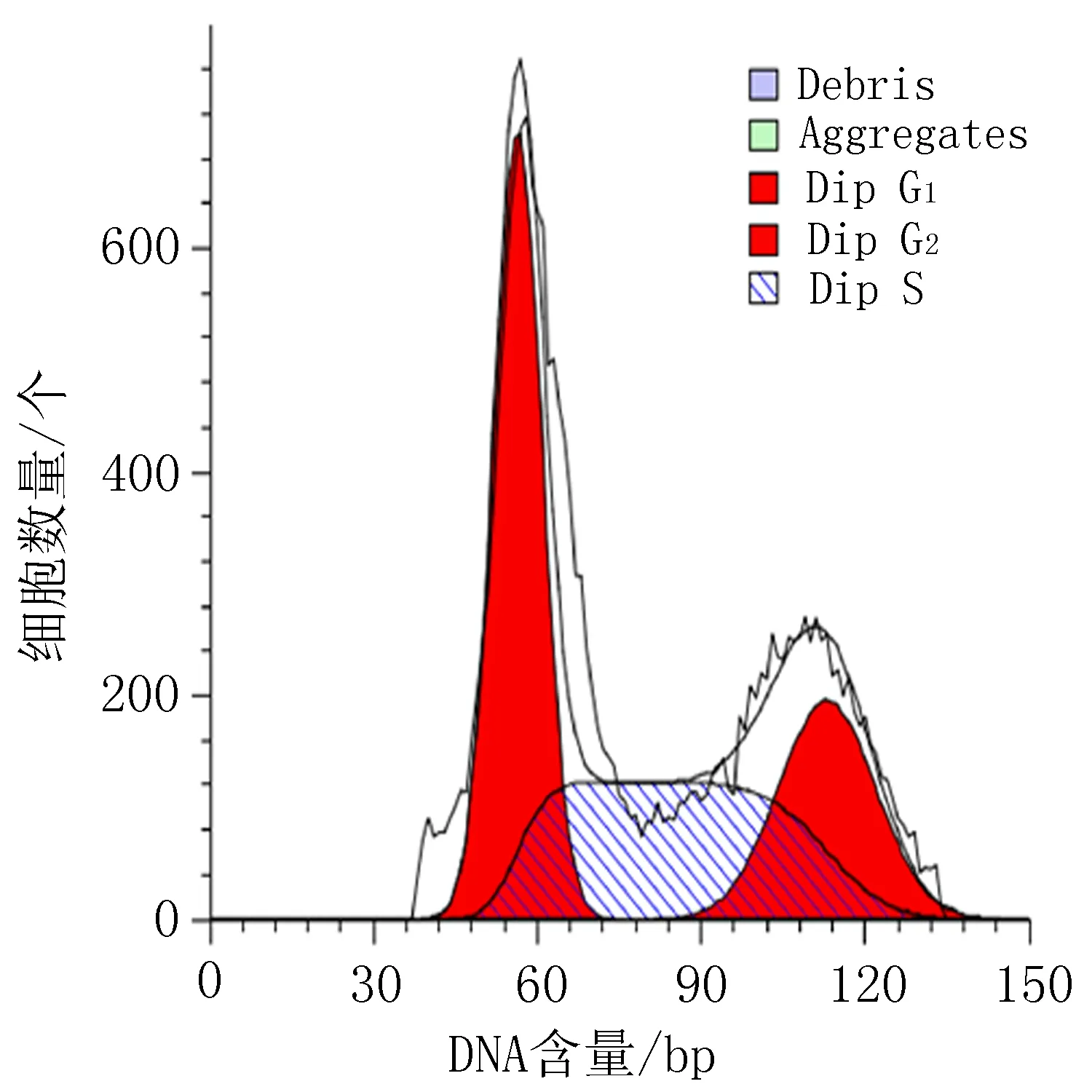
衍生物3 (20 μg/mL)
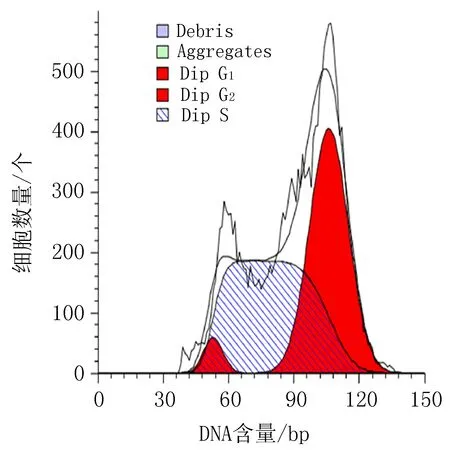
衍生物3 (30 μg/mL)
图4 衍生物3和阳性对照对HeLa细胞作用24h的细胞周期图
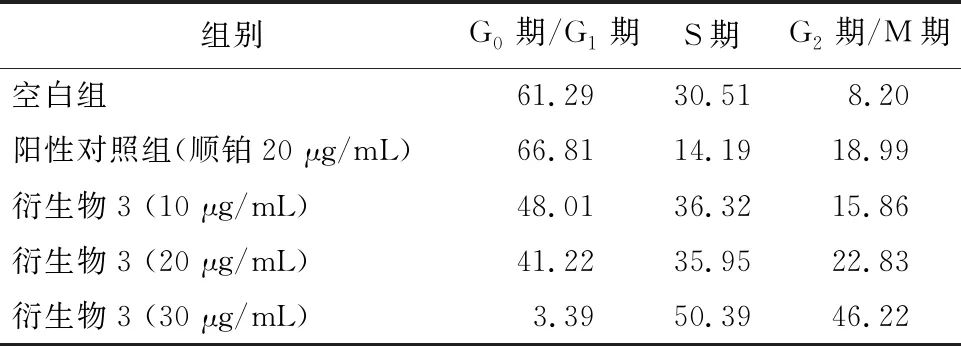
表5 衍生物3对HeLa细胞作用24 h的周期实验结果/%
3 讨论
抗癌药物的作用靶点多在细胞核内,药物有较高的脂溶性才能穿透细胞膜,进入细胞内发挥药效。本研究发现A环含2个甲氧基的查耳酮衍生物抗宫颈癌活性比仅含一个甲氧基的查耳酮衍生物更强,而且邻位甲氧基取代的活性高于间位甲氧基取代的化合物。其中化合物3与先导化合物Lico B相比,从增殖的抑制活性和促凋亡作用上均显示其活性优势。MDM2是一种p53特异性的E3泛素连接酶,也是当前癌细胞信号通路中的一种新的抗癌靶点蛋白而开始被重视。研究证实查耳酮类化合物可通过抑制此种靶点途径而产生较强的抗宫颈癌活性。本研究进一步探索Lico B的结构修饰,发现当结构中的羟基被甲氧基取代时,其抗宫颈癌活性明显提高,而且甲氧基取代的衍生物合成快,成本低,产率高,为进一步研究新型MDM2抑制剂提供了实验基础。
