补肾安胎冲剂调控VHL/HIF-1α信号通路改善复发性流产小鼠母胎界面血管生成的实验研究
2020-02-13郝乐乐李伟莉王媛中余欣慧
郝乐乐,李伟莉,吴 花,金 雅,王媛中,余欣慧
(1.安徽中医药大学,安徽 合肥 230012;2.安徽中医药大学第一附属医院妇产科,安徽 合肥 230031)
复发性流产(recurrent spontaneous abortion,RSA)指与同一性伴侣发生2次或2次以上的自然流产,是女性妊娠期主要疾病之一,病因复杂,且仍有40%患者病因不明,严重影响育龄女性的身心健康,引起RSA的原因较多, 包括先天遗传、女性解剖异常、内分泌紊乱、盆腔感染因素、男性因素、心理因素及免疫因素等, 但其确切机制尚不明确[1]。因此RSA的机制研究引起越来越多学者的关注[2-3]。有研究表明,希佩尔-林道抑癌基因(Von Hippel-Lindau, VHL)缺陷会抑制缺氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)的降解,从而升高HIF-1α的表达,引起血管内皮生长因子(vascular endothelial growth factor,VEGF)、细胞代谢等一系列改变,促进血管生成[4]。也有研究表明,补肾健脾活血法能改善子宫内环境和胎盘的微循环[5]。补肾安胎冲剂是安徽中医药大学第一附属医院的院内制剂,在寿胎丸的基础上改良而成,具有补肾健脾、养血安胎的作用,广泛应用于RSA患者的防治中,其保胎疗效确切[6-7]。但补肾安胎冲剂影响血管生成的机制尚不明确。故本研究以VHL/HIF-1α信号通路作为切入点,旨在从母胎界面血管生成角度,探讨补肾安胎冲剂的作用机制,为临床保胎应用补肾安胎冲剂提供科学依据。
1 材料
1.1 动物 健康雌性CBA/J小鼠76只,雄性DBA/2小鼠30只,BALB/C小鼠8只,小鼠体质量均为20 g左右,属于SPF级,8周龄,均购于北京华阜康实验动物有限公司[动物生产许可证号:SCXK(京)2014-0004]。所有小鼠均饲养于安徽中医药大学实验动物中心[环境温度:(24±2)℃;相对湿度:45%±5%;每日光照时间和黑夜时间均等,各12 h],自由获得水及食物,适应性饲养1周。本实验方案经安徽中医药大学实验动物伦理委员会批准。
1.2 药物 补肾安胎冲剂(每袋10 g,皖药制字BZ20080017)由安徽中医药大学第一附属医院提供;黄体酮胶囊(每粒50 mg,国药制字H20041902)由浙江仙琚制药股份有限公司提供。
1.3 试剂与仪器 ①酶联免疫吸附测定试剂盒。VHL(货号 EK-E20775R)、HIF-1α(货号 EK-E20353R):北京安迪华泰生物科技有限公司。②荧光定量PCR试剂。Trizol(批号 90803):Life technogies公司;QuantiNova SyBr Green PCR试剂盒(批号 208054):Qiagen;逆转录试剂盒(批号 00519963):Thermo Scientific。③免疫组织化学法试剂。VHL(批号 AC11253656)、HIF-1α(批号 GR196812-1):Bioss公司;通用型二抗试剂盒(批号 K136830B)、DAB显色剂(批号 K136821F)、PBS(批号 WK163307-1):北京中杉公司。④Western blot法试剂。山羊抗小鼠IgG(批号 127655)、山羊抗兔IgG(批号 129256)、β-actin(批号 17AV0303):北京中杉公司;VHL(批号 AC11253656)、HIF-1α(批号 AE120101P):Bioss公司;SDS(批号 1029H032):Solarbio;PVDF膜(批号 R8CA8257E):Millipore;ECL超敏发光试剂盒(批号 QF220648):Thermo。
RM2135切片机(Leica):德国;普通PCR仪(型号 K960);显微镜(Nikon 80i):日本;EPS300型电泳仪:Tanon;高速台式冷冻离心机(JW-3021HR):安徽嘉文仪器装备有限公司;TS-1000水平摇床、LX 300型微量离心机:海门市其林贝尔仪器制造有限公司。
2 方法
2.1 模型复制、分组及给药 按照文献[8]方法复制RSA小鼠模型和正常妊娠小鼠模型。每日凌晨5:00—6:00检查雌鼠阴道,若见阴道栓,计为妊娠第1天;若未见阴道栓,则继续合笼。共复制RSA模型小鼠50只,正常妊娠小鼠10只。将模型复制成功的RSA小鼠随机分为5组:模型组,黄体酮组,补肾安胎冲剂高、中、低剂量组,每组10只。从妊娠第1天开始给药,正常组、模型组小鼠给予等容积蒸馏水灌胃,黄体酮组小鼠以26 mg/(kg·d)黄体酮灌胃,补肾安胎冲剂高、中、低剂量组小鼠于妊娠第1天分别按35.1、11.7、3.9 g/(kg·d)灌胃。每日1次,连续15 d,末次给药24 h后处死小鼠。
2.2 胚胎丢失率的计算 肉眼观察各组孕鼠胚胎丢失情况并记录,计算胚胎丢失率。参照赵爱明等[9]的方法制定胚胎丢失的标准,记录每组孕鼠的存活胚胎数、丢失胚胎数,然后计算胚胎丢失率。胚胎丢失率=丢失胚胎数/(存活胚胎数+丢失胚胎数)×100%。
2.3 ELISA法检测外周血VHL、HIF-1α水平 从眶后静脉丛采血2 mL,4 ℃、3 000 r/min离心10 min,取上清液0.5~1 mL于试管中,-80 ℃保存。采用酶联免疫吸附测定试剂盒测定外周血中VHL、HIF-1α的含量。
2.4 采用荧光定量PCR检测VHL、HIF-1α mRNA的表达水平 运用Trizol法对小鼠蜕膜组织进行总RNA提取,然后进行逆转录操作,严格按照试剂盒说明书进行,荧光定量PCR检测VHL、HIF-1α mRNA的表达水平。以cDNA作为荧光定量的模板,引物序列见表1。

表1 引物序列
2.5 免疫组织化学法检测蜕膜组织VHL、HIF-1α表达水平 蜕膜组织石蜡切片,常规脱蜡至水,3% H2O2灭活内源性过氧化物酶,微波修复抗原。PBS液洗涤3次,滴加一抗(VHL、HIF-1α,稀释至1∶200),37 ℃孵育60 min。PBS洗涤后再滴加通用型二抗,37 ℃孵育20 min。DAB显色,复染,脱水,封片。光镜下以细胞胞浆、胞核中呈棕黄色或棕褐色为阳性对照。采用JEDR 80ID形态学图像分析系统软件(Version 1.0)对阳性反应细胞的积分光密度值(integral optical density,IOD)进行分析。
2.6 Western blot法检测蜕膜组织中VHL、HIF-1α蛋白水平 取小鼠蜕膜组织,按照总蛋白提取试剂盒说明书提取小鼠蜕膜组织总蛋白,用BCA蛋白测定试剂盒检测蛋白浓度。SDS-聚丙烯酰胺凝胶电泳将蛋白分离后转移至PVDF膜上,然后用5%脱脂奶粉溶液在摇床上室温封闭2 h,加入不同一抗VHL(稀释至1∶300)和HIF-1α(稀释至1∶300),4 ℃孵育过夜。PBST洗涤3次,加入二抗稀释液稀释辣根过氧化物酶(稀释至1∶10 000),孵育2 h。室温孵育2 h,PBST洗涤3次。使用ECL超敏发光试剂盒检测蛋白条带,最后用Image J软件分析条带灰度值,以目的条带与内参照β-actin的灰度比值表示蛋白相对表达水平。

3 结果
3.1 各组小鼠胚胎丢失率 与正常组比较,模型组小鼠胚胎丢失率显著升高(P<0.05)。与模型组比较,所有治疗组小鼠胚胎丢失率均显著下降(P<0.05);与补肾安胎冲剂低剂量组比较,补肾安胎冲剂高、中剂量组胚胎丢失率显著升高(P<0.05);黄体酮组与补肾安胎冲剂高剂量组小鼠胚胎丢失率比较,差异无统计学意义(P>0.05)。见表2。

表2 各组小鼠胚胎丢失率比较
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与黄体酮组比较,□P<0.05;与补肾安胎冲剂低剂量组比较,△P<0.05;与补肾安胎冲剂中剂量组比较,◇P<0.05
3.2 各组小鼠血清中VHL、HIF-1α含量比较 与正常组比较,模型组小鼠血清中VHL含量明显上升(P<0.05),HIF-1α含量明显下降(P<0.05);与模型组比较,所有治疗组小鼠血清中VHL含量均明显下降(P<0.05),HIF-1α含量均明显升高(P<0.05);补肾安胎冲剂高剂量组小鼠血清中VHL含量低于低、中剂量组(P<0.05),HIF-1α含量高于低、中剂量组(P<0.05)。见表3。

表3 各组小鼠血清中VHL、HIF-1α含量比较
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与黄体酮组比较,□P<0.05;与补肾安胎冲剂低剂量组比较,△P<0.05;与补肾安胎冲剂中剂量组比较,◇P<0.05
3.3 各组小鼠蜕膜VHL、HIF-1α mRNA表达水平比较 与正常组比较,模型组VHL mRNA表达水平显著升高(P<0.05),HIF-1α mRNA表达水平显著降低(P<0.05);与模型组比较,各药物治疗组VHL mRNA表达水平显著降低(P<0.05),HIF-1α mRNA表达水平显著升高(P<0.05);补肾安胎冲剂对VHL、HIF-1α mRNA表达的影响具有剂量依赖性,以补肾安胎冲剂高剂量作用最优(P<0.05)。见表4。
3.4 免疫组织化学法检测的各组小鼠蜕膜组织中VHL、HIF-1α蛋白表达水平比较 VHL、HIF-1α在各组妊娠小鼠蜕膜组织中皆有表达,主要表达于细胞的细胞浆中,除此之外在细胞核中也可见表达。见图1。与正常组比较,模型组小鼠蜕膜组织中VHL蛋白表达水平显著升高(P<0.05),HIF-1α蛋白表达水平显著降低(P<0.05);与模型组比较,各治疗组小鼠蜕膜组织中VHL蛋白表达水平显著下降(P<0.05),HIF-1α蛋白表达水平显著升高(P<0.05);补肾安胎冲剂降低模型小鼠蜕膜组织中VHL蛋白和升高HIF-1α蛋白的作用具有明显的剂量依赖性(P<0.05)。见表5。

表4 各组小鼠蜕膜VHL、HIF-1α mRNA相对表达水平比较
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与黄体酮组比较,□P<0.05;与补肾安胎冲剂低剂量组比较,△P<0.05;与补肾安胎冲剂中剂量组比较,◇P<0.05

表5 免疫组织化学法检测的各组小鼠蜕膜组织中VHL、HIF-1α蛋白表达水平比较
注:与正常组比较,*P<0.05;与模型组相比,#P<0.05;与黄体酮组比较,□P<0.05;与补肾安胎冲剂低剂量组比较,△P<0.05;与补肾安胎冲剂中剂量组比较,◇P<0.05
3.5 Western blot检测的各组小鼠蜕膜组织中VHL、HIF-1α蛋白表达水平比较 与正常组比较,模型组小鼠蜕膜组织中VHL蛋白表达水平显著升高(P<0.05),HIF-1α蛋白表达水平显著降低(P<0.05);与模型组比较,各治疗组蜕膜组织中VHL蛋白表达水平显著降低(P<0.05),HIF-1α蛋白表达水平显著升高(P<0.05);补肾安胎冲剂降低模型小鼠蜕膜组织中VHL蛋白和升高HIF-1α蛋白的作用具有明显的剂量依赖性(P<0.05)。见图2、表6。

表6 Western blot检测的各组小鼠蜕膜组织中VHL、HIF-1α蛋白表达水平比较
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与黄体酮组比较,□P<0.05;与补肾安胎冲剂低剂量组比较,△P<0.05;与补肾安胎冲剂中剂量组比较,◇P<0.05
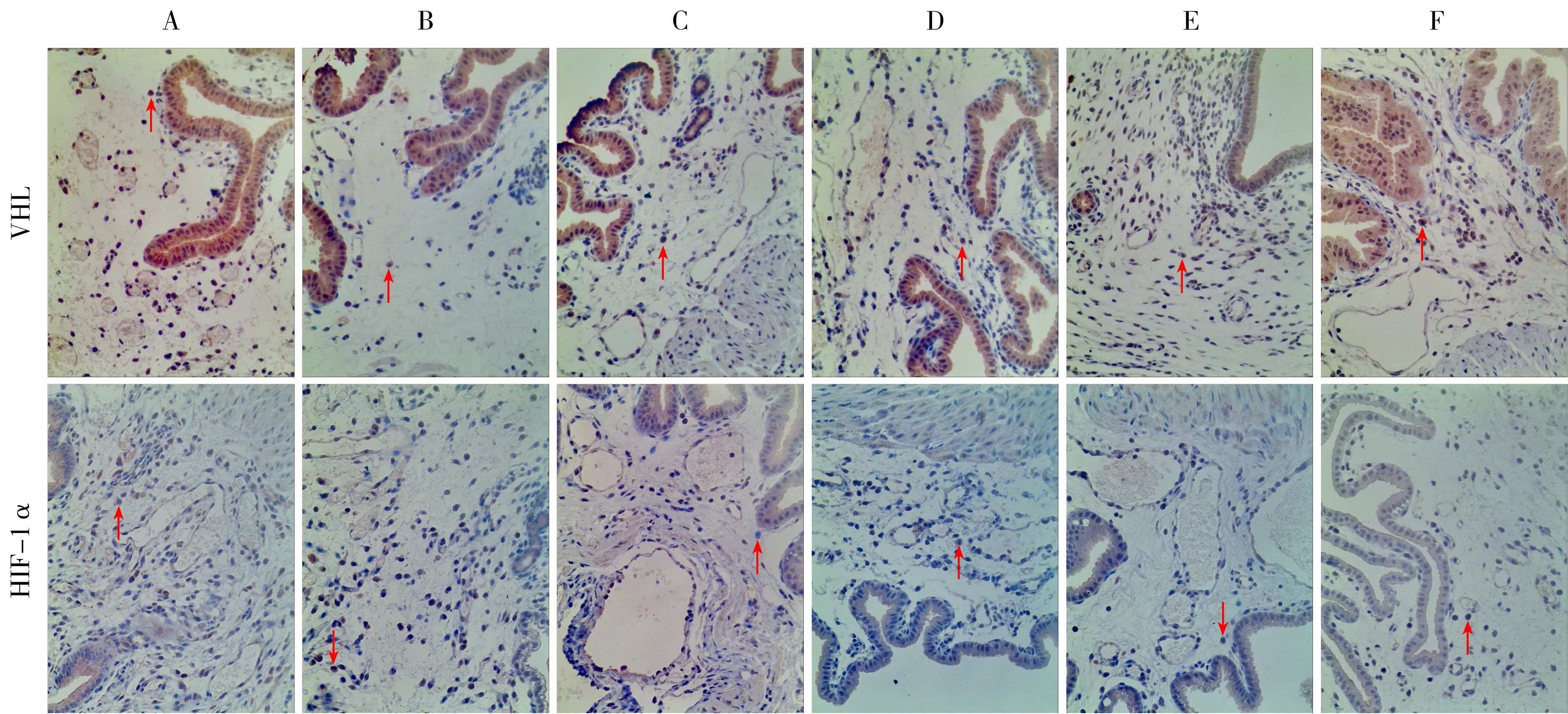
注:A.正常组;B.模型组;C.黄体酮组;D.补肾安胎冲剂低剂量组;E.补肾安胎冲剂中剂量组;F.补肾安胎冲剂高剂量组;箭头所示棕黄色或棕褐色颗粒是VHL、HIF-1α蛋白
图1各组小鼠蜕膜组织中VHL、HIF-1α蛋白表达水平比较(免疫组织化学法,10×20倍)
注:A.正常组;B.模型组;C.黄体酮组;D.补肾安胎冲剂低剂量组;E.补肾安胎冲剂中剂量组;F.补肾安胎冲剂高剂量组
图2Westernblot法检测各组小鼠蜕膜组织中VHL、HIF-1α蛋白表达水平
4 讨论
RSA属于中医“滑胎”范畴,是妊娠期的一种常见疾病,RSA主要是由“脾肾气血两虚”所致。目前对于RSA的治疗,中医主要通过补肾健脾法进行治疗。《胎产指南》指出:“凡孕妇脾胃旺而血气充,则胎安而正。”脾气主升,气能载胎,中气升提有力,胎儿正常发育而不致堕胎。《傅青主女科》指出:“肾水足而胎安,肾水亏而胎动。”肾主固胎,肾气盛则孕后胞脉固胎有力,使胎无下坠之虑,说明胎儿生长发育全赖母体之肾所系,脾胃化生之气血所养,气以载之,冲任以固之。补肾安胎冲剂是基于此理论的一种经验性复方,主要由菟丝子、桑寄生、续断、黄芪、白术、黄芩等药物组成,具有补肾健脾、养血安胎的作用。菟丝子能补肾,肾旺自能荫胎;桑寄生能养血,强筋骨,使胎气强壮;续断亦为补肾要药;黄芪、白术配伍,健脾益气安胎;白术、黄芩为安胎圣药,白术健脾除湿,黄芩滋阴清热,合而用之养血健脾,清化湿热,以安胎气。
HIF-1是一种异源二聚体,主要由HIF-1α和HIF-1β两个亚单位组成。HIF-1α作为唯一的活性亚基,能调节多种基因的表达,如参与红细胞生成、血管形成等生物学效应,同时还对胚胎及胎盘发育起重要作用[10]。有研究[11-12]表明,HIF-1α通过诱导或调控血管生成相关基因促进血管新生,如增加VEGF等细胞因子的分泌从而调控动物对缺血反应的适应。VHL是一种蛋白质编码基因,参与HIF的泛素化和降解[13]。有研究[14]表明,VHL的关键组成部分E3连接酶复合体可泛素化和降解HIF-1α,当VHL蛋白失活会抑制E3连接酶复合体,从而上调HIF-1α的表达水平,过量的HIF-1α会积聚于细胞内,激活其靶基因转录,间接启动VEGF、Notch和PI3K/AKT/mTOR等信号通路,激活缺血传导途径,促使肿瘤血管新生及肿瘤细胞的增殖。另有研究[15-16]表明,VHL/HIF-1α信号通路对胚胎的发育和机体组织的生长等均有重要的调控作用。因此,本研究进一步从微观角度探讨经补肾安胎冲剂干预后,VHL、HIF-1α蛋白表达及这一信号通路在RSA过程中的作用。
CBA/J×DBA/2交配组合具有易患反复自然性流产的特点,可以用作研究反复自然性流产的动物模型[17]。因此,本研究采用CBA/J×DBA/2交配组合经典反复流产小鼠模型,观察补肾安胎冲剂对RSA小鼠胚胎丢失率、血清和蜕膜组织中VHL、HIF-1α表达的影响。结果发现,与正常组比较,模型组RSA小鼠胚胎丢失率高,血清中VHL含量升高,HIF-1α含量降低;蜕膜组织中VHL mRNA及蛋白表达水平升高,HIF-1α mRNA及其蛋白表达水平下降。经药物干预后,RSA小鼠胚胎丢失率降低;血清VHL含量和蜕膜组织中VHL mRNA及其蛋白表达水平明显降低,血清HIF-1α含量和蜕膜组织中HIF-1α mRNA及其蛋白表达水平明显增加,其中补肾安胎冲剂高剂量组效果最为显著。因此可以推测,补肾安胎冲剂可能是通过VHL/HIF-1α信号通路诱导RSA小鼠胎盘血管的形成,降低胚胎丢失率,从而达到保胎的效果。因此,补肾安胎冲剂可以作为一种潜在的、有益的中药复方制剂,用于RSA的预防和治疗中。
