表儿茶素对四氯化碳诱导肝纤维化大鼠的干预作用
2020-02-13王玉涵谢忠稳李庆林
王玉涵,展 凡,程 卉,郑 凤,谢忠稳,李庆林
(1.安徽中医药大学科研实验中心 新安医学教育部重点实验室,安徽 合肥 230038; 2.安徽农业大学茶树生物资源与利用国家重点实验室,安徽 合肥 230031)
肝纤维化是对慢性肝损伤的创伤愈合反应,是大多数慢性肝病的一个主要特征,反映了肝脏修复与瘢痕形成之间的平衡[1]。随着损伤时间的延长,肝纤维化可发展为过度瘢痕和器官衰竭,如肝硬化和原发性肝癌,严重威胁人类健康[2]。在此过程中,细胞外基质(extracellular matrix,ECM)合成增加,降解减少而使得ECM过度沉积;肝纤维化中多种细胞类型被认为是ECM的来源,而肝星状细胞是肝损伤后产生ECM的主要细胞。目前为止,虽然治疗肝纤维化的药物种类繁多[3],但大多数药物的不良反应大,治疗效果不理想。近年来,中药治疗肝纤维化成为研究的热点[4-5]。表儿茶素属黄烷醇类化合物,广泛存在于茶叶、可可、葡萄等植物中,也可见于多种中药如儿茶、山楂、何首乌、钩藤[6-8]。大量研究表明,表儿茶素具有抗氧化、抗炎及神经保护等多种药理活性[9-11]。Cheng H等[12]研究表明,表儿茶素对非酒精性脂肪肝具有明显的预防作用。但是表儿茶素干预肝纤维化的作用及其机制目前尚未见研究报道。本研究通过腹腔注射四氯化碳(CCl4)建立大鼠肝纤维化模型,观察表儿茶素对大鼠肝纤维化的影响,为表儿茶素的应用提供可能的理论依据。
1 材料与仪器
1.1 实验动物 SPF级雄性SD大鼠,体质量180~220 g,购自北京维通利华实验动物技术有限公司[动物生产许可证号:SCXK(京)2016-0011]。
1.2 药物与试剂 表儿茶素(纯度>98.0%,C15H14O6,MW=290.27):南京植佰萃生物科技有限公司;阳性对照药为秋水仙碱(批号 20150312)、CCl4(批号 20181010):北京国药集团;苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒(批号 20181222)、Masson染色试剂盒(批号 201910103)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)检测试剂盒(批号 20190111)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)检测试剂盒(批号 20190112):南京建成生物工程研究所;平滑肌肌动蛋白(alpha smooth muscle actin,α-SMA)抗体(E-AB-34268)、Ⅰ型胶原(typeⅠcollagen,collα1)抗体(E-AB-70008):武汉伊莱瑞特生物科技有限公司。
1.3 主要仪器 低速离心机:德国Eppendorf公司;多功能酶标仪:美国MD公司;凝胶成像系统:美国ProteinSimple;电子精密天平:奥多利斯科学仪器有限公司;倒置显微镜:日本OLYMPUS公司。
2 方法
2.1 动物模型的复制、分组及给药 根据马冬梅等[13]的方法复制肝纤维化大鼠模型。雄性SD大鼠80只,SPF级。实验室饲养1周后,随机分为6组,分别为正常对照组、模型组(CCl4)、秋水仙碱组(CCl4+秋水仙碱)、表儿茶素高剂量组、表儿茶素低剂量组,组间大鼠体质量差异无统计学意义。正常对照组10只,其余每组14只,除正常对照组腹腔注射橄榄油溶液外,其余各组大鼠腹腔注射30% CCl4橄榄油复制肝纤维化模型,首次3 mL/kg,以后每次2 mL/kg,每周2次,连续6周,直至动物处死前一天。模型复制次日开始灌胃给药,秋水仙碱组按照每日0.1 mg/kg的剂量给予秋水仙碱;表儿茶素高剂量组按照每日100 mg/kg的剂量灌胃给予表儿茶素;表儿茶素低剂量组按照每日25 mg/kg的剂量灌胃给予表儿茶素;正常对照组和模型组给予同容积生理盐水,每日1次,持续6周,末次给药后禁食不禁水24 h,大鼠麻醉后腹主动脉取血,离心分离血清,-20 ℃保存。各组大鼠处死后取肝脏,称量肝湿质量,切取肝左叶边缘相同部位置于10%甲醛溶液固定,用作组织病理学观察,另一部分于-80 ℃保存。
2.2 计算肝脏指数 肝脏指数计算公式:肝脏指数=肝脏质量/大鼠体质量×100%。
2.3 血清ALT和AST水平测定 离心分离血清,按照ALT及AST试剂盒上说明,微板法检测大鼠血清中ALT及AST含量,评价大鼠肝功能。
2.4 肝脏组织病理学观察 用10%中性甲醛固定肝脏后,经梯度浓度乙醇常规脱水、二甲苯透明,石蜡包埋、切成4 μm厚的病理组织片后,常规HE染色,评价肝组织病理学状态。Masson染色,观察肝脏纤维化程度。
2.5 Western blot法检测肝脏中α-SMA、collα1蛋白的表达水平 将肝组织切成小块,在冰上用放射免疫沉淀分析(radio-immunoprecipitation assay,RIPA)裂解液提取蛋白。在4 ℃以12 000 r/min离心样品10 min。通过聚氰基丙烯酸正丁酯(bicinchoninic acid,BCA)蛋白质测定试剂盒测量总蛋白质的浓度。通过十二烷基磺酸钠(sodium dodecyl sulfate,SDS)-聚丙烯酰胺凝胶电泳分离肝组织裂解物样品,然后转移到硝酸纤维素膜(nitrocellulose filter membrane,NC)上。在一抗(1∶1 000)与4 ℃温育过夜后,将膜洗涤3次,然后与二抗温育2 h。通过三羟甲基氨基甲烷-盐酸缓冲盐溶液和吐温(tris-buffered saline and tween 20,TBST)将膜洗涤3次并分析定量。目的蛋白的灰度值除以内参的灰度值以校正误差,所得结果代表某样品的目的蛋白相对表达量。

3 结果
3.1 表儿茶素对肝纤维化大鼠肝脏指数的影响 与正常对照组相比,模型组大鼠肝脏指数明显增加,差异有统计学意义(P<0.05);与模型组相比,表儿茶素各剂量组、秋水仙碱组大鼠的肝脏指数显著降低,差异有统计学意义(P<0.05),但表儿茶素各剂量组与秋水仙碱组相比,差异无统计学意义(P>0.05),提示表儿茶素具有改善肝脏指数的作用。见图1。

注:A.正常对照组;B.模型组;C.秋水仙碱组;D.表儿茶素高剂量组;E.表儿茶素低剂量组;与正常对照组比较,#P<0.05,与模型组比较,*P<0.05
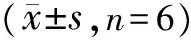
3.2 表儿茶素对大鼠肝功能的影响 与正常对照组相比,模型组大鼠血清中ALT和AST活性显著升高(P<0.05);与模型组相比,表儿茶素各剂量组、秋水仙碱组大鼠血清中ALT和AST的水平显著降低(P<0.05),但表儿茶素各剂量组与秋水仙碱组相比,差异无统计学意义(P>0.05),提示表儿茶素具有改善大鼠肝功能的作用。见图2。
3.3 表儿茶素对肝组织形态的影响 HE染色结果(见图3)显示:正常对照组大鼠肝小叶结构清晰完整,肝索排列整齐,呈放射状排列,肝细胞大小均匀,无炎症细胞变性及坏死。模型组大鼠肝小叶结构紊乱,肝的正常结构遭到破坏,肝细胞出现气球样变,可见明显坏死的肝细胞及大量炎症细胞浸润,肝汇管区出现胶原纤维沉积。秋水仙碱组和表儿茶素高、低剂量组大鼠肝细胞损伤程度均有明显减轻,且秋水仙碱组和表儿茶素高剂量组效果较好,肝细胞脂肪变性及坏死显著减少,细胞炎症明显减轻。Masson染色结果(见图4)显示,正常对照组大鼠肝小叶结构正常,仅在中央静脉及汇管区有极少量胶原纤维存在。模型组大鼠肝脏汇管区有大量粗大的胶原纤维增生,呈宽带状增生的胶原纤维形成条索状纤维分隔,导致正常的肝小叶结构被破坏,形成了假小叶。秋水仙碱组及表儿茶素高、低剂量组肝组织中胶原纤维显著减少,肝小叶结构也有不同程度的恢复,且秋水仙碱组和表儿茶素高剂量组恢复较为显著。

注:A.正常对照组;B.模型组;C.秋水仙碱组;D.表儿茶素高剂量组;E.表儿茶素低剂量组;与正常对照组比较,#P<0.05,与模型组比较,*P<0.05
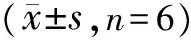
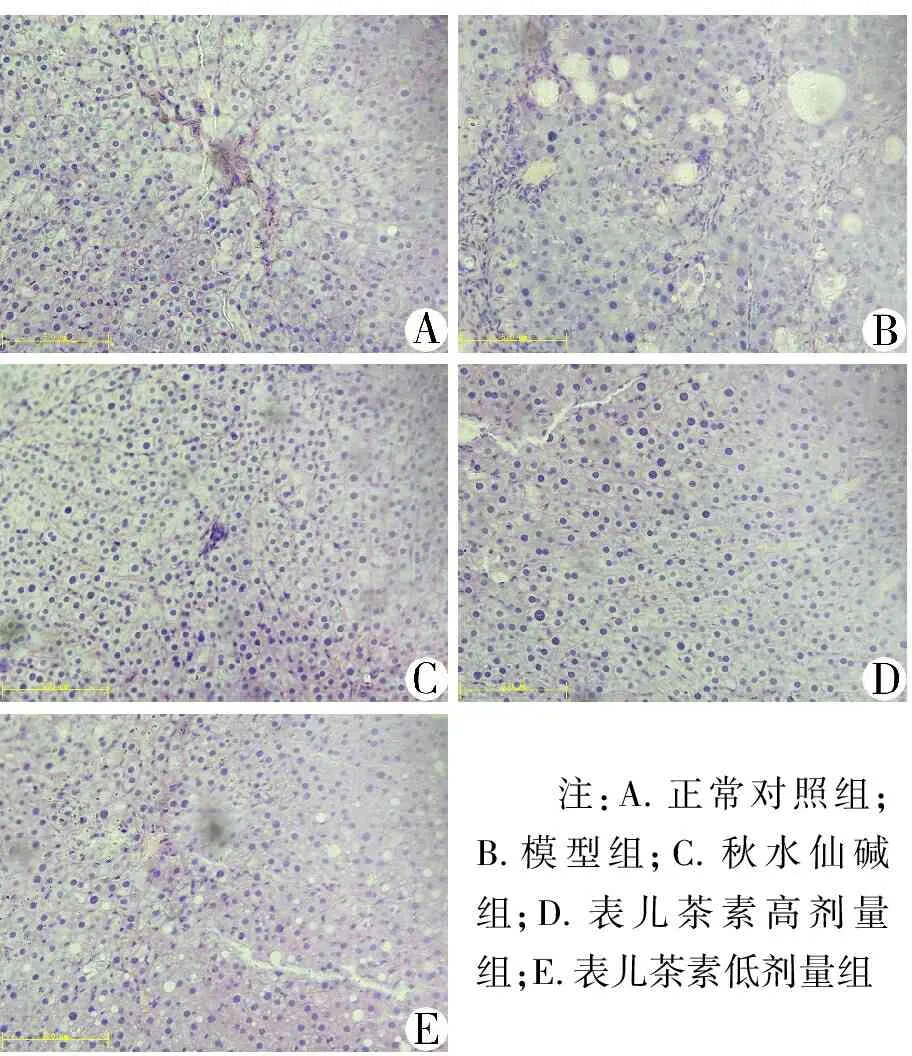
注:A.正常对照组;B.模型组;C.秋水仙碱组;D.表儿茶素高剂量组;E.表儿茶素低剂量组
图3各组大鼠肝组织形态变化(HE染色,10×40倍)
3.4 表儿茶素对大鼠肝脏中α-SMA、collα1蛋白表达的影响 与正常对照组比较,模型组大鼠肝组织中α-SMA、collα1蛋白的相对表达量均显著升高,差异均有统计学意义(P<0.05);与模型组比较,表儿茶素高、低剂量组和秋水仙碱组大鼠肝组织中α-SMA、collα1蛋白的相对表达量均显著降低,差异均有统计学意义(P<0.05);另外,与秋水仙碱组比较,表儿茶素低剂量组大鼠肝组织中α-SMA、collα1蛋白的相对表达量显著升高,且差异具有统计学意义(P<0.05),而表儿茶素高剂量组与秋水仙碱组的差异无统计学意义(P>0.05),提示表儿茶素能够降低大鼠肝组织中α-SMA、collα1蛋白的相对表达水平,且表儿茶素高剂量组的效果较明显。见图5、图6。
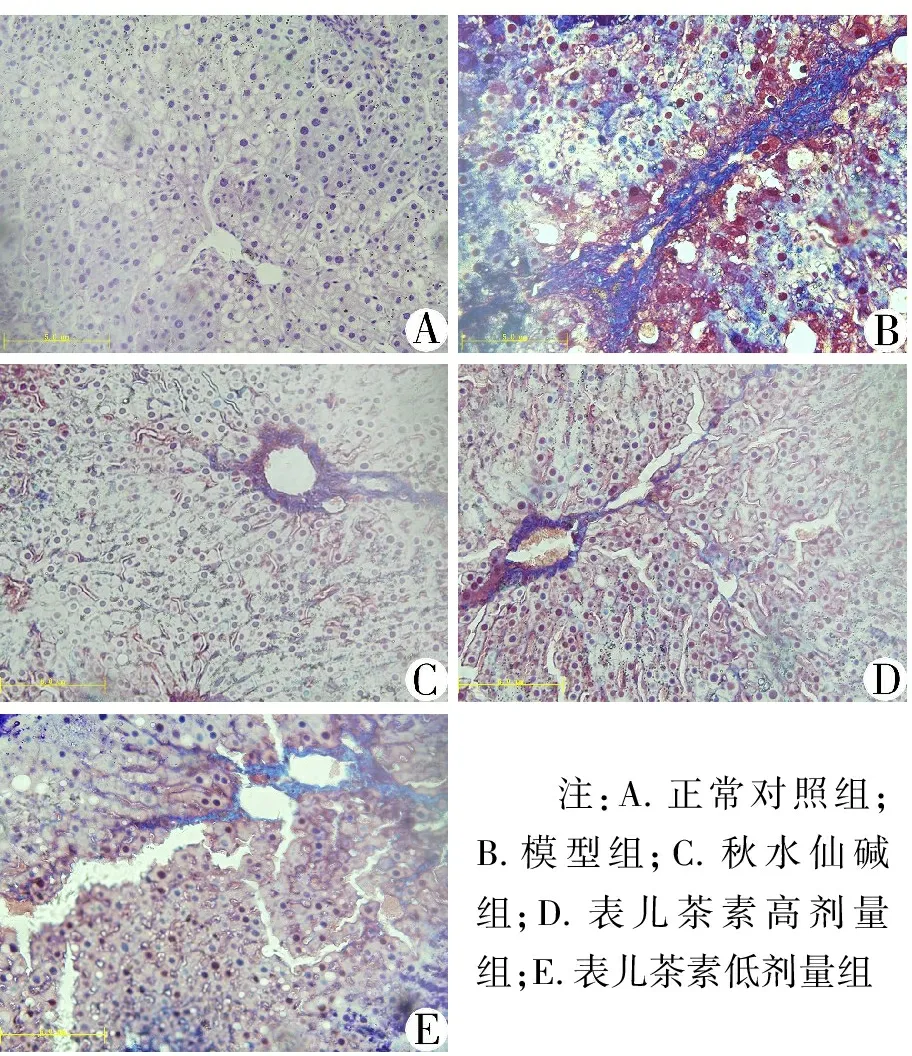
注:A.正常对照组;B.模型组;C.秋水仙碱组;D.表儿茶素高剂量组;E.表儿茶素低剂量组
图4各组大鼠肝组织形态变化(Masson染色,10×40倍)

注:A.正常对照组;B.模型组;C.秋水仙碱组;D.表儿茶素高剂量组;E.表儿茶素低剂量组
图5Westernblot法检测肝脏中α-SMA、
collα1蛋白表达水平
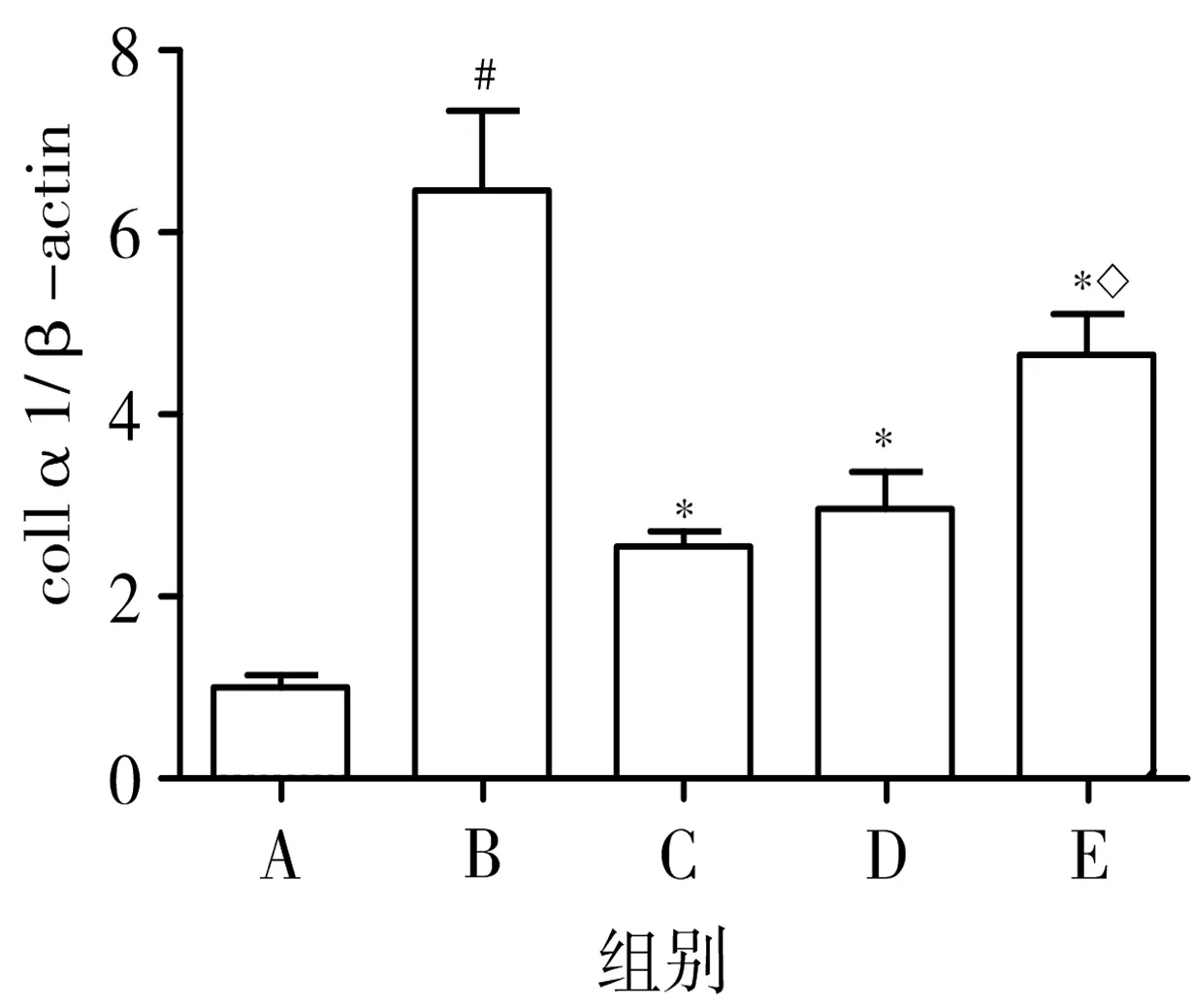
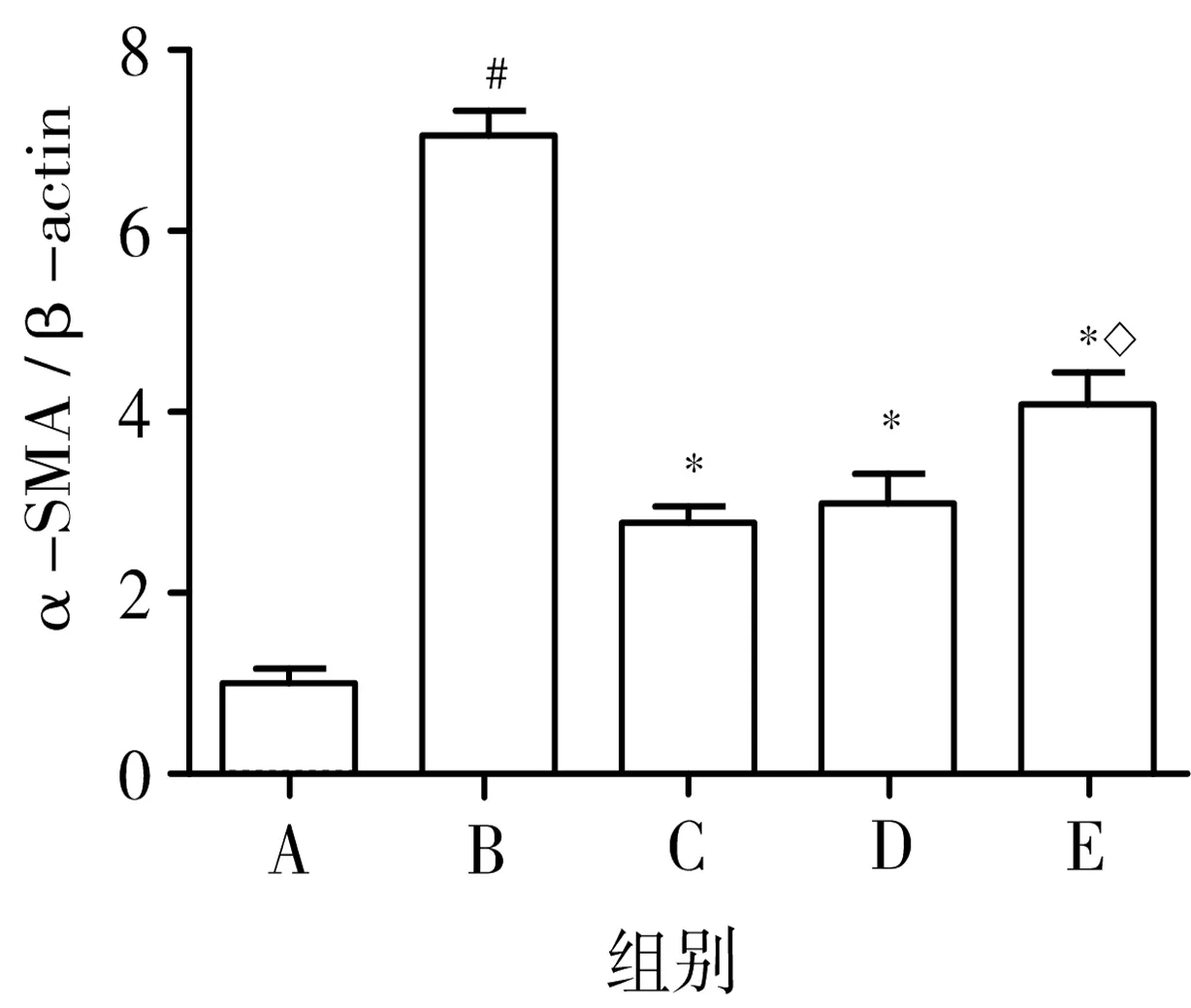
注:A.正常对照组;B.模型组;C.秋水仙碱组;D.表儿茶素高剂量组;E.表儿茶素低剂量组;与正常对照组比较,#P<0.05;与模型组比较,*P<0.05;与秋水仙碱组比较,◇P<0.05

4 讨论
肝纤维化是机体对各种致病因子引起肝脏持续性损伤后,肝组织自我修复的代偿反应,是各种慢性肝病的共同病理过程,也是向肝硬化发展的中间环节[14]。现代医学研究表明,在肝纤维化早期进行干预,可延缓肝纤维化进程,减轻肝纤维化程度;若得不到有效治疗,肝纤维化最终会发展为肝硬化甚至肝癌,严重威胁人类健康。
CCl4是一种经典的肝毒性试剂,常被用来诱导大鼠肝纤维化模型,具有重复性好、操作简单的特点。CCl4进入肝细胞后,可直接被肝细胞膜溶解,并在肝细胞内质网中通过肝细胞中细胞色素P450酶代谢为活泼的自由基后,发生脂质过氧化反应,导致肝细胞损伤[15]。当肝细胞受到损伤时,肝细胞发生变性、坏死,造成细胞内容物溢出,存在于胞质内的ALT、AST被释放进入血液,因此,血清中ALT、AST的水平可作为评估肝脏受损伤的程度[16]。本研究表明,模型组大鼠血清ALT、AST水平显著高于正常对照组,而表儿茶素组大鼠血清ALT、AST水平显著低于模型组,表明表儿茶素可明显改善大鼠肝功能。病理学检测结果也显示,表儿茶素能够抑制胶原纤维的生成和沉积,对CCl4诱导的肝纤维化大鼠具有明显的保护作用。
肝纤维化一个最显著的特征就是ECM的过度沉积,特别是α-SMA和collα1[17-18]。当肝脏受到持续性损伤时,肝星状细胞经历了一个从静息状态的储脂细胞到具有高度分化和合成更多的α-SMA、collα1等ECM的肌成纤维细胞的转化[19-20]。α-SMA也被认为是肝星状细胞激活的标志,在正常情况下,α-SMA仅在血管壁表达,发生肝纤维化时,α-SMA表达明显增加,在假小叶及纤维纵隔内有大量表达。通过测定肝脏组织中α-SMA、collα1蛋白的表达,可以从分子水平揭示肝纤维化的形成过程。本研究结果显示,与正常对照组相比,模型组大鼠肝组织中α-SMA和collα1蛋白表达水平明显升高,导致ECM过度沉积,形成肝纤维化;经过表儿茶素干预后的大鼠,其肝组织中α-SMA和collα1蛋白表达水平明显降低,表明表儿茶素可能通过抑制α-SMA和collα1的表达干预肝纤维化的进程。
综上所述,本研究初步表明,表儿茶素对CCl4诱导的大鼠肝纤维化具有显著的改善作用,其作用机制可能与抑制α-SMA和collα1有关。
